紫蘇葉多糖對糖尿病模型小鼠胰腺組織氧化應激及PI3K/AKT/GLUT4信號通路的影響
孫廣平 袁麗 方曉琳 楊海波

摘 要 目的:研究紫蘇葉多糖對糖尿病(DM)模型小鼠胰腺組織氧化應激及磷酸肌醇-3-激酶(PI3K)/蘇氨酸蛋白激酶(AKT)/葡萄糖轉運蛋白4(GLUT4)信號通路的影響。方法:取60只小鼠,采用腹腔注射鏈脲佐菌素(60 mg/kg)的方法復制糖尿病模型。將造模成功的40只小鼠隨機分為模型組、二甲雙胍組(陽性對照,200 mg/kg)和紫蘇葉多糖高、低劑量組(400、200 mg/kg),每組10只;另取10只健康小鼠作為正常組(生理鹽水)。每天灌胃給藥1次,連續給藥28 d。實驗期間,觀察小鼠一般狀況和體質量變化;進行口服葡萄糖耐量(OGTT)實驗[測定灌胃40%葡萄糖溶液0、30、60、120 min后的空腹血糖(FBG)水平]。末次給藥后,測定小鼠血糖相關指標[FBG、空腹胰島素(FINS)和胰島素敏感指數(ISI)、胰島素抵抗指數(IRI)]、血脂相關指標[血清中高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、總膽固醇(TC)、三酰甘油(TG)]和氧化應激相關指標[胰腺組織中丙二醛(MDA)含量和超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)活性]的變化,并測定小鼠胰腺組織中PI3K、磷酸化AKT(p-AKT)和GLUT4蛋白表達水平。結果:實驗期間,與正常組比較,模型組小鼠行動遲緩,飼料消耗量和飲水量增多,體質量顯著增加(P<0.05);給予葡萄糖0、30、60、120 min后,小鼠的FBG水平均顯著升高(P<0.05);末次給藥后,血清中FINS、HDL-C含量和ISI以及胰腺組織中SOD、CAT、GSH-Px活性和PI3K、p-AKT、GLUT4蛋白表達水平均顯著降低(P<0.05),而血清中FBG、LDL-C、TC、TG含量和IRI以及胰腺組織中MDA含量均顯著升高(P<0.05)。與模型組比較,各給藥組小鼠一般情況和OGTT情況均有好轉;血清中FINS、HDL-C含量和ISI以及胰腺組織中SOD、CAT、GSH-Px活性和PI3K、p-AKT、GLUT4蛋白表達水平均顯著升高(P<0.05),而血清中FBG、LDL-C、TC、TG含量和IRI以及胰腺組織中MDA含量均顯著降低(P<0.05)。結論:紫蘇葉多糖具有抗糖尿病作用,該作用可能與降低氧化應激水平和促進PI3K/AKT/GLUT4信號通路的活化有關。
關鍵詞 紫蘇葉多糖;氧化應激;PI3K/AKT/GLUT4信號通路;糖尿病;小鼠
ABSTRACT? ?OBJECTIVE: To study the effects of Purple frutescens leaves polysaccharides (PPLPs) on oxidative stress and PI3K/AKT/GLUT4 signaling pathway of pancreatic tissues in diabetes mellitus (DM) model mice. METHODS: Totally 60 mice were given intraperitoneal injection of STZ (60 mg/kg) to induce DM model. The 40 successful modeling mice were randomly divided into model group, metformin group (positive control, 200 mg/kg), PPLPs high-dose and low-dose groups (400, 200? ? ?mg/kg), with 10 mice in each group. Another 10 healthy mice were selected as the normal group (normal saline). They were given relevant medicine intragastrically, once a day, for consecutive 28 days. During the experiment, general information and body weight of mice were observed; oral glucose tolerance (OGTT) test (determining FBG at 0, 30, 60, 120 min after giving 40% glucose solution) was conducted. After last medication, the changes of related blood glucose indexes (FBG, FINS, ISI, IRI), blood lipid indexes (HDL-C, LDL-C, TC, TG) and oxidant stress indexes (MDA content and the activities of SOD, CAT, GSH-Px) as well as the protein expressions of PI3K, p-AKT and GLUT4 in pancreatic tissue were determined. RESULTS: During the experiment, compared with normal group, the mice were slow in action, the feed consumption and water consumption increased, and body weight significantly increased in model group (P<0.05). 0, 30, 60, 120 min after giving glucose, the FBG content of mice were all increased significantly (P<0.05). After last medication, the contents of FINS and HDL-C in serum as well as ISI, the activities of SOD, CAT and GSH-Px as well as the protein expressions of PI3K, p-AKT and GLUT4 in pancreatic tissue were all decreased significantly (P<0.05); the contents of FBG and LDL-C, TC and TG in serum as well as IRI, MDA content in pancreatic tissue were all increased significantly (P<0.05). Compared with model group, the general condition and OGTT of mice in each administration group was improved; the contents of FINS and HDL-C in serum as well as ISI, the activities of SOD, CAT and GSH-Px as well as the protein expressions of PI3K, p-AKT and GLUT4 in pancreatic tissue were all increased significantly (P<0.05); the contents of FBG, LDL-C, TC and TG in serum as well as IRI, MDA content of pancreatic tissue were decreased significantly (P<0.05). CONCLUSIONS: PPLPs has anti-diabetic effects, which are related to reducting oxidative stress level and promoting the activation of PI3K/AKT/GLUT4 signaling pathway.
KEYWORDS? ?Purple frutescens leaves polysaccharides; Oxidative stress; PI3K/AKT/GLUT4 signaling pathway; Diabetes; Mice
糖尿病在當前世界范圍內呈現廣泛流行趨勢,已成為威脅人類健康的最重要的慢性非傳染性疾病之一[1]。國際糖尿病聯盟2019年的統計數據表明,全球糖尿病患者人數已高達4.63億人,而到2045年這一數據將增長至7億人[2]。糖尿病患病率的日益增長給社會帶來了沉重的負擔。雙胍類、葡萄糖苷酶抑制劑類、格列奈類、磺酰脲類藥物是目前臨床應用的主要口服降糖藥,雖具有一定的降糖作用,但同時也存在著低血糖、腎毒性及肝毒性等多種副作用[3]。而中藥治療糖尿病及其并發癥歷史悠久,具有低毒副作用、療效明確等優勢[4]。
紫蘇葉為唇形科植物紫蘇[Perilla frutescens(L.) Britt.]的干燥葉(或帶嫩枝),具有調節糖脂代謝、抗氧化、抗抑郁、止咳平喘、解熱、鎮靜等多種功效,其中所含的多糖類、揮發油類、黃酮類、酚酸類及脂肪酸類成分是其主要活性成分[5]。有研究發現,給予自發性糖尿病模型大鼠紫蘇茶葉后,可延緩其糖尿病的發生[6]。并且已有研究報道,紫蘇葉總黃酮提取物可調節糖尿病模型小鼠糖脂代謝紊亂,具有較好的抗糖尿病作用[7]。然而,作為紫蘇葉中主要活性成分之一的多糖類成分是否具有抗糖尿病作用目前尚未見報道。氧化應激和磷酸肌醇-3-激酶(PI3K)/蘇氨酸蛋白激酶(AKT)/葡萄糖轉運蛋白 4(GLUT4)信號通路在糖尿病的發生發展中扮演著重要角色[8-9]。因此,本研究主要研究紫蘇葉多糖對糖尿病模型小鼠是否具有改善作用,并明確該作用與氧化應激及PI3K/AKT/GLUT4信號通路的關聯性,初步闡明其抗糖尿病的作用及機制,為其進一步的臨床應用奠定基礎。
1 材料
1.1 儀器
AL204型分析天平(德國Mettler-Toledo公司);AU600型全自動生化分析儀(日本Olympus公司);1800型酶標儀(上海閃譜科技生物有限公司);T6型紫外-可見分光光度計(北京普析通用儀器有限責任公司);Universal Hood Ⅱ型凝膠成像系統、170-3930型蛋白電泳及轉印儀(美國Bio-Rad公司);卓越纖巧型血糖儀(瑞士Roche公司)。
1.2 藥品與試劑
紫蘇葉藥材于2018年8月采摘自吉林省吉林市地區,經北華大學藥學院苑廣信教授鑒定為唇形科植物紫蘇[P. frutescens (L.) Britt.]的葉片;鹽酸二甲雙胍片(中美上海施貴寶公司,批號:20190427,規格:0.5 g);鏈脲佐菌素(STZ)對照品(美國Sigma公司,批號:S0130,純度:≥98%);空腹血糖(FBG)、空腹胰島素(FINS)測定試劑盒(湖南三諾生物公司,批號:190116、190223);高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、總膽固醇(TC)、三酰甘油(TG)測定試劑盒(泉州睿信生物科技有限公司,批號:20190415、20190426、20190302、20190517);丙二醛(MDA)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)測定試劑盒(南京建成生物工程研究所,批號:20180908、20181120、20191120、20181018);兔源PI3K、磷酸化AKT(p-AKT)、GLUT4多克隆抗體(美國Abcam公司,批號:ab140307、ab8805、ab654);兔源β-肌動蛋白(β-actin)多克隆抗體、辣根過氧化物酶標記的山羊抗兔免疫球蛋白G(IgG)二抗(杭州景杰生物公司,批號:180526、180603);其余試劑均為分析純或實驗室常用規格,水為蒸餾水。
1.3 動物
SPF級昆明種小鼠70只,雄性,體質量為18~22 g,購自吉林大學實驗動物中心,實驗動物生產許可證號:SCXK(吉)2016-0001。飼養環境溫度為20~25 ℃、相對濕度為40%~70%,飼養期間小鼠自由飲食。本實驗經吉林市化工醫院實驗動物倫理委員會批準,按照中國倫理委員會有關動物研究指導原則開展。
2 方法
2.1 紫蘇葉多糖的制備
將采摘的紫蘇葉清洗、瀝干和干燥后,粉碎過40目篩。稱取500 g紫蘇葉粉末,加入10倍體積(mL/g)水,在80 ℃水浴條件下浸提6 h,濾過。濾液加入3倍體積的無水乙醇進行沉淀,再經4%H2O2溶液脫色及Sevag法除蛋白[10],最終制得紫蘇葉多糖,經苯酚-硫酸法[11]檢測其多糖含量為75.6%。
2.2 造模、分組與給藥
小鼠適應性飼養1周后,隨機取60只小鼠,一次性腹腔注射以檸檬酸/檸檬酸鈉緩沖液(0.1 mol/L,pH 4.4)新鮮配制的STZ溶液(60 mg/kg),復制糖尿病模型。注射3 d后,小鼠尾靜脈取血并用血糖儀測定FBG含量,糖尿病小鼠模型成功建立的標準為FBG>16.7 mmol/L[12]。剩余10只健康小鼠作為正常組,注射等體積、同濃度和pH的檸檬酸/檸檬酸鈉緩沖液。共有43只小鼠造模成功。選取造模成功的40只小鼠隨機分為模型組、二甲雙胍組(陽性對照,200 mg/kg)和紫蘇葉多糖高、低劑量組(400、200 mg/kg),每組10只。正常組和模型組小鼠灌胃等體積生理鹽水,各給藥組小鼠灌胃相應藥物,灌胃體積均為0.2 mL/10 g,每天給藥1次,連續給藥28 d。其中,二甲雙胍組小鼠的給藥劑量是參考文獻方法[13]設置的,紫蘇葉多糖的劑量是參考文獻方法[14]并結合預實驗結果設置的。
2.3 小鼠一般情況及體質量測定
實驗期間,每日觀察各組小鼠行為活動、精神狀態、毛色、大小便量、進食量及飲水量等情況,并在給藥前及末次給藥后分別稱定小鼠的體質量。
2.4 小鼠口服葡萄糖耐量實驗
灌胃給藥21 d后,各組小鼠禁食不禁水12 h,隨后灌胃40%葡萄糖溶液(2 g/kg)。分別于灌胃糖溶液0、30、60、120 min后,斷尾取血并用血糖儀測定FBG含量。
2.5 小鼠血清中血糖、血脂相關指標測定
末次給藥12 h后,各組小鼠摘眼球取血,以3 000? ? r/min離心10 min,分離血清。采用血糖儀測定FBG含量,酶聯免疫吸附法測定FINS含量,全自動生化分析儀測定HDL-C、LDL-C、TC、TG含量。按公式計算胰島素敏感指數(ISI)和胰島素抵抗指數(IRI):ISI=ln(1/FBG× FINS);IRI=FBG×FINS/22.5。
2.6 小鼠胰腺組織中氧化應激水平測定
各組小鼠取血后處死,無菌操作分離其胰腺組織,將部分組織充分碾磨并經RIPA裂解液裂解后,以3 000 r/min離心10 min,制備組織上清液。采用硫代巴比妥酸法測定MDA含量,黃嘌呤氧化酶法測定SOD活性,硫代硫酸鈉法測定CAT活性,二硫對硝基苯甲酸法測定GSH-Px活性,具體操作按照相應試劑盒說明書進行。
2.7 小鼠胰腺組織中PI3K、p-AKT、GLUT4蛋白表達水平測定
取各組小鼠另一部分胰腺組織,按“2.6”項下方法制備組織上清液,二喹啉甲酸(BCA)法測定總蛋白含量后,煮沸使蛋白變性。取蛋白20 μg,行12%聚丙烯酰胺凝膠電泳分離目的蛋白(其中濃縮膠電壓為70 V,電泳時間為40 min;分離膠電壓為120 V,電泳時間約為1.5 h),然后電轉(電流為120 mA,時間為2 h)至硝酸纖維素膜上;用牛奶封閉1 h,分別加入稀釋比例均為1 ∶ 2 000的PI3K、p-AKT、GLUT4和β-actin一抗,在4 ℃條件下孵育過夜;以TBST漂洗3次后,加入相應二抗(稀釋比例為 1 ∶ 5 000),在常溫下繼續孵育40 min;以TBST漂洗3次,加入ECL試劑顯色。采用凝膠成像系統顯影后,以Image J v1.8.0軟件分析各條帶灰度值,以目的蛋白條帶灰度值與內參β-actin條帶灰度值的比值表示目的蛋白的相對表達水平。
2.8 統計學方法
采用SPSS 18.0統計學軟件進行數據分析。結果以x±s表示,多組間比較采用單因素方差分析,方差齊時組間兩兩比較采用Bonferroni法,方差不齊時組間兩兩比較采用Nemenyi法。P<0.05表示差異具有統計學意義。
3 結果
3.1 紫蘇葉多糖對糖尿病模型小鼠一般狀況及體質量的影響
正常組小鼠行動活躍,精神狀態良好,皮毛干燥光滑,大小便量、進食量及飲水量均正常;模型組小鼠行動較遲緩,精神萎靡不振,毛發有不同程度的脫落或糾結成簇,大小便量增加,飼料消耗量和飲用水增多;二甲雙胍組和紫蘇葉多糖高、低劑量組小鼠一般狀況較模型組均有一定程度的改善。給藥前,各組小鼠的體質量差異均無統計學意義(P>0.05);灌胃給藥28 d后,與正常組比較,模型組小鼠體質量顯著降低(P<0.05);與模型組比較,二甲雙胍組和紫蘇葉多糖高、低劑量組小鼠體質量均有不同程度的升高,但差異均無統計學意義(P>0.05)。上述結果提示,紫蘇葉多糖可以改善糖尿病模型小鼠的一般狀況,但對體質量并無明顯影響。各組小鼠體質量測定結果見表1。
3.2 紫蘇葉多糖對糖尿病模型小鼠口服葡萄糖耐量的影響
灌胃葡萄糖溶液0~30 min后,各組小鼠的FBG水平均呈逐漸增加的趨勢;而在灌胃30~120 min后,其血糖水平又均呈逐漸降低的趨勢。與正常組比較,模型組小鼠在灌胃葡萄糖溶液0、30、60、120 min后FBG水平均顯著升高(P<0.05);與模型組比較,二甲雙胍組和紫蘇葉多糖高、低劑量組小鼠在灌胃葡萄糖溶液0、30、60、120 min后其FBG水平均顯著降低(P<0.05)。各組小鼠灌胃葡萄糖溶液不同時間后的FBG測定結果見表2。
3.3 紫蘇葉多糖對糖尿病模型小鼠血清中FBG、FINS含量及ISI、 IRI的影響
與正常組比較,模型組小鼠血清中FBG含量和IRI均顯著升高(P<0.05),而FINS含量和ISI均顯著降低(P<0.05);與模型組比較,二甲雙胍組和紫蘇葉多糖高、低劑量組小鼠血清中FBG含量和IRI均顯著降低(P<0.05),FINS含量和ISI均顯著升高(P<0.05)。各組小鼠血清中FBG、FINS含量及ISI、 IRI測定結果見表3。
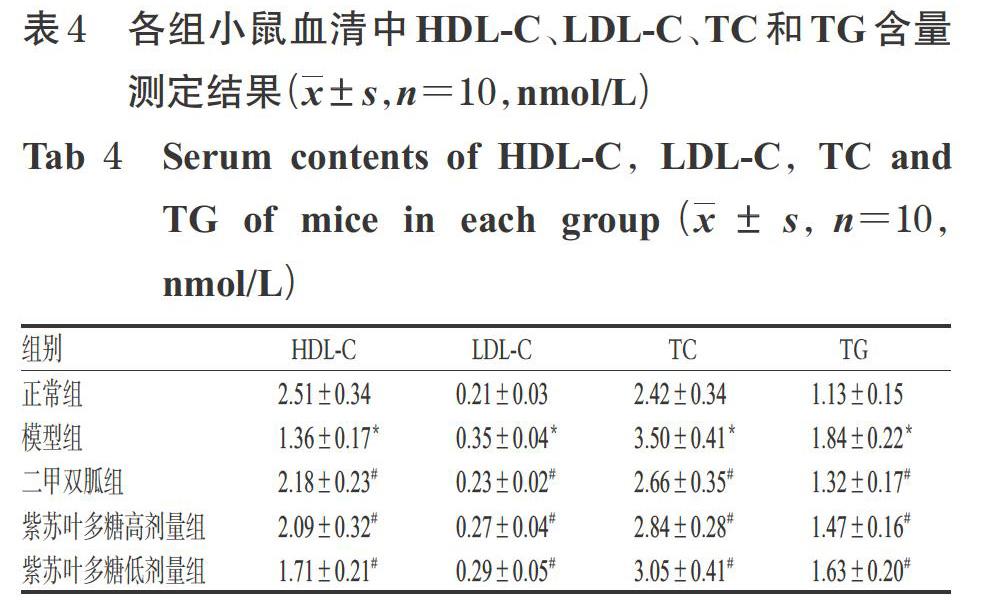
3.4 紫蘇葉多糖對糖尿病模型小鼠血清中HDL-C、LDL-C、TC和TG含量的影響
與正常組比較,模型組小鼠血清中HDL-C含量顯著降低(P<0.05),LDL-C、TC、TG含量均顯著升高(P<0.05);與模型組比較,二甲雙胍組和紫蘇葉多糖高、低劑量組小鼠血清中HDL-C含量均顯著升高(P<0.05),LDL-C、TC、TG含量均顯著降低(P<0.05)。各組小鼠血清中HDL-C、LDL-C、TC和TG含量測定結果見表4。
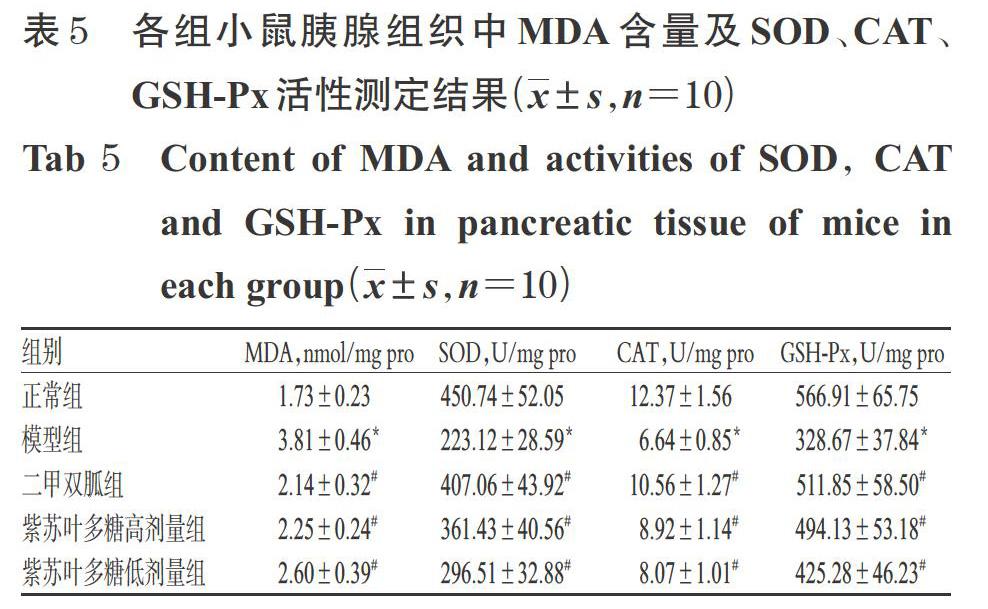
3.5 紫蘇葉多糖對糖尿病模型小鼠胰腺組織中MDA含量和SOD、CAT、GSH-Px活性的影響
與正常組比較,模型組小鼠胰腺組織中MDA含量顯著升高(P<0.05),SOD、CAT、GSH-Px活性均顯著降低(P<0.05)。與模型組比較,二甲雙胍組和紫蘇葉多糖高、低劑量組小鼠胰腺組織中MDA含量均顯著降低(P<0.05),SOD、CAT、GSH-Px活性均顯著升高(P<0.05)。各組小鼠胰腺組織中MDA含量及SOD、CAT、GSH-Px活性測定結果見表5。
3.6 紫蘇葉多糖對糖尿病模型小鼠胰腺組織中PI3K、p-AKT和GLUT4蛋白表達水平的影響
與正常組比較,模型組小鼠胰腺組織中PI3K、p-AKT、GLUT4蛋白表達水平顯著降低(P<0.05);與模型組比較,二甲雙胍組和紫蘇葉多糖高、低劑量組小鼠胰腺組織中PI3K、p-AKT、GLUT4蛋白表達水平均顯著升高(P<0.05)。各組小鼠胰腺組織中PI3K、p-AKT和GLUT4蛋白表達的電泳圖見圖1,蛋白表達水平測定結果見表6。
4 討論
本研究通過口服葡萄糖耐量實驗,發現紫蘇葉多糖可改善糖尿病模型小鼠的葡萄糖耐受。灌胃給予紫蘇葉多糖28 d后,發現其可升高模型小鼠血清中FINS、HDL-C含量和ISI,并降低血清中FBG、LDL-C、TC、TG含量和IRI。以上結果表明,紫蘇葉多糖具有抗糖尿病作用,并可調節糖尿病模型小鼠的血脂代謝紊亂。
氧化應激在糖尿病早期、進程及并發癥進展中具有重要作用,與糖尿病的發生、發展密切相關[15]。抗氧化療法目前已是臨床上糖尿病治療的重要手段,在降低糖脂水平的前提下進行抗氧化治療,能夠更加有效地提高胰島素的敏感性,改善葡萄糖耐受水平[16]。已有研究證實,植物多糖可通過降低氧化應激水平發揮其抗糖尿病作用:例如,黃芪多糖可以升高2型糖尿病模型大鼠骨骼肌中SOD、GSH含量,降低MDA含量,進而緩解糖尿病的進程[17];再如,金耳環多糖也可通過提高機體抗氧化能力,進而調節實驗性2型糖尿病模型大鼠的血脂代謝紊亂[18]。本研究通過檢測紫蘇葉多糖對糖尿病模型小鼠胰腺組織中氧化應激指標MDA含量和SOD、CAT、GSH-Px活性的影響,發現其可以有效降低MDA含量并升高SOD、CAT、GSH-Px活性。以上結果提示,紫蘇葉多糖可能通過改善機體氧化應激水平,進而發揮其抗糖尿病作用。
相關研究證實,PI3K/AKT/GLUT4信號通路的活化對胰島β細胞分泌胰島素具有重要意義,其不僅可以促進組織對葡萄糖的攝取,還可以減弱胰島素抵抗[19]。AKT為PI3K信號通路下游的重要靶蛋白;GLUT4是葡萄糖轉運的主要轉運體,其介導的跨膜運轉是葡萄糖攝取的關鍵步驟[20]。當胰島素信號到達細胞膜后,與胰島素受體底物1(IRS1)結合,引起酪氨酸蛋白激酶活化;后者又使IRS1發生磷酸化反應并與PI3K調節亞基p85發生結合,激活催化亞基p110,活化PI3K;活化的PI3K可以促進下游靶蛋白AKT發生磷酸化,使細胞質膜上的p-AKT釋放并轉移至細胞質內,誘導GLUT4表達,介導葡萄糖轉運至細胞,最終發揮升高胰島素敏感性及調節血糖的作用[21]。而氧化應激與PI3K/AKT/ GLUT4信號通路的活化有關,氧化應激水平的增加可以促使活性氧(ROS)大量生成,進而阻斷PI3K/AKT GLUT4信號通路的激活[22]。通過促進PI3K/AKT/GLUT4信號通路的活化而發揮抗糖尿病的作用也已被研究證實:例如馬歡等[23]研究發現,糖通飲可降低糖尿病模型大鼠血糖水平并改善胰島素抵抗水平,其機制可能與升高PI3K/AKT/GLUT4信號通路中p-AKT的表達水平有關;再如,Rai U等[24]也發現,川芎嗪也可以通過激活PI3K/AKT/GLUT4信號通路,促進PI3K、p-AKT和GLUT4的表達,最終降低高脂飲食聯合STZ誘導的2型糖尿病模型小鼠的血糖。本研究結果顯示,給予糖尿病模型小鼠紫蘇葉多糖后,其胰腺組織中PI3K、p-AKT和GLUT4蛋白表達水平均顯著升高,這表明紫蘇葉多糖的抗糖尿病作用可能也與促進PI3K/AKT/GLUT4信號通路的活化有關。
綜上,紫蘇葉多糖具有抗糖尿病作用,該作用與降低氧化應激水平和促進PI3K/AKT/GLUT4信號通路的活化有關。
參考文獻
[ 1 ] WANG J,WANG MY,WANG H,et al. Status of glycosy- lated hemoglobin and prediction of glycemic control among patients with insulin-treated type 2 diabetes in North China:a multicenter observational study[J]. Chin Med J:Engl,2020,133(1):17-24.
[ 2 ] IWASAKI T,FUKUDA H,KITAMURA M,et al. Association between number of pairs of opposing posterior teeth,metabolic syndrome,and obesity[J]. Odontology,2019,107(1):111-117.
[ 3 ] BAGEPALLY BS,GURAV YK,ANOTHAISINTAWEE T,et al. Cost utility of sodium-glucose cotransporter 2 inhibitors in the treatment of metformin monotherapy failed type 2 diabetes patients:a systematic review and meta-analysis[J]. Value Health,2019,22(12):1458-1469.
[ 4 ] 宋保蘭.抗2型糖尿病中藥活性成分研究進展[J].時珍國醫國藥,2017,28(5):1193-1195.
[ 5 ] 何育佩,郝二偉,謝金玲,等.紫蘇藥理作用及其化學物質基礎研究進展[J].中草藥,2018,49(16):3957-3968.
[ 6 ] KISHI H,KOMATSU W,MIURA Y,et al. Effects of habitual perilla (shiso) tea drinking on the incidence of diabetes mellitus in spontaneously diabetic Trii (SDT) rats[J]. Biosci Biotechnol Biochem,2010,74(12):2490- 2493.
[ 7 ] 何佳奇,李效賢,熊耀康.紫蘇總黃酮提取物對四氧嘧啶致糖尿病小鼠糖脂代謝及抗氧化水平的影響[J].中華中醫藥學刊,2011,29(7):1667-1669.
[ 8 ] NEWSHOLME P,CRUZAT VF,KEANE KN,et al. Molecular mechanisms of ROS production and oxidative stress in diabetes[J]. Biochem J,2016,473(24):4527- 4550.
[ 9 ] GUO X,SUN W,LUO G,et al. Panax notoginseng saponins alleviate skeletal muscle insulin resistance by regula- ting the IRS1-PI3K-AKT signaling pathway and GLUT4 expression[J]. FEBS Open Bio,2019,9(5):1008-1019.
[10] 張蕓,倪德江,余志,等.烏龍茶多糖的聚酰胺柱層析法純化工藝[J].食品科學,2014,35(14):1-4.
[11] 于淼,王冰,付葉珊,等.響應面法優化刺五加根廢棄物多糖提取工藝的研究[J].中草藥,2019,20(7):1610-1613.
[12] SHUANG J,YONG T,YANG B,et al. Protective effect of Coptis chinensis polysaccharide against renal injury by suppressing oxidative stress and inflammation in diabetic rats[J]. Natural Product Communications,2019,14(9):1-7.
[13] 劉率男,劉泉,孫素娟,等.二甲雙胍對2型糖尿病KKAy小鼠胰島β細胞功能的影響及初步作用機制探討[J].藥學學報,2014,49(11):1554-1562.
[14] 李沖偉,宋永,孫慶申.微波輔助提取紫蘇多糖及保肝降酶活性的研究[J].中國農學通報,2014,30(9):285-290.
[15] ARDESHIRLARIJANI E,TABATABAEI-MALAZY O,MOHSENI S,et al. Effect of probiotics supplementation on glucose and oxidative stress in type 2 diabetes mellitus:a meta-analysis of randomized trials[J]. DARU,2019,27(2):827-837.
[16] OGUNTIBEJU OO. Type 2 diabetes mellitus,oxidative stress and inflammation:examining the links[J]. Int J Physiol Pathophysiol Pharmacol,2019,11(3):45-63.
[17] 賀映俠,朱虹.黃芪多糖對2型糖尿病大鼠骨骼肌氧化應激水平及SIRT3表達的影響[J].中國老年學雜志,2018,38(12):3023-3025.
[18] 周多強,李溥,羅良琦,等.水藥金耳環多糖對實驗性2型糖尿病模型大鼠糖脂代謝、腎功能及氧化應激的影響[J].中國藥房,2017,28(31):4415-4419.
[19] ZUO ML,WANG AP,TIAN Y,et al. Oxymatrine ameliorates insulin resistance in rats with type 2 diabetes by regulating the expression of KSRP,PETN,and AKT in the? ?liver[J]. J Cell Biochem,2019,120(9):16185-16194.
[20] 陳潔,劉一然.姜黃素對2型糖尿病大鼠脂肪細胞葡萄糖轉運及PI3K/Akt信號通路的影響[J].中國比較醫學,2019,29(5):90-97.
[21] LIU Y,DENG J,FAN D. Ginsenoside Rk3 ameliorates high-fat-diet/streptozocin induced type 2 diabetes mellitus in mice via the AMPK/Akt signaling pathway[J]. Food Funct,2019,10(5):2538-2551.
[22] 張雷,李東哲,陳志宏.絲膠蛋白對2型糖尿病大鼠腎臟氧化應激損傷和PI3K/Akt信號通路的影響[J].中國老年學雜志,2020,40(4):831-834.
[23] 馬歡,高楠楠,陳俞如,等.糖通飲對2型糖尿病大鼠胰腺組織PI3K-AKT通路的影響[J].貴州醫科大學學報,2020,45(1):1-6.
[24] RAI U,KOSURU R,PRAKASH S,et al. Tetramethylpyrazine prevents diabetes by activating PI3K/Akt/GLUT-4 signalling in animal model of type-2 diabetes[J]. Life Sci,2019. DOI:10.1016/j.lfs.2019.116836.
(收稿日期:2020-02-03 修回日期:2020-06-02)
(編輯:林 靜)

