響應面優化乳酸菌-柚子核共發酵體系中多肽的制備
劉 帆,吳戈儀,吳繼紅,王 琴
(1.仲愷農業工程學院輕工食品學院,廣東廣州 510000;2.北京工商大學食品學院,北京市風味化學重點實驗室,北京 100048)
柚子核作為金柚產業的大宗加工副產物,資源豐富,但在金柚的加工和食用過程中,往往被忽視而遺棄,造成資源的嚴重浪費。謝貞建等人[1]研究柚子核的化學組成為粗脂肪占柚子核的40.12%±0.13%,粗蛋白占32.89%±0.82%,含水量為12.08%±0.02%,總糖占11.22%±0.96%,灰分占5.35%±0.09%,且其中含有多種對人體健康有益的生理活性成分,如活性多糖、活性多肽、膳食纖維、黃酮等。因此,提高柚子核的高值化利用將會有效推動金柚產業向資源節約型、環境友好型的轉型和發展。
關于金柚柚子核的研究剛剛起步,僅有關于其中的黃酮和檸檬苦素的優化提取,以及柚子核中揮發油的化學成分等研究。其中,黃師榮等人[2]利用乙醇作為提取劑,在進行提取工藝優化后,柚子核中黃酮類化合物的提取率為0.968%。邵金華等人[3]以乙醇作為提取劑,在進行提取工藝優化后,柚子核中的檸檬苦素的提取率為3.967 mg/g。葉茂等人[4]利用超聲波輔助水酶法提取柚子核油,在進行提取工藝優化后,柚子籽油得率達到33.2%,且抗氧化性優于維C和白藜蘆醇,這是由于柚子籽油中富含類黃酮、檸檬苦素等有效抗氧化成分。然而,有關柚子核中活性多肽的相關研究國內外尚未見報道。
多肽是具有與其功能性蛋白質相同序列的特異性小的無活性蛋白質片段。通常,肽包含2~20個氨基酸[5]。與蛋白質相比,生物活性肽的分子量較低、結構相對簡單、抗原較弱、毒副作用較低且易被人體吸收,具有較強的生理活性,包括調節免疫、抗腫瘤、抗疲勞、抗氧化、抗衰老、抗病毒及抗菌等,是當今研究和開發的熱點[6]。
由于乳酸菌的食物來源主要是纖維、乳糖、淀粉、寡糖,多肽幾乎不被利用,而其代謝產物中富含蛋白酶,可對天然產物中的蛋白質進行水解,產生不同分子量的生物活性肽,利用這一特點選用微生物發酵法制備活性多肽,不僅成本較低并且在微生物發酵過程中其代謝等生理活動可減少天然產物中的某些致敏成分,提高營養成分含量[7]。
柚果加工,尤其是有關柚核、果皮等的綜合利用已經引起國內外科技工作者的關注。因此,利用響應面優化乳酸菌-柚子核共發酵體系中活性多肽的提取,將為進一步研究乳酸菌-柚子核共發酵體系中多肽的生理活性奠定基礎,有助于提高金柚加工過程中副產物的高值化利用,促進金柚產業的轉型與升級,未來勢必將加大對金柚加工副產物柚子核的綜合利用。
1 材料與方法
1.1 材料來源
柚子核,來源于廣東梅州的金柚柚子果實;乳酸菌(Lactobacillus amylolyticus 6),仲愷農業工程學院輕工食品學院微生物實驗室提供。
1.2 主要試劑
谷胱甘肽標準品,Meilunbio公司提供;MRS肉湯培養基,青島高科技工業園海博生物技術有限公司提供;氯化鈉(AR)、三氯乙酸(AR)、碳酸鈉(AR)、氫氧化鈉(AR)、酒石酸鉀鈉(AR)、五水硫酸銅(AR),天津市大茂化學試劑廠提供;瓊脂、福林酚試劑,廣州市齊云生物技術有限公司提供。
1.3 主要儀器
MGC-350H型恒溫培養箱,鄭州生元儀器有限公司產品;YXQ-LS-50SII型高壓滅菌鍋,上海博迅實業有限公司產品;DHG-9023A型鼓風干燥箱,飛迪科技有限公司產品;SCIENTZ-50F型真空冷凍干燥機,新芝凍干有限公司產品;SC-3610型離心機,中佳有限公司產品;ME203E型分析天平,梅特勒-托利多儀器(上海)有限公司產品;TU-1900型雙光束紫外可見分光度計,普析有限公司產品;HH-S2型數顯恒溫水浴鍋,常州市金壇大地自動化儀器廠產品;RWD-1型超純水機,Heal Force有限公司產品。
1.4 試驗方法
1.4.1 柚子核樣品制備
使用鼓風干燥機于60℃下將金柚柚子核烘干至恒質量,得干燥的柚子核。用組織搗碎機粉碎成粉末狀,并通過30目篩,得試驗用柚子核粉末,保存于常溫干燥皿中,備用。
1.4.2 乳酸菌菌懸液制備
選定Lactobacillus amylolyticus 6作為微生物固態發酵菌種[8]。將MRS肉湯培養基以54 g/L的質量濃度配置,并用滅菌鍋殺菌(121℃,15 min) 以備用。
將保存在-40℃的菌株復蘇,再將50 μL已融化的冷凍菌滴入25 mL MRS肉湯培養基中,用封口條封好,避免污染,置于37℃培養箱中培養36 h。將培養后的乳酸菌用20 mL無菌生理鹽水清洗并離心(1 200 r/min,15 min,常溫) 2次,每次倒掉上清液,以去除培養基,加入20 mL無菌0.9%NaCl鹽水,制備成懸濁液待用。
1.4.3 乳酸菌與柚子核的共生發酵
將已處理的柚子核粉末精密稱取1 g于錐形瓶中,用一定料液比的超純水將其浸濕,用封口條封好以免污染,于121℃下滅菌20 min后,在超凈工作臺上以一定百分比的接種量將乳桿菌接種于柚子核粉末表面,并置于一定溫度的培養箱中培養一定時間,發酵完成后立即將樣品放置在60℃烘箱中干燥48 h,以停止反應,并立即儲存在4℃下備用。
1.4.4 乳酸菌發酵柚子核中多肽的提取
以1∶20的料液比加入超純水,于溫度37℃,轉速40 r/min下用恒溫搖床提取1 h;提取后倒入離心管以轉速1 300 r/min離心20 min;取上清液定容至50 mL,并立即儲存在4℃下以備后續測定使用。對于不需測定的多肽提取液,放置于-40℃條件下保存,后用真空冷凍干燥機進行凍干,得到多肽粗樣,并立即儲存在-40℃冰箱中。
1.4.5 多肽得率的測定
為避免蛋白質對多肽含量檢測的影響,取1 mL上述提取液,加入10%(W/V) 的三氯乙酸(TCA) 水溶液1 mL混合均勻,靜置10 min,以轉速1 100 r/min離心30 min,取上清液。
多肽得率的測定使用福林酚法[9-10],具體包括以下步驟:
(1) 溶液配置。福林試劑A液:0.8 g NaOH和4 g無水Na2CO3溶于200 mL超純水;福林試劑B液:2 g酒石酸鉀鈉溶于200 mL超純水;福林試劑C液:1 g CuSO4·5H2O溶于200 mL超純水;福林試劑D液:192 mL福林試劑A溶液與4 mL福林試劑B液和4 mL福林試劑C液的混合液,現配現用;福林試劑E液:Folin-Phenol試劑。
(2) 吸收光譜的測定。配置成質量濃度為1 mg/mL谷胱甘肽標準溶液,取0.5 mL加入4 mL試劑D液,于室溫下靜置10 min,然后加入試劑E液0.5 mL并混勻,于40℃下保溫20 min,室溫冷卻,于波長300~900 nm處掃描,得到其吸收光譜曲線,確定測定波長。
(3)谷胱甘肽標準曲線制作。配置質量濃度為0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.1,1.2 mg/mL谷胱甘肽溶液,各取1 mL,分別加入8 mL試劑D液,于室溫下靜置10 min,然后加入試劑E液1 mL并混勻,于40℃下保溫20 min,室溫冷卻,于波長749 nm處測定各管溶液的吸光度,繪制標準曲線。
(4) 多肽得率的測定。取1 mL已加入TCA去除蛋白的樣品,加入8 mL試劑D液,于室溫下靜置10 min,然后加入試劑E液1 mL并混勻,于40℃下保溫20 min,室溫冷卻,于波長749 nm處測定各管溶液的吸光度,根據標準曲線求出試樣溶液的多肽質量濃度。
式中:ρ——樣品液中多肽質量濃度,mg/mL;
V——樣品液體積,mL;
m——初始柚子核粉末的質量,mg。
1.4.6 乳酸菌發酵柚子核制備多肽工藝的單因素試驗
(1)發酵溫度對乳酸菌發酵柚子核制備多肽工藝影響。準確稱取1 g柚子核粉,在發酵時間為50 h,料液比為1∶11,接種量為40%的情況下,分別于10,14,18,22,26℃下發酵。以多肽得率的極大值為指標,確定最佳發酵溫度。
(2)發酵時間對乳酸菌發酵柚子核制備多肽工藝影響。準確稱取1 g柚子核粉,在發酵溫度為18℃,料液比為1∶11,接種量為40%的情況下,分別發酵20,35,50,65,80 h。以多肽得率的極大值為指標,確定最佳發酵時間。
(3)料液比對乳酸菌發酵柚子核制備多肽工藝影響。準確稱取1 g柚子核粉,在發酵溫度為18℃,發酵時間為50 h,接種量為40%的情況下,分別按照 1∶7,1∶9,1∶11,1∶13,1∶15(g∶mL) 的料液比添加超純水。以多肽得率的極大值為指標,確定最佳發酵液料比。
(4)接種量對乳酸菌發酵柚子核制備多肽工藝影響。準確稱取1 g柚子核粉,在發酵溫度為18℃,發酵時間為50 h,料液比為1∶11的情況下,分別按照30%,35%,40%,45%,50%添加乳酸菌菌懸液。以多肽得率的極大值為指標,確定最佳接種量。1.4.7 響應面優化乳酸菌發酵工藝試驗
在單因素試驗結果的基礎上,采用Design Expert 8.0(MSR) 軟件設計試驗條件,選用Box-behnken(BB) 模型,以發酵后柚子核多肽得率為響應面值Y,發酵溫度(A)、發酵時間(B)、料液比(C)、接種量(D)為自變量,設計四因素三水平響應面試驗并確定乳酸菌發酵柚子核制備多肽的最優工藝條件[11]。并根據響應面模型方差分析表,利用JMP14軟件進一步分析各因素之間的交互作用關系。
2 結果與分析
2.1 谷胱甘肽吸收光譜掃描的測定結果
谷胱甘肽光譜掃描曲線見圖1。
由圖1可得,1 mg/mL谷胱甘肽標準溶液經TU-1900雙光束紫外可見分光光度計在300~900 nm波長范圍內進行光譜掃描,確定其最大吸收峰在749 nm處,并將此波長確定為以下各步驟中多肽含量的測定波長。
2.2 谷胱甘肽標準曲線的制作
749 nm測定波長的谷胱甘肽標準曲線見圖2。
由圖2可知,在測定波長為749 nm時,谷胱甘肽的標準曲線方程為Y=0.388 4X+0.033 4。相關系數R2=0.999,直觀地說明了在749 nm下,吸光度與谷胱甘肽質量濃度有很好的線性關系,兩者相關性強。標準曲線制作誤差小,數據準確度高,為后續多肽得率的測定提供依據。
2.3 乳酸菌發酵柚子核制備多肽工藝的單因素試驗結果與分析
2.3.1 發酵溫度對乳酸菌發酵柚子核制備多肽工藝的影響
發酵溫度對乳酸菌-柚子核共發酵體系中多肽得率的影響見圖3。
由圖3可知,在10~14℃的發酵溫度范圍內,多肽得率隨發酵溫度的增加而提高,在14℃時達到最高點,多肽得率為5.52%±0.12%,發酵溫度大于14℃時,隨溫度增加而降低,最后趨于平緩。這是由于大多乳酸菌均為嗜冷桿菌屬[12],在較低溫度時生長代謝旺盛,產生的蛋白酶豐富,可對天然產物中的蛋白質進行水解,有助于多肽得率的提高,而在較高溫度時乳酸菌生長緩慢,多肽得率較低。數據用3次重復的平均標準偏差(SD) 表示,用SPSS 17.0軟件(IBM Amonk) 計算鄧肯檢驗的顯著性差異可得,發酵溫度在14℃時與其他溫度條件下的多肽得率有顯著差異(p<0.05)。因此,初步確定14℃為最佳發酵溫度。
2.3.2 發酵時間對乳酸菌發酵柚子核制備多肽工藝的影響
發酵時間對乳酸菌-柚子核共發酵體系中多肽得率的影響見圖4。
由圖4可知,在20~35 h的發酵時間內,多肽得率隨發酵時間的增加而提高,發酵時間在35 h時達到最高點,多肽得率為4.40%±0.09%,發酵時間超過35 h后,隨著發酵時間增加多肽得率降低。該乳酸菌的生長對數期為30~36 h,其在生長過程中主要利用纖維、乳糖、淀粉、寡糖[13-14],而在柚子核粉作為營養源的發酵過程中,在35 h達到一個菌株生長與物質消耗的平衡點,因此在35 h時對應的多肽得率最大。數據用3次重復的平均標準偏差(SD)表示,用SPSS 17.0軟件(IBM Amonk) 計算鄧肯檢驗的顯著性差異可得,發酵時間在35 h時與其他發酵時間下的多肽得率有顯著差異(p<0.05)。因此,初步確定35 h為最佳發酵時間。
2.3.3 料液比對乳酸菌發酵柚子核制備多肽工藝的影響
料液比對乳酸菌-柚子核共發酵體系中多肽得率的影響見圖5。
由圖5可知,料液比為1∶7~1∶11時,多肽得率隨著添加的超純水比例增加而逐漸增加,料液比超過1∶11時,多肽得率幾乎穩定為4.79%±0.14%。原料在形成合適的質量濃度梯度時,將促進柚子核中水溶性物質溶出,包括提供乳酸菌生長代謝所需的碳源,在1∶11的料液比時剛好達到飽和,在1∶11的料液比后,增加超純水的體積對多肽得率幾乎沒影響。數據使用3次重復的平均標準偏差(SD) 表示,用SPSS 17.0軟件(IBMAmonk) 計算鄧肯檢驗的顯著性差異可得,料液比為1∶11與1∶7,1∶9條件下的多肽得率有顯著差異,與1∶13,1∶15條件下的多肽得率無顯著差異(p<0.05)。因此,初步確定1∶11為最佳料液比。
2.3.4 接種量對乳酸菌發酵柚子核制備多肽工藝的影響
接種量對乳酸菌-柚子核共發酵體系中多肽得率的影響見圖6。
由圖6可知,接種量為30%~45%時,多肽得率隨著接種量的增加而逐漸增加,當接種量為45%時多肽得率達到最大值為4.68%±0.10%,當接種量大于45%后,多肽得率開始出現降低的趨勢。這是由于提供乳酸菌生長所需的營養物質在接種量為45%時達到平衡,當接種量大于45%時會出現乳酸菌競爭營養物質而導致多肽得率趨于下降。數據用3次重復的平均標準偏差(SD)表示,用SPSS 17.0軟件(IBM Amonk) 計算鄧肯檢驗的顯著性差異可得,接種量在40%時與30%,35%條件下的多肽得率有顯著差異,與45%,50%條件下的多肽得率無顯著差異(p<0.05)。因此,初步確定40%為最佳接種量。
2.4 響應面優化乳酸菌發酵工藝試驗結果與分析
2.4.1 因素的選取及方案
綜合上述單因素的試驗結果,根據Box-benhnken的中心組合試驗設計原理,選定發酵溫度、發酵時間、料液比、接種量這4個因素作為響應面分析試驗的因素,采用四因素三水平響應面分析法,利用Design Expert 8.0(MSR) 軟件對數據進行擬合優化乳酸菌發酵柚子核制備多肽的工藝。
響應面分析試驗因素與水平設計見表1。

表1 響應面分析試驗因素與水平設計
以發酵后柚子核多肽得率為響應面值Y,發酵溫度(A)、發酵時間(B)、料液比(C)、接種量(D)為自變量。其中1-24號為析因試驗,25-29號為中心試驗。
響應面試驗設計與結果見表2。
2.4.2 二次方程數學模型的建立
針對響應面分析試驗結果,應用Design Expert進行回歸擬合分析,得到各發酵條件和多肽得率之間的二次多項式方程模型為Y=4.88-0.17A+0.15B+0.23C+0.036D。由方程中一次項系數可得出影響乳酸菌發酵柚子核制備多肽得率的因素由強到弱依次為C>A>B>D,即料液比>發酵溫度>發酵時間>接種量。
2.4.3 方差分析結果
對模型的回歸方程進行方差分析,以檢驗二次回歸模型的顯著性。
回歸模型方差分析見表3。
回歸模型的方差分析與顯著性檢驗:利用Design Expert 8.0軟件對回歸模型進行方差分析,以確定每個因素對柚子核多肽提取率的影響程度,同時也檢驗回歸方程的有效性。由表5可知,RSM獲得的模型p值為0.020 1(p<0.05),顯著;失擬項p值為0.453 8(p>0.05),不顯著。因此,該模型成立,適合用于乳酸菌發酵柚子核制備多肽的得率響應值的預測。

表2 響應面試驗設計與結果
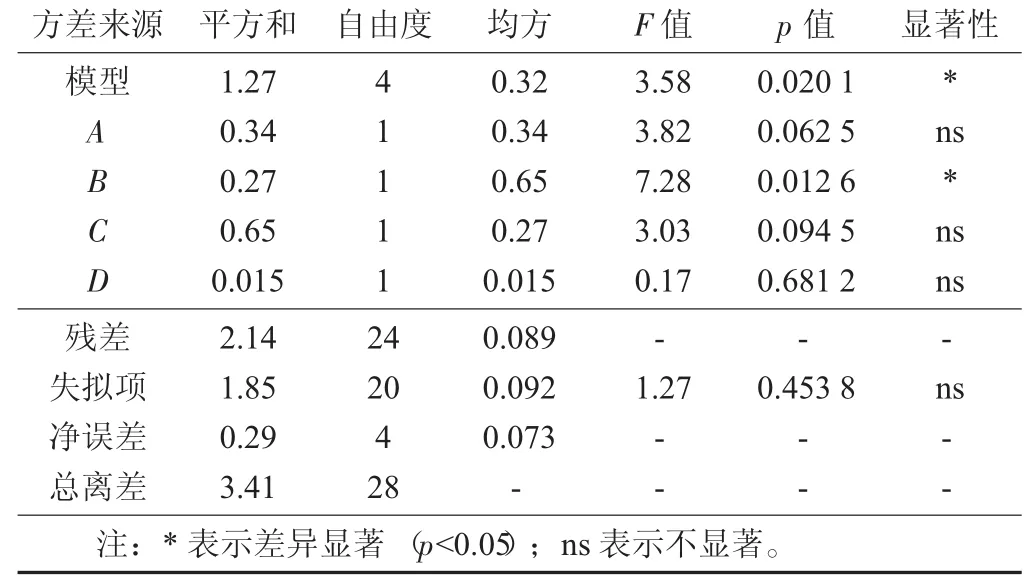
表3 回歸模型方差分析
2.4.4 響應面因素交互作用分析
根據響應面模型方差分析表,利用JMP 14[15]分析得出發酵溫度、發酵時間、料液比、接種量之間的交互作用關系圖,作進一步分析。
發酵溫度、發酵時間、料液比和接種量間的交互作用圖見圖7。
交互作用關系圖中,曲線的彎曲程度越大,表明這種因素隨著相應變量因素的變化而明顯變化[16]。由圖7可知,隨發酵時間的變化,不同發酵溫度、不同發酵料液比和不同接種量之間多肽得率變化較大,每條曲線的斜率變化較大,因此發酵時間與發酵溫度、料液比、接種量之間交互作用均明顯。
2.4.5 響應面優化結果及模型驗證試驗
根據試驗所建立的模型,得到最佳發酵工藝為發酵溫度10℃,發酵時間40 h,料液比1∶15,接種量50%,在此條件下柚子核多肽理論提取率為7.13%。在此條件下進行3次重復試驗,柚子核活性肽實際平均提取率為7.04%±0.23%,與預測值的相對誤差為1.26%。表明響應面法優化所得最佳工藝條件可靠,具有實用價值。
3 結論
以乳酸菌-柚子核共發酵體系為研究對象,通過 Design Expert 8.09(MSR) 軟件的 Box-benhnken中心組合試驗設計原理,利用響應面分析法優化乳酸菌-柚子核共發酵體系制備多肽的工藝。首先,通過單因素試驗,分別研究乳酸菌發酵柚子核過程中發酵溫度、發酵時間、料液比、接種量4個因素對柚子核多肽得率的影響。在此基礎上,以發酵溫度、發酵時間、料液比、接種量作為試驗因子,采用四因素三水平的響應面分析法進行試驗,分析數據后得出,制備乳酸菌-柚子核共發酵體系中活性多肽的最佳工藝為發酵溫度10℃,發酵時間40 h,料液比1∶15,接種量50%,經過方差分析和分子刻畫器顯示模型擬合度較高。通過驗證性試驗證實此工藝條件下多肽得率為7.04%±0.23%,與模型的預測值7.13%十分接近。由此可見,該模型能有效指導乳酸菌-柚子核共發酵體系中活性多肽制備工藝條件的優化,并證明通過響應面分析法優化乳酸菌-柚子核共發酵體系中活性多肽的制備在實踐上是可行的,這為進一步研究乳酸菌-柚子核共發酵體系中多肽的生理活性奠定基礎。
柚果加工,尤其是有關柚核、果皮等的綜合利用已經引起國內外科技工作者的關注。因此,利用響應面優化乳酸菌-柚子核共發酵體系中活性多肽的提取,將為進一步研究乳酸菌-柚子核共發酵體系中多肽的生理活性奠定基礎,有助于提高金柚加工過程中副產物的高值化利用,促進金柚產業的轉型與升級,未來勢必將加大對金柚加工副產物柚子核的綜合利用。

