正交設計優化超聲輔助提取新疆和田大棗中多糖工藝
陳 莉,李亞童,李歡歡,海力茜·陶爾大洪
(新疆醫科大學藥學院,新疆烏魯木齊 830011)
新疆和田大棗為鼠李科(Rhamnaceae) 棗屬(Zizyphusmill)植物的成熟果實棗(Zizyphus jujuba mill),經烘干、烤制或者晾、曬而成的食用或藥用性產品。和田大棗的果皮呈深紅色,果肉飽滿有彈性[1]。藏醫名著中記載道,大棗具有性溫、味酸、清心熱、治心病等作用[2]。
多糖是由相同的單糖組合而成,如糖原和淀粉。多糖廣泛存在于植物、動物和微生物的細胞壁中[3-4]。大量的藥理和臨床研究表明天然多糖具有廣泛的藥理活性,如免疫調節、抗腫瘤、抗病毒、降血糖、調血脂、抗衰老等,又因其具有高效、安全、低副作用等特點,所以多糖成為國內外學者研究熱點。近年來,多糖類化合物已在醫藥、食品、化妝品等領域被廣泛應用[5-6]。試驗采用超聲提取,通過單因素試驗和正交試驗最后確定新疆和田大棗多糖最佳提取工藝,以期為應用于今后的試驗研究提供理論參考。
1 儀器與試劑
1.1 儀器
DHG-9075A型減壓真空干燥箱,上海精宏實驗設備有限公司產品;DT-200型分析天平、UV-2550型紫外分光光度儀,日本島津公司產品。
1.2 試劑
無水乙醇、正丁醇,天津市富宇精細化工有限公司提供;95%乙醇,天津市大茂化學試劑廠提供;5%葡萄糖,國藥集團新疆制藥有限公司提供;氯仿、濃硫酸、丙酮,均為分析純。
2 方法與結果
2.1 多糖的測定
采用苯酚-硫酸法測定大棗多糖含量。
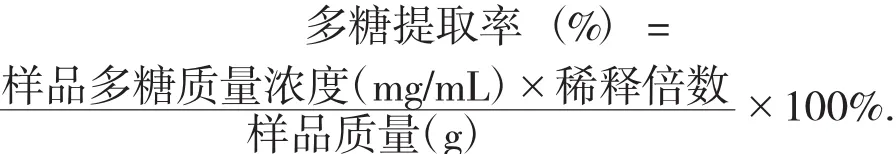
2.2 標準曲線的繪制
精密吸取5%葡萄糖0.2 mL置于100 mL容量瓶中,用蒸餾水定容至刻度,精密移取葡萄糖溶液0.3,0.4,0.5,0.6,0.7,0.8 mL分別置于試管中,加水至2 mL,再依次加入5%苯酚1.0 mL,濃硫酸5.0 mL,于90℃下加熱15 min,冷卻至室溫,以2 mL蒸餾水,1.0 mL苯酚,5.0 mL濃硫酸定容至刻度的溶液做空白對照,于波長490 nm處測吸光度。以葡萄糖質量濃度C(mg/mL)為橫坐標,吸光度A為縱坐標繪制標準曲線,得回歸方程為Y=17.057X+0.001 4(R2=0.999 7),樣品檢測量為 0.015~0.040 mg/mL時與吸光度線性關系良好。
2.3 方法學考查試驗
2.3.1 穩定性試驗
取完全反應后的供試品2 mL,按上述方法顯色后,每隔30 min測1次吸光度,連續測6次,結果RSD值為1.3%,表明該樣品在1 h內穩定。
樣品穩定性試驗見表1。
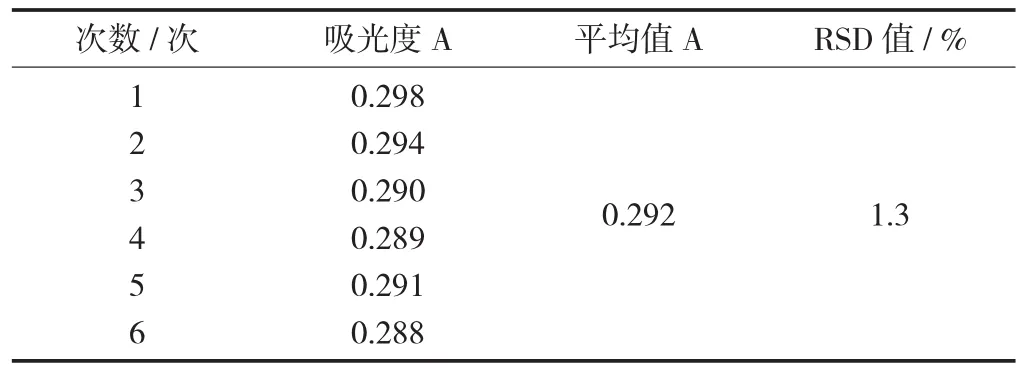
表1 樣品穩定性試驗
2.3.2 重復性試驗
精密量取2 mL供試液,按上述方法顯色后,測其吸光度并計算RSD值為1.8%,表明樣品的重復性較好。
樣品重復性試驗見表2。
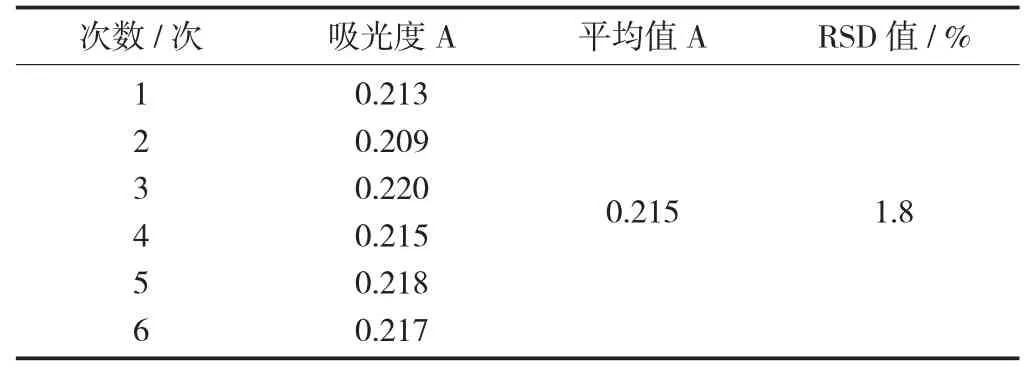
表2 樣品重復性試驗
2.3.3 精密度試驗
精密吸取6份葡萄糖對照品溶液0.5 mL,置于試管中,按標準曲線制備重復操作,重復測定吸光度6次,結果RSD值為0.7%,表明該方法精密度良好。
精密度試驗見表3。
2.3.4 加樣回收率試驗
為了驗證試驗的準確性,在樣品中加入葡萄糖對照品后測定并計算其回收率。取已知質量濃度的多糖含量的供試品9份,各2.0 mL,置于100 mL容量瓶中,按低、中、高質量濃度分別加入葡萄糖對照品 0.8,0.8,0.8,1.0,1.0,1.0,1.2,1.2,1.2 mL,按上述方法顯色后,用蒸餾水定容至刻度,于波長490 nm處測定吸光度,結果平均回收率98.1%,RSD值為1.3%。
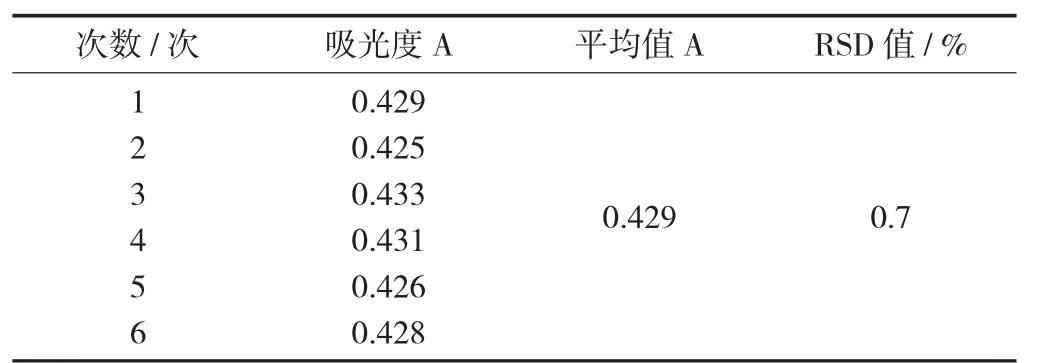
表3 精密度試驗
加樣回收試驗見表4。
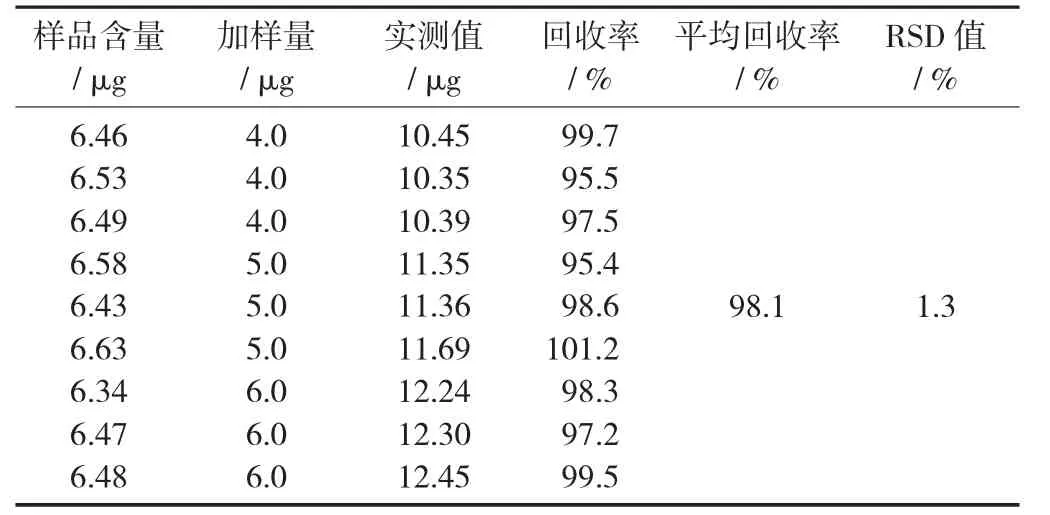
表4 加樣回收試驗
2.4 單因素試驗
2.4.1 料液比對大棗多糖提取率的影響
準確稱取大棗粉末4份,每份2.00 g,分別設置料液比為1∶10,1∶15,1∶20,1∶25,在提取溫度70℃,超聲功率80 W的超聲波清洗儀中超聲處理30 min,再抽濾、除蛋白、醇沉,將沉淀溶解并稀釋成樣液,然后精密加入1 mL苯酚和5 mL濃硫酸,靜置20 min,于波長490 nm處測定吸光度,計算提取率。
料液比對大棗多糖提取率的影響見圖1。
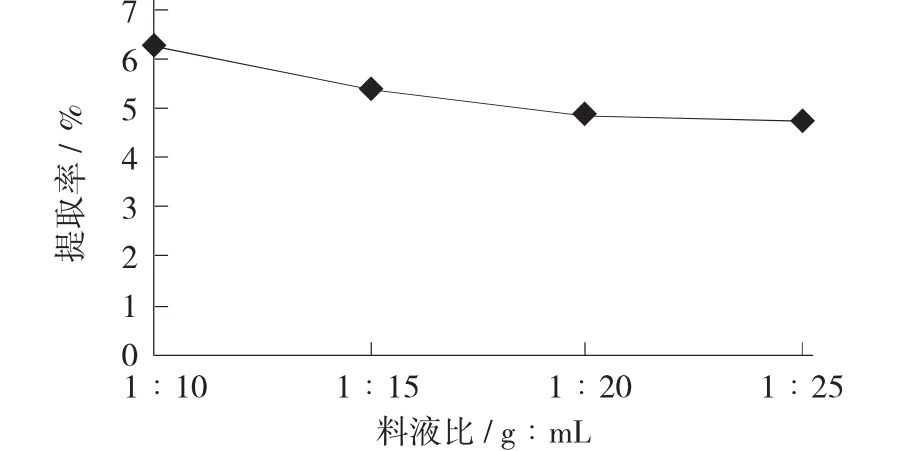
圖1 料液比對大棗多糖提取率的影響
由圖1可知,隨著料液比的增加,大棗多糖的提取率逐漸下降。當料液比為1∶10(g∶mL) 時,提取率最大為6.10%。因此,選擇料液比為1∶10(g∶mL)時提取大棗中多糖最優。
2.4.2 超聲時間對大棗多糖提取率的影響
準確稱取大棗粉末4份,每份2.00 g,放入錐形瓶中,以1∶15的料液比配制溶液,分別設定超聲時間為10,20,30,40 min,在提取溫度70℃,超聲功率80 W的超聲波清洗儀中超聲提取后,再抽濾、除蛋白、醇沉,將沉淀溶解并稀釋成樣液,然后加入精密稱量的苯酚1 mL和濃硫酸5 mL,靜置20 min,于波長490 nm處測定吸光度,計算提取率。
超聲時間對大棗多糖提取率的影響見圖2。
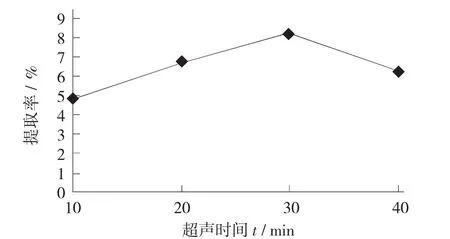
圖2 超聲時間對大棗多糖提取率的影響
由圖2可知,隨著超聲時間的延長,多糖的提取率增加,但當超聲時間繼續增加時,多糖的提取率有所降低,可能是因為隨著超聲時間延長,多糖大分子被降解為小分子,小分子不易沉淀,所以使得多糖的提取率降低。因此,選擇超聲時間為30 min時提取大棗中多糖最優。
2.4.3 提取溫度對大棗多糖提取率的影響
準確稱取大棗粉末4份,每份2.00 g,放入錐形瓶中,以1∶15的料液比配制溶液,分別設定提取溫度為50,60,70,80℃,在超聲功率80 W的超聲波清洗儀中超聲30 min后,再抽濾、除蛋白、醇沉,將沉淀溶解并稀釋成樣液,然后加入精密稱量的苯酚1 mL和濃硫酸5 mL,靜置20 min,于波長490 nm處測定吸光度,計算提取率。
提取溫度對大棗多糖提取率的影響見圖3。
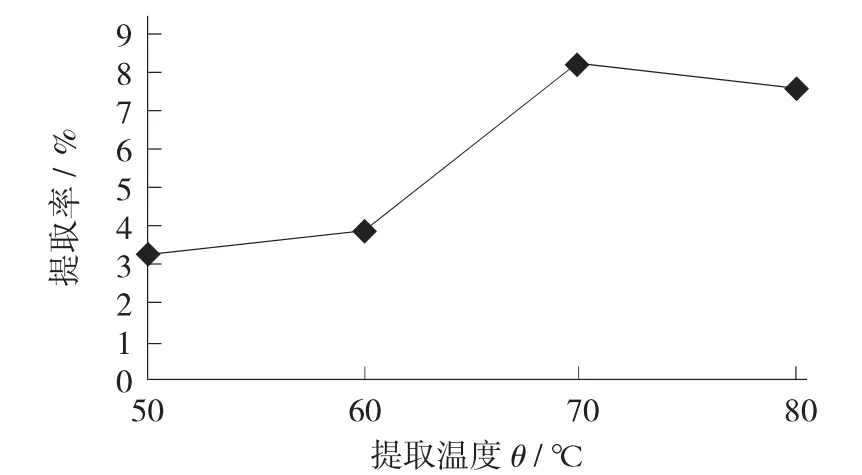
圖3 提取溫度對大棗多糖提取率的影響
由圖3可知,隨著提取溫度的升高,多糖的提取率增加,這是由于升高溫度使得分子間運動增加,多糖從大棗中溶出速率增加。因此,選擇提取溫度為70℃時提取大棗中多糖最優。
2.4.4 超聲功率對大棗多糖提取率的影響
準確稱取大棗粉末4份,每份2.00 g,放入錐形瓶中,以1∶15的料液比配制溶液,分別設定超聲功率為70,80,90,100 W,于提取溫度70℃條件下超聲處理30 min后,再抽濾、除蛋白、醇沉,將沉淀溶解并稀釋成樣液,然后加入精密稱量的苯酚1 mL和濃硫酸5 mL,靜置20 min,于波長490 nm處測定吸光度,計算提取率。
超聲功率對大棗多糖提取率的影響見圖4。
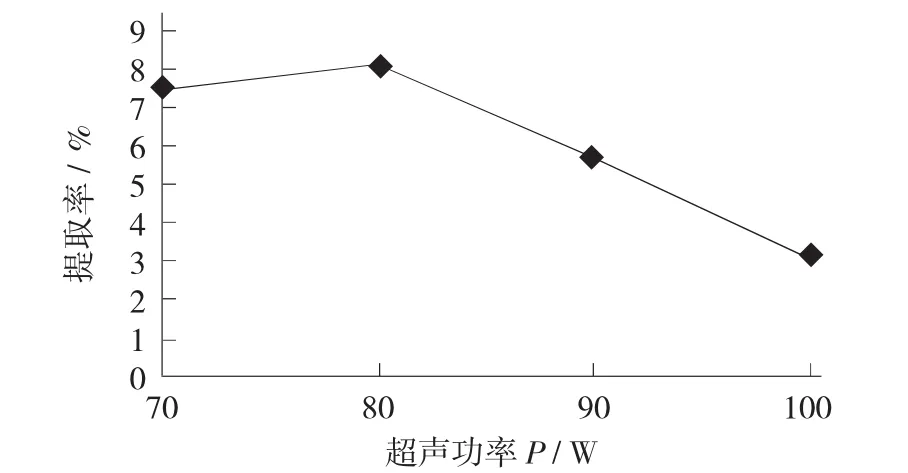
圖4 超聲功率對大棗多糖提取率的影響
由圖4可知,超聲功率對多糖提取率影響明顯,超聲功率80 W時多糖提取率最高為8.07%,但隨著功率的增大,多糖可能發生了降解,從而使得多糖的提取率有所降低。因此,選擇超聲功率為80 W提取大棗中多糖最優。
2.5 正交試驗
在單因素試驗基礎上,以超聲功率(A)、提取時間(B)、超聲溫度(C)、料液比(D) 為試驗因素,以大棗多糖的提取率為評價指標,設計正交試驗L9(34),優化最佳提取工藝條件。
正交試驗因素水平見表5,正交試驗結果見表6。

表5 正交試驗因素水平
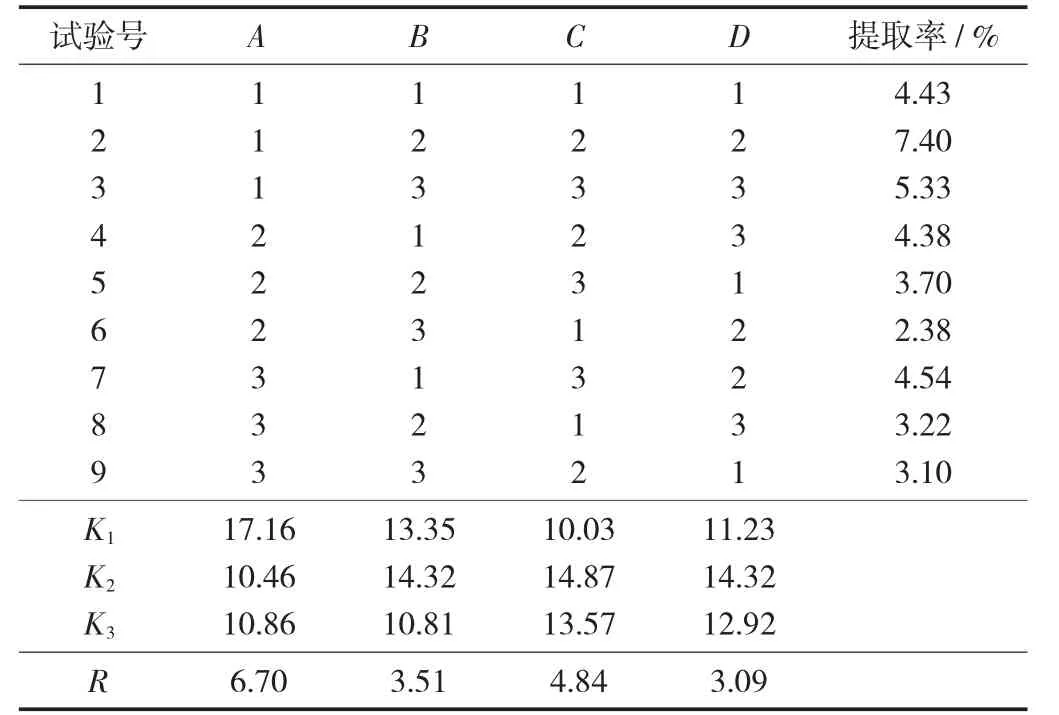
表6 正交試驗結果
由表6可知,影響新疆和田大棗提取的影響因素的順序為超聲功率>提取溫度>超聲時間>料液比,超聲提取大棗多糖的最佳提取條件為A1B2C2D2,即超聲功率70 W,超聲時間30 min,提取溫度70℃,料液比1∶15。
2.6 驗證試驗
為了驗證正交試驗所得的最優提取工藝的穩定性,分別等量稱取大棗粉末2.00 g共3份,根據正交設計優選的最佳大棗多糖提取工藝A1B2C2D2操作,即料液比1∶15,超聲時間30 min,提取溫度70℃,超聲功率70 W,平行操作,進行3次重復試驗。結果表明,驗證試驗與正交設計試驗數據基本一致,充分證明了大棗多糖提取工藝的合理性和穩定性。
3 結論
以大棗多糖提取率為考查指標,采用超聲輔助提取大棗多糖,通過單因素試驗和正交試驗,優化確定大棗多糖的最佳提取工藝參數。結果表明,以大棗多糖提取率為考查指標時,影響多糖提取率的主要因素為超聲功率,對大棗多糖的提取具有顯著性影響,其次是提取溫度和超聲時間,料液比影響最小。大棗多糖的最佳提取工藝為A1B2C2D2,即料液比1∶15,超聲時間30 min,提取溫度70℃,超聲功率70 W。在最佳提取工藝條件下,多糖的提取率為7.40%。通過驗證試驗,證明了大棗多糖提取工藝的合理性和穩定性。相比傳統的水浸提取法,超聲提取法增大了物質分子運動的頻率和速度,提高了提取率,具有提取效率高、提取時間短、節省藥材等優點,所以超聲提取法在中草藥提取領域有著廣闊的前景。

