EphA2在鼻咽癌致病過程中的作用及治療靶點展望*
梁政 董愷悌 周慧芳 綜述 任秀寶 審校
鼻咽癌(nasopharyngeal carcinoma,NPC)好發生于中國華南地區、東南亞及部分非洲地區,全世界約80%的NPC 發生在中國,嚴重威脅人們的生命健康。NPC 對放療較敏感,隨著放療技術的不斷發展,早期NPC 的5年生存率已達95%[1]。病理上NPC 以低分化非角化性鱗癌和未分化癌多見,其他類型為角化性鱗狀細胞癌。NPC發病與遺傳因素、EB病毒感染、環境因素、飲食習慣等因素有關。但在臨床實踐中,由于NPC 發病部位隱匿,早期癥狀的非特異性導致確診時常處于中晚期,同時伴有較高的復發率和(或)遠處轉移,很大程度上增加了死亡率[2]。因此早期的篩查和診斷,尋找新的治療靶標,對提升NPC整體診治水平具有重要意義。
促紅細胞生成素產生肝細胞受體(erythropoietin-producing hepatocellular receptor,Eph)及其配體ephrin[3],是最大受體酪氨酸激酶(RTK)家族,RTK通常通過與可溶性配體結合而激活。區別于其他RTK家族,ephrin 配體和Eph 受體均結合在細胞膜上,激活信號的轉導通路,一般發生在直接接觸的細胞之間,雙向信號轉導是其獨特特點[4]。Eph受體是一種膜結合型Ⅰ型糖蛋白,主要由N末端糖基化配體結合區、跨膜區和胞內具有酪氨酸激酶活性區域構成。ephrin配體通過A類糖基磷脂酰肌醇錨蛋白(GPI)錨定作用或通過跨膜蛋白和包括1個PDZ-結合基序的胞質區(B 類)與細胞膜結合,與此相對應是A 類或B類Eph 受體。Eph 受體共有16 個亞型,即EphA(1~10)和EphB(1~6)[5]。
配體受體結合產生的正向信號通常需要酪氨酸激酶結構域活化,激活的Eph受體通過招募調節Rho家族蛋白(包括RhoA、Rac 和CDC42)GTP 酶激活狀態,針對細胞骨架改變、細胞黏附、細胞運動性能產生調控。配體受體結合還可以招募p120Ras-GAP,抑制RAS家族蛋白(H-RAS、R-RAS),從而抑制Ras-ERK通路[6]。
Eph 受體-ephrin 配體相互作用和信號轉導通常導致細胞排斥、分離、細胞收縮、失去黏著斑和細胞變圓[4,7],這種排斥性細胞收縮反應在許多生理和病理過程中起到關鍵作用,包括胚胎發育、神經系統發育中軸突的引導和損傷后組織再生的抑制[4]。在癌細胞中,Eph受體引起的排斥反應對惡性腫瘤在不同狀態下有著不同的影響。
1 EphA2的信號特點
在16 種Eph 受體中,EphA2 與腫瘤的聯系最強,因此已被廣泛研究[8-10]。腫瘤細胞中的EphA2 信號轉導可能具有促腫瘤或抑腫瘤的作用,這取決于腫瘤微環境[11],EphA2經典信號轉導涉及Eph-ephrin結合、酪氨酸自磷酸化和激酶活性。在正常組織中,EphA2 在上皮細胞中表達,膜結合的Ephrin-A 成員(A1、A2、A3、A4 和A5)在鄰近細胞中表達,其結合EphA2,引發配體依賴信號[12]。EphA2配體依賴信號能有效抑制Ras/ERK的信號通路和ErbB等其他生長因子受體激活的PI3K/AKT致癌信號通路[13-14]。
EphA2也可以產生不需要配體或激酶活性(非經典信號)的另一種信號形式,并且在連接激酶結構域和SAM 結構域的片段中涉及S897 的磷酸化,表現為癌蛋白功能。EphA2S897磷酸化是由絲氨酸/蘇氨酸激酶(如AKT、RSK 和PKA)引起的,并促進細胞遷移、侵襲、轉移和腫瘤干細胞樣特征。S897的磷酸化對促進癌細胞惡性腫瘤的EphA2非經典信號機制至關重要[15-17]。在癌癥進展過程中,受體EphA2的過度表達可導致其配體無關的原癌性激活,這是由與配體Ephrin-A 的結合減少引起的。這些非經典的EphA2受體的原癌性作用可通過配體刺激逆轉,觸發了EphA2 內在的腫瘤抑制信號通路,包括抑制PI3K/AKT 和ERK通路[18]。EphA2其他促瘤機制包括EphA2 的配體結合區常被膜型金屬蛋白酶MT1-MMP切割,促進配體非依賴的信號轉導,錨定不依賴性生長和細胞遷移[19],而解整合素-金屬蛋白酶ADAM12增強Ephrin-A1從EphA2切割促進腫瘤轉移[20](圖1)。
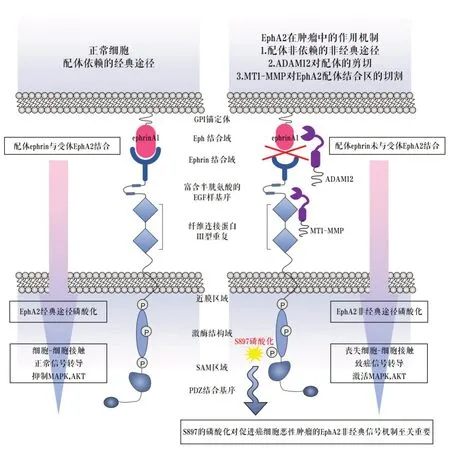
?圖1 EphA2在腫瘤中的作用
2 EPHA2表達在NPC致病過程中的作用
2.1 NPC中EPHA2信號通路與臨床意義
Li等[21]發現,在高轉移性NPC 細胞中,相對于非轉移性NPC細胞,EphA2的S897處磷酸化顯著上調,而EphrinA1 的表達水平顯著降低。AKT/Stat3/介導下磷酸化S897-EphA2 與EphA2 依賴性NPC 細胞生長、侵襲、轉移和干性呈正相關,與患者總生存率呈負相關。EphA2的S897磷酸化位點可作為NPC的一個有前景的治療靶點。該研究同時報道了ANXA1與Cbl 競爭結合EphA2,通過抑制Cbl 介導的EphA2 泛素化降解,提高EphA2 穩定性,從而促進NPC 的體內、外生長和轉移。有研究[22-23]發現,NPC 組織中EphA2表達增多,EphA2的表達與臨床分期及淋巴結轉移顯著相關。上調EphA2表達可提高NPC5-8F細胞的存活率。EphA2 的過度表達通過調節PI3K/Akt信號通路介導的細胞周期進程而非凋亡過程,其過度表達降低了NPC 細胞對紫杉醇的敏感性。EphA2降表達可提高對紫杉醇化療藥物的敏感性。EphA2還可以通過介導P-gp 蛋白表達,進而調控NPC 細胞紫杉醇耐藥性,P13K/AKT 通路可能參與這一過程,因此EphA2有望成為NPC紫杉醇化療增敏靶點[24]。
2.2 EPHA2是NPC EB病毒感染的關鍵分子
非角化性NPC 是我國NPC 的主要類型,EB 病毒(epstein-barr virus,EBV)感染是非角化性NPC 最主要的致病因素,幾乎所有的非角化性NPC 患者均存在EBV感染。EBV的感染增加了發生惡性腫瘤的危險,EBV 相關性腫瘤主要包括伯基特淋巴瘤、霍奇金淋巴瘤、彌漫大B 淋巴瘤、NK/T 細胞淋巴瘤、胃癌、NPC等。
EBV主要感染B淋巴細胞和上皮細胞[25],EBV進入靶細胞是EBV 致病的重要步驟,需要病毒糖蛋白和細胞受體介導的病毒膜和宿主細胞膜融合。病毒糖蛋白包括gp350、gHgL、gB 和gp422,雖然B 細胞和上皮細胞的感染機制不同,gHgL 和gB 是B 細胞和上皮細胞感染共同所必需的蛋白。
EBV 感染B 細胞需要其糖蛋白gp350 或剪接突變體gp220 與細胞表面受體CD21 之間的相互作用,以及病毒糖蛋白gp42 與MHCⅡ的相互作用[26-27],活化gp42 能夠將信號轉導至gH/gL 和gB,以防止其與包括整合素受體在內的其他細胞受體相互作用。因此,gp42 被認為是EBV 特異性感染B 細胞所必需的[28-30]。與B 細胞不同,EBV 進入上皮細胞與gp350/gp220和gp42無關,而上皮細胞的EBV感染也需要糖蛋白gH/gL 和gB[31-34]。Chesnokova 等[35-36]研究表明,糖蛋白gH/gL 與3 種上皮整合素受體(αvβ5、αvβ6 和αvβ8)的相互作用與EBV 進入上皮細胞有關。近年有研究報道,EphA2 受體也可以作為介導EBV 感染進入受體,Chen等[38]研究發現,EphA2與EBV編碼的gH/gL 相互作用,促進EBV 融合和內吞,此外發現整合素受體αvβ5、αvβ6 和αvβ8 對EBV 進入上皮細胞無影響,這與Chesnokova等[36-37]發現不一致。
Zhang 等[38]通過整合微陣列和RNA 干擾篩選分析發現,EphA2 對EBV 進入上皮細胞有重要作用。EphA2敲除可顯著降低EBV上皮細胞感染,EphA2過表達增加上皮細胞EBV 感染。在易受EBV 感染的B細胞淋巴瘤細胞系(Akata、Akata-EBV 和Raji)中未檢測到EphA2 的表達,表明EphA2 對上皮細胞的EBV 感染是必需的,但對B 細胞感染則非必需。EphA2 的配體結合區和纖維黏連蛋白Ⅲ型重復區是EphA2介導的EBV感染的必需區域。
上皮細胞感染EBV 需要EphA2,但EBV 編碼蛋白同樣調節EphA2 的表達。Xiang 等[39]研究發現,EBV 陽性NPC 細胞中EphA2 的表達水平明顯高于EBV 陰性NPC 細胞,PI3K/AKT 信號通路在NPC 的異種移植和臨床標本中均被顯著激活。Miao等[40]報道EphA2 和AKT 之間的相互調節環,非經典途徑的EphA2 是AKT 的底物,提示EBV 可能通過AKT 信號途徑調節EphA2的表達。
3 EPHA2的靶向治療展望
EphA2 在NPC 中過表達以及其在正常組織中有限的功能提示可以作為開發新的抗腫瘤藥物的候選靶標,并為開發新的阻斷EBV 感染策略提供新的選擇。針對EphA2 的各種治療策略正在開發中,包括小分子拮抗劑、ANXA1 衍生肽、ephrinA1 多肽類似物、單克隆抗體、免疫治療、RNAi介導的EphA2抑制、免疫偶聯物,為治療腫瘤提供了寶貴的機會。
Zhang等[38]在體外實驗中應用可溶性EphA2蛋白、抗EphA2抗體、可溶性EphA2配體ephrin A1或Eph A2抑制劑2,5-二甲基吡咯苯甲酸衍生物有效阻斷EBV上皮細胞感染。另一種小分子酪氨酸激酶抑制劑達沙替尼具有對EphA2的有效抑制活性。達沙替尼是一種口服活性抑制劑,其作用靶向多種激酶,包括BCR-ABL和Src家族激酶[41]。一項進行中的研究發現,基于ANXA1與EphA2結合的N端氨基酸20~30區,應用一種ANXA1衍生肽A1,其能切斷ANXA1與EphA2的連接,成功下調EphA2,并在體內外抑制NPC的致癌性。EphA2高表達的膠質母細胞瘤U-251MG細胞用EphrinA1 cDNA轉染,結果顯示顯著降低EphA2水平,顯著抑制細胞增殖和遷移[42]。Koolpe等[43]嘗試利用EphrinAl多肽類似物封閉EphA2治療腫瘤。EphA2激動劑單克隆抗體可以降低卵巢癌HeyA8細胞的EphA2水平,在體內研究中EphA2激動劑單克隆抗體或與劑紫杉醇聯合使用,顯著抑制了鼠腫瘤的生長[44]。EphA2表位在腫瘤細胞和正常細胞中的差異表達為腫瘤免疫治療提供了靶點[45]。EphA2肽段在多種腫瘤中被呈遞,能夠誘導腫瘤特異性CD8+T細胞反應[46],因此以EphA2為靶點的免疫治療研究逐步開展。為了抑制EphA2的過度表達,RNA干擾(RNAi)方法特異性沉默EphA2基因表達的序列已經得到應用,在胰腺癌來源的MIA-PaCa2細胞中,RNAi抑制EphA2表達,同時抑制裸鼠異種移植模型中的腫瘤生長[47]。
由于其在腫瘤細胞中的表達模式,EphA2受體被認為是一個很有前途的腫瘤歸巢靶向傳遞策略,123B9靶向EphA2酪氨酸激酶受體配體結合區。在胰腺癌和黑色素瘤模型中,123B9與紫杉醇結合,比未結合藥物更有效[48]。EphA2靶向免疫偶聯物將選擇性地誘導癌細胞的細胞毒性,同時保留正常細胞,EphA2單克隆抗體1C1偶聯到高效微管抑制劑MMAF(monomethyl auristin phenylalanine),在EphA2陽性卵巢癌HeyA8細胞和原位卵巢癌模型中顯示出療效[49]。BT5528為雙環肽結合到MMAE(maleimidocaproyl-monomethyl auristatin E)顯示出更強的藥代動力學和更小的毒副作用[50]。
隨著針對EphA2 的各種途徑靶向治療研究不斷取得進展,EphA2有望成為開發新型NPC靶向治療方法的一個有前途的策略(圖2),為NPC患者的治療提供了寶貴的機會。

圖2 EphA2在NPC致病過程中的作用及治療靶點
4 結語
EPHA2在NPC中致病過程和EBV感染中的作用是明確的,EphA2受體及其ephrin配體之間的相互關系復雜。關于EphA2和ephrin配體在其他生長因子受體及其腫瘤微環境中的功能需要進一步闡明,因此探明EphA2在NPC發生和發展中的分子機制將為今后NPC診斷和靶向治療提供新的線索,為合理設計針對Eph-ephrin系統的靶向治療策略提供理論依據。

