EPO衍生肽對大鼠缺血再灌注損傷腦微血管內皮細胞的保護作用
肖韓艷 陳光 韓民 王冬梅 徐甜穎 周淑芬
(牡丹江醫學院 1附屬第二醫院,黑龍江 牡丹江 157000;2附屬紅旗醫院;3牡丹江市第二人民醫院)
隨著中國人口老齡化社會的到來,缺血性腦血管病發病率逐年升高,該病死亡率高、致殘率高及復發率高,是目前臨床工作的重點難點〔1〕。為了改善預后,現在大多數研究集中在缺血/再灌注(I/R)損傷和缺血半暗帶與其之間的聯系〔2〕。人腦微血管內皮細胞(BMECs)是腦部微血管的組成單位,在一定程度上直接決定了缺血區血管新生,進而影響腦組織能否恢復和臨床預后〔3〕。本實驗觀察促紅細胞生成素(EPO)衍生肽(HBSP)對I/R的BMECs的作用,并探討其可能的作用機制。
1 材料與方法
1.1實驗動物 清潔級雄性SD大鼠2只,體重80~100 g,2周齡,購自牡丹江醫學院實驗動物中心。CO2恒溫孵箱購自美國Thermo公司,熒光倒置顯微鏡購自日本Olympus公司。臺式離心機購自德國Biofuge公司,AE-100電子分析天平購自瑞士Mettler公司,化學發光酶標儀購自美國Promega公司,Western印跡系統購自美國Bio-Rad公司,凝膠成像系統購自美國UVP公司。DMEM培養基(低糖)、辣根過氧化物酶標記山羊抗兔免疫球蛋白(Ig)G購自美國Hyclone公司,Ⅱ型膠原酶購自美國Invitrogen公司,HBSP購自上海科膚生物科技有限公司,噻唑藍(MTT)、二甲基亞砜(DMSO)購自美國Sigma公司,放射免疫沉淀法(RIPA)裂解液購自上海碧云天生物技術研究所,原位細胞凋亡檢測(TUNEL)試劑盒購自美國Roche公司,二喹啉甲酸(BCA)蛋白定量試劑盒購自美國Thermo公司,β-actin抗體購自美國Santa Cruz公司,電化學發光加強試劑盒購自美國Millipore公司。
1.2大鼠BMECs制備 采集2周齡SD大鼠大腦皮質,應用Ⅱ型膠原酶和分散酶+膠原酶連續消化法,篩網過濾法及兩次梯度離心法獲得腦微血管段后,接種于培養瓶中進行原代培養,進行形態學觀察,以Ⅷ因子相關抗原免疫染色法進行鑒定。
1.3構建模擬I/R模型 取生長狀態良好的第3代BMECs,沖洗后,更換為缺血液;置于 CO25%、O21%、N294%的缺氧孵箱中模擬缺血。2 h后將培養液更換為正常培養液,置于恒溫 37℃、含5% CO2的正常孵箱中繼續培養4 h。
1.4分組 隨機分為對照組(不加任何干預);I/R組、I/R+HBSP組(以1.2中方法缺血培養后,再灌注時分別加入2.5、25.0、50.0、100.0 ng/ml的HBSP)。
1.5采用MTT法檢測BMECs增殖數目 BMECs接種于96孔板,分組建立模型。每孔加入MTT溶液,每孔加入DMSO室溫下搖床低速震蕩10~15 min。于波長490 nm處檢測各孔的吸光度值(A值)。
1.6TUNEL法檢測BMECs的凋亡 細胞爬片的制備,固定,破膜,設立陽性對照組,滴加TUNEL反應液,陰性對照組只加酶濃縮液(viall液)。磷酸鹽緩沖液(PBS)液浸洗3次,滴加4′,6-二脒基-2-苯基吲哚(DAPI)反應液,于倒置熒光顯微鏡下,拍照后統計細胞總數和凋亡細胞數,每張爬片隨機取5個視野,取平均值。計算凋亡率(AI)及凋亡細胞數占總細胞數的百分比。
1.7Western印跡法檢測蛋白激酶B(Akt)、雷帕霉素靶蛋白(mTOR)、核糖體40 S小亞基S6蛋白激酶(p70S6K)的表達及磷酸化(p)水平 BMECs蛋白樣品的制備及定量后,選取了濃度為8%和10%的分離膠,將制備好的蛋白樣品取出,3 000 r/min離心5 min,上樣孔內加入蛋白樣品及蛋白Marker。電泳、轉膜后抗體雜交后發光檢測,放入凝膠成像系統曝光顯影,用軟件對條帶進行灰度分析。
1.8統計學分析 采用SPSS19.0軟件進行單因素方差分析、LSD-t檢驗。
2 結 果
2.1BMECs增殖能力 與對照組相比,I/R組吸光度值明顯下降(P<0.05)。不同濃度HBSP組吸光度顯著高于I/R組(P<0.05),顯著低于對照組(P<0.05),其中I/R+25 ng/ml HBSP組增殖能力最強,見表1。
2.2HBSP對I/R誘導的BMECs凋亡的影響 與對照組相比,I/R組BMECs的凋亡率顯著增加(P<0.05)。與I/R組相比,不同濃度的HBSP組凋亡率均明顯下降(P<0.05),下降最明顯的為I/R+25.0 ng/ml HBSP組。見表1。
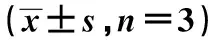
表1 各組BMBCs增殖能力和凋亡率的比較
2.3pAkt、pmTOR、pp70S6K蛋白水平 與I/R組相比,I/R+25.0 ng/ml HBSP組pAkt、pmTOR、pp70S6K水平均顯著性增高(P<0.05),見表2,圖1。
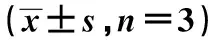
表2 各組pAkt,pmTOR,pp70S6K蛋白水平比較

1~3:對照組、I/R組、I/R+25.0 ng/ml HBSP組圖1 Western印跡法檢測Akt、mTOR、p70S6K蛋白及其磷酸化水平
3 討 論
血管新生是近年來缺血性腦血管病的研究熱點及可能的治療作用點〔4,5〕,血管新生主要是BMECs的形態改變和數量增多,從而促進新生血管增加,使缺血區腦組織再灌注,改善臨床癥狀〔6〕。
血管新生是一個復雜過程,多個細胞及細胞因子通過多個信號轉導系統參其中,具體新生過程不完全明確,但這卻是一個潛在的治療方向,是目前的研究熱點。其中磷脂酰肌醇-3-激酶(PI3K)/Akt/mTOR信號通路參與調控了細胞的生長、增殖、凋亡、血管的生成等。以往研究證實PI3K/Akt通路和絲裂原活化蛋白激酶(MAPK/ERK)通路在EPO保護腸上皮時起作用〔7〕。本實驗發現HBSP可通過PI3K/Akt/mTOR信號通路起到保護SI/R損傷后BMECs的作用,使其活性增強,抑制其凋亡。
近年來發現,EPO在人類海馬、皮層神經元、杏仁核、丘腦等腦組織廣泛分布,可能是神經系統中的一個新的信號轉導分子〔8〕,EPO有促紅細胞生成、促血栓形成作用,這是目前臨床主要應用方向,但在促進血管新生時這些副作用限制了其臨床應用。HBSP是一種可以和 EPO 組織受體(EPOR-βcR)特異性結合的線性多肽鏈,在糖尿病大鼠模型、鼠腦卒中模型、坐骨神經擠壓傷動物模型等實驗中均發現其具有刺激血管內皮細胞增殖、促進內皮細胞在基質膠表面遷移、形成管樣分支和吻合的作用〔9〕,還有抑制顱內炎癥反應、保護神經元作用,這些作用與EPO相似,且無不良反應的發生〔10〕。 本實驗發現HBSP對I/R的BMECs 有保護作用,為急性缺血性腦卒中患者的治療提供了新的方向。

