白芨工廠化育苗組培快繁技術體系的構建
李志紅 徐靜雅 旦真次仁 段金華 侯典云


摘要:白芨的野生資源瀕臨匱乏,其種子自然萌發比較困難,因此傳統的白芨種植方法已不適于市場需求。以白芨種子為材料,探究白芨種子萌發、生根及組培苗移栽馴化的最佳方法。白芨種子萌發最佳培養基為MS+蔗糖30 g/L+瓊脂8 g/L+馬鈴薯10 g/L,增殖培養基為MS+蔗糖30 g/L+瓊脂9 g/L+KT 1.0 mg/L+NAA 0.2 mg/L,最佳生根培養基為MS+NAA 0.2 mg/L+IAA 1.0 mg/L+蔗糖30 g/L+瓊脂9 g/L+馬鈴薯25 g/L,馬鈴薯可促進白芨組培苗根的生長,組培苗馴化的最佳處理為預先將培養瓶開瓶進行適應性鍛煉,2~3 d后把組培苗移至煉苗基質中,這樣可提高白芨組培苗的成活率。白芨工廠化育苗體系的建立可有效地擴大白芨的種植規模,縮短育苗時間,從而更好地利用和保護白芨野生資源。
關鍵詞:白芨;組織培養;快速繁殖;種子萌發率;組培苗;叢生芽;生根率;成活率
中圖分類號:S567.23+9.043 文獻標志碼: A文章編號:1002-1302(2020)13-0080-04
收稿日期:2019-08-30
基金項目:國家自然科學基金(編號:1404829);西藏自治區重點科技計劃(編號:2015-ZD-NM-0)。
作者簡介:李志紅(1996—),女,河南新鄉人,碩士,主要從事藥用植物分子生物學研究。E-mail:1600356814@qq.com。
通信作者:侯典云,博士,副教授,碩士生導師,主要從事藥用植物資源評價與利用研究。E-mail:dianyun518@163.com。白芨[Bletilla striata(Thunb.)Reichb.f.]為蘭科多年生草本植物,其干燥塊莖入藥,具有收斂止血、消腫生肌的功效,可用于治療吐血、外傷出血、皮膚皸裂等癥[1],還具有很高的園林觀賞價值[2]。現代藥理研究表明,白芨具有抗菌[3]、止血[4-5]、促進創傷愈合[6]、抗腫瘤[7-8]等作用。研究表明,白芨的主要化學成分是多糖、三萜及皂苷等[9-10]。白芨在我國分布較為廣泛,在云南、廣西、甘肅、貴州等地均有發現[11]。近年來市場對白芨的需求量不斷加大,導致野生白芨遭到過度的開采,野生資源急劇減少,現已是國家重點保護的野生藥用植物[12]。但白芨的常規種植卻受到很大的限制,每個白芨蒴果內大約有幾萬顆種子,種子細小且無胚乳,自然條件下出苗率只有萬分之一[13]。目前主要是依靠人工栽培的方法來增加白芨的產量,但這種方法不僅周期長,且白芨苗易染病害,不能滿足大規模栽培的需要[14]。利用組織培養技術對白芨外植體進行離體培養,不僅可實現工廠化育苗選育白芨優良品種,而且可保護白芨野生資源[15]。
1材料與方法
1.1材料處理
選取未開裂的白芨成熟蒴果,用75%乙醇棉球擦拭表面后,在超凈工作臺內,用75%乙醇浸泡 30 s 后取出,用0.1%的氯化汞溶液浸泡6 min后,用無菌水沖洗5次,每次30 s,最后用無菌濾紙吸干蒴果表面水分。在無菌條件下將白芨種子均勻接在培養基上,置于培養室內進行約10 d的暗培養,當種子出綠時,可轉為光培養,培養時間為15~20 d。
選取表面完整無病毒、無發芽跡象的普通市售馬鈴薯,切塊煮熟后,用紗布過濾,棄濾渣后備用。
1.2種子萌發最適培養基篩選
取白芨無菌種子于表1中的各組MS培養基中培養,每組培養基均添加30 g/L蔗糖,8 g/L瓊脂,培養基pH值調至5.8~6.0,篩選白芨種子萌發最佳培養基,查看培養7、30 d時種子情況,計算接種30 d時的萌發率。萌發率以培養基的底面積計算。
1.3增殖繼代培養
繼代培養的關鍵影響因素是植物激素之間的配比[16],本研究所用增殖培養基為MS培養基,并向其中添加3%蔗糖,0.9%瓊脂,1.0 mg/L激動素(KT),0.2 mg/L NAA,調節pH值為5.5~6.0。
在超凈工作臺內,將無菌種子萌發所獲得的叢生芽小苗分株接種在增殖培養基上,置于培養室內培養,約50 d后獲得3~5 cm的白芨叢生苗。
1.4叢生芽生根培養
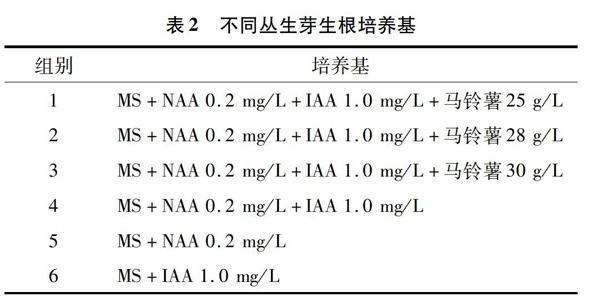
將4 cm左右的叢生芽轉接到表2所示培養基中進行生根培養,各培養基均添加蔗糖30 g/L,瓊脂9 g/L,pH值調至5.8~6.0。每組培養基接種300株,接種30 d后統計叢生苗生根的株數,計算生根率。
1.5白芨無菌苗馴化
制作煉苗基質時需將中位泥炭土滅菌,然后將中位泥炭土、珍珠巖以及碎木屑按照體積比 5 ∶2 ∶3 的比例混合后,加入滅菌的蒸餾水拌勻,使其含水量為50%~55%,然后將所制作的煉苗基質裝入育苗盤中, 放在遮陽率為50%的拱棚中備用,控制拱棚中的濕度為50%~55%,溫度為 15~25 ℃。
注:IAA為吲哚-3-乙酸。
挑選生長健壯、根系較發達的白芨組培苗,打開培養瓶瓶蓋,向瓶內噴灑無菌水,每瓶噴灑約 6 mL,置于培養室內2~3 d后,將組織培養瓶移出培養室再放置2~3 d。從培養瓶中取出白芨組培苗,并用蒸餾水清洗根部殘留的培養基后,置于 0.2 mg/L 的NAA中浸泡30 s,需注意通風晾苗,以防根莖發霉[17]。將白芨苗種植于表3所示的煉苗基質中,煉苗90 d后移栽至大田種植,并計算煉苗成活率。
2結果與分析
2.1不同培養基對白芨種子萌發的影響
不同培養基對白芨種子萌發的影響見圖1和圖2。當MS培養基中無馬鈴薯和外源激素NAA時,接種30 d后的白芨種子萌發率僅有60%,低于添加馬鈴薯或NAA后的萌發率,而添加馬鈴薯的培養基內的種子萌發率均遠高于添加NAA的培養基。通過對比組1和組5、組2和組6可以看出,在加入馬鈴薯后如果再次添加NAA反倒不利于白芨種子的萌發。因此,本試驗所用的種子萌發培養基無需添加外源激素,即可有效促進白芨種子的萌發,且與添加激素的培養基相比,能夠取得更高的萌發率。
2.2叢生芽生長
白芨叢生芽繼代培養以MS培養基為基礎培養基,向其中添加外源激素KT和NAA以促進叢生芽的生長。白芨叢生芽的生長結果見圖3,可以看出,白芨叢生苗生長茂密, 葉翠綠且寬,長勢較好,表明
外源激素KT和NAA有利于提高白芨叢生苗的質量,促進白芨生長與增殖。
2.3不同培養基對叢生芽生長及生根的影響
不同培養基對叢生芽生根的影響見圖4和圖5。由圖5可知,在生根培養基中添加馬鈴薯后,白芨叢生芽生根率高于未添加馬鈴薯的生根培養基,表明馬鈴薯對白芨生根有明顯的促進作用,可使白芨叢生芽生根率較高,根系較發達。因此本試驗中MS+NAA 0.2 mg/L+IAA 1.0 mg/L+蔗糖30 g/L+瓊脂 9 g/L+馬鈴薯25 g/L為白芨叢生芽生根的最佳培養基。
2.4白芨組培苗煉苗、馴化
不同煉苗培養基對白芨組培苗成活率的影響
如圖6所示。采用表3中組1所述的煉苗基質時,白芨組培苗成活率可達98%,遠高于其他3組。組1的配比較其他3組更為合理,保證了煉苗過程中的水分和營養物質供應以及透氣性,提高了白芨組培苗馴化的成活率。組1的組成成分易獲取,若將其運用在白芨的工廠化育苗中,可降低白芨的培育成本。
3討論
在白芨種子萌發試驗中,外源激素NAA和有機添加物馬鈴薯泥起到了明顯的促進作用,接種后 30 d,未加激素和有機添加物的MS基礎培養基中的種子萌發率不高,而同時加入馬鈴薯和NAA培養基中的白芨種子萌發率反倒低于單獨添加馬鈴薯或NAA的培養基。因此,本試驗中最佳的白芨種子萌發培養基為MS+蔗糖30 g/L+瓊脂 8 g/L+馬鈴薯10 g/L。筆者所在實驗室還發現,在5 ℃條件下儲存的種子萌發率比 -20 ℃ 條件下的高,說明5 ℃的溫度條件較溫和,可保護種子的生物活性,使得種子萌發率較高。
白芨組培苗移栽的成活率由生根條件決定。研究表明,外源激素NAA更適合誘導生根[18]。本試驗研究發現,在生根誘導培養基中添加有機物馬鈴薯,會促進白芨組培苗的生根。白芨組培苗在培養瓶內的生長主要依靠培養基提供養分,因此煉苗過程前的開瓶、噴灑無菌水可增強白芨無菌苗對外界環境的適應性[19]。研究發現,對外界環境的適應性鍛煉促進了蘭科植物組培苗的生長及移栽成活率[20]。本試驗以中位泥炭土、珍珠巖和碎木屑作為白芨組培苗的移栽介質。中位泥炭土是介于高位和低位之間的過渡性泥炭,透氣性好,保水,富含營養物質。當中位泥炭土、珍珠巖、碎木屑按體積比 5 ∶2 ∶3 混合時,不僅能增強培養基質的排水能力,還能加大基質間的孔隙,防止土壤硬結,有助于組培苗根系的呼吸和對營養物質的吸收,進而促進組培苗的生長[21]。
白芨喜溫暖、陰涼和較濕潤的環境,不耐寒,怕積水。因此大田種植期間,切忌向育苗床頻繁灑水,水分過多會導致地下塊莖的腐爛。由于組培苗移栽初期新根系尚不發達,且土壤疏松透氣,排水良好,因此移栽初期的養分供應以葉面噴施為主。可選擇噴施對白芨產量影響最大的氮肥[22]。
本試驗以白芨種子為材料,通過誘導種子萌發、增殖和生根,成功建立了白芨工廠化育苗快繁體系,并獲得了大量可用于大田種植的組培苗,為種植戶提供了優良種苗及技術支持。最佳誘導種子萌發的培養基配比為MS+蔗糖30 g/L+瓊脂 8 g/L+馬鈴薯10 g/L,接種30 d內種子萌發率可達100%;增值繼代培養基為MS+蔗糖30 g/L+瓊脂9 g/L+KT 1.0 mg/L+NAA 0.2 mg/L;生根培養基為MS+NAA 0.2 mg/L+IAA 1.0 mg/L+蔗糖 30 g/L+瓊脂9 g/L+馬鈴薯25 g/L,生根率可達99%。向培養基內添加馬鈴薯等有機添加物可促進白芨種子的萌發與根的生長。
參考文獻:
[1]國家藥典委員會. 中華人民共和國藥典(一部)[M]. 北京:中國醫藥科技出版社,2015:95.
[2]陸峻波,劉亞輝,楊永紅,等. 從文獻分析看我國白芨研究進展[J]. 云南農業大學學報(自然科學版),2011,26(2):288-292.
[3]彭芙,萬峰,熊亮,等. 白及抑菌作用及其活性部位的初步研究[J]. 時珍國醫國藥,2013,24(5):1061-1063.
[4]萬大群,趙仁全,劉海,等. 白及的成分、藥理作用和臨床應用研究進展[J]. 中國藥業,2017,26(2):93-96.
[5]董莉,董永喜,劉星星,等. 白芨多糖對大鼠血小板聚集、凝血功能及TXB_2,6-keto-PGF_(1α)表達的影響[J]. 貴陽醫學院學報,2014,39(4):459-462.
[6]俞林花,聶緒強,潘會君,等. 白及多糖對糖尿病潰瘍創面愈合的作用研究[J]. 中國中藥雜志,2011,36(11):1487-1491.
[7]孫愛靜,龐素秋,王國權. 白及化學成分與抗腫瘤活性研究[J]. 中國藥學雜志,2016,51(2):101-104.
[8]左霞,常明泉,陶平德,等. 白及在腫瘤治療中的應用[J]. 中南藥學,2015,13(1):58-60.
[9]He X R,Wang X X,Fang J C,et al. Bletillastriata:Medicinal uses,phytochemistry and pharmacological activities[J]. Journal of Ethnopharmacology,2017,195:20-38.
[10]王愛民,王永林,鄭林,等. 白及藥材中多糖的含量測定[J]. 中國中藥雜志,2009,34(22):2963-2965.
[11]任風鳴,劉艷,李瀅,等. 白及屬藥用植物的資源分布及繁育[J]. 中草藥,2016,47(24):4478-4487.
[12]傅立國. 中國植物紅皮書——稀有瀕危植物 (第一冊)[M]. 北京:科學出版社:1992,494-495.
[13]張佳寧,田茂琳,周祥云,等. 瀕危名貴藥材白芨組培繁育技術研究[J]. 甘肅科技,2016,32(24):122-124.
[14]林福林,楊昌云,楊薇薇,等. 中藥白芨的現代研究概況[J]. 中國醫院藥學雜志,2013,33(7):571-573.
[15]王躍華,陳燕,劉曼,等. 培育優質白芨苗條件篩選研究[J]. 江蘇農業科學,2018,46(20):165-167.
[16]王高鵬,孟淑霞,程超民,等. 白及組培苗繁育組織繼代培養研究[J]. 現代園藝,2018(8):9-10.
[17]孟彪,苗桂林,許東東,等. 白及組培苗移栽技術研究[J]. 遼寧中醫藥大學學報,2014,16(2):56-58.
[18]林伊利,李偉平,馬丹丹,等. 白及組培快繁的實驗研究[J]. 中華中醫藥學刊,2012,30(2):336-339,450.
[19]王月英,陳義增,曾愛平,等. 基質及煉苗處理對蝴蝶蘭組培苗落地和成苗生長的影響[J]. 浙江農業科學,2004(1):16-18.
[20]賈守海. 如何提高組培試管苗移栽的成活率[J]. 民營科技,2011(11):136.
[21]盧玨,王宇峰,金濤,等. 基于底泥堆肥的園林綠化基質生產研究[J]. 杭州師范大學學報(自然科學版),2019,18(4):411-417.
[22]李姣紅. 白芨營養特性與施肥效應研究[D]. 貴陽:貴州大學,2007.張謀草,張俊林,趙玉娟,等. 溫度變化對隴東地區玉米不同器官生長率和產量的影響[J]. 江蘇農業科學,2020,48(13):84-90.doi:10.15889/j.issn.1002-1302.2020.13.017

