斑馬魚幼魚整魚石蠟切片制作
何嘉玲暴 國王天奇張長勇李 楠孫德明
(國家衛生健康委科學技術研究所實驗動物中心,北京 100081)
斑馬魚(Danio rerio)又名藍條魚、花條魚、斑馬擔尼魚,隸屬輻鰭亞綱鯉科短擔尼魚屬,是發育生物學、遺傳學、毒理學等領域重要的脊椎動物模型[1-5]。 然而,目前國內尚缺乏其系統的組織形態學描述。 為數不多的國內研究也較多地關注斑馬魚成魚的組織形態學變化,如成魚的腦、腸道、心臟和肝等[6-8]。 在生物學及醫學領域,由于斑馬魚早期胚胎透明,易于觀察,其在各領域的應用遠遠較成魚廣泛。 然而目前國內尚未檢索到關于斑馬魚幼魚石蠟切片條件優化的文獻。 研究者在進行幼魚石蠟切片的過程中多采用傳統石蠟切片制備方法,切片質量良莠不齊[9-10]。 斑馬魚幼魚體型小,含水量高,有必要摸索出一套適合于斑馬魚幼魚的石蠟切片方法,以獲得優質的組織切片。
優質的石蠟組織切片能夠保持細胞間的正常相互關系,清晰顯示組織細胞的形態結構,真實地展示組織形態學結構。 在條件摸索中我們發現,不恰當的石蠟切片制作方法,可能人為導致正常的生理組織出現“異常”的形態和結構,影響實驗的判斷。 本實驗以斑馬魚幼魚整魚為實驗材料,從固定、脫水,透明等環節出發摸索實驗條件。 通過HE 染色后采集圖像,展示不同條件下獲得的切片效果,為后續研究者進行斑馬魚幼魚切片制作提供有益的參考。
1 材料和方法
1.1 實驗動物
實驗所用斑馬魚成魚為野生型TU 品系,由北京大學生命科學學院細胞增殖與分化教育部重點實驗室張博教授饋贈,20 ~24 周齡,體重約350 ~390 mg,雌雄各4 尾。 按照Westerfield[11]述及的方法飼養、繁育、收集受精卵。 受精卵清洗和消毒后,放入含有1‰(w/v)亞甲基藍的培養液中,于28.5℃培養箱中培養4 d,期間每天更換新鮮培養液。 上述斑馬魚飼養及實驗均在國家衛生健康委科學技術研究所實驗動物中心[SYXK(京)2018-0010]完成。 所有研究方案均通過國家衛生健康委科學技術研究所實驗動物福利倫理委員會審批(NRIFH11-1912-6),嚴格遵循3R 原則。
1.2 主要試劑與儀器
Tricaine(sigma);多聚甲醛(天津市致遠化學試劑有限公司);波恩氏液(北京百奧萊博科技有限公司);乙醇(宜興市第二化學試劑廠);二甲苯(宜興市第二化學試劑廠);叔丁醇(上海阿拉丁化學試劑有限公司);蘇木素染液(珠海貝索生物技術有限公司);伊紅(天津市大茂化學試劑廠)。 切片機(德國萊卡公司);正置光學顯微鏡(德國萊卡公司)。
1.3 實驗方法
1.3.1 固定、脫水、透明
受精后4 d(4 days post fertilization,4dpf)幼魚固定前,用0.02% 的Tricaine(ethylm-aminobenzoate,1 mol/L Tris-HCl,pH9.0)進行安樂死。 隨后分別用4%多聚甲醛(paraformaldehyde,PFA)和Bouin’s液固定24 h。 固定完成后,4%多聚甲醛固定的樣品放入裝有蒸餾水的離心管中,置搖床上,清洗3 ~4次,每15~30 min 換一次水。 Bouin’s 液固定的樣品放入裝有70%乙醇(配制時50 mL 中加30 μL 濃氨水)的離心管中,同法清洗固定組織,以去除固定液中色素的干擾。
脫水時間分別為1 min 和4 min,叔丁醇脫水后直接浸蠟,乙醇脫水后經二甲苯透明后浸蠟,透明程序為:無水乙醇-二甲苯等體積混合液2.5 min,二甲苯Ⅰ1 min,二甲苯Ⅱ1 min。
實驗設計詳見表1、表2 和表3。
1.3.2 浸蠟、包埋、切片
按照常規方法進行浸蠟,包埋和切片處理。 透明后于65℃浸蠟,共2 次,分別為20 min 和40 min。為獲得斑馬魚不同切面的切片,包埋時可使用高精密鑷子在液態石蠟中擺放幼魚。 待蠟塊徹底冷卻后,蠟塊于-20℃冰箱冷凍1 ~2 h,修塊,制備5 μm切片。
1.3.3 HE 染色
石蠟切片的HE 染色參考常規方法進行。 切片65℃干烤1 h 后立即浸入二甲苯脫蠟,二甲苯Ⅰ和二甲苯Ⅱ各25 min。 隨后梯度水化:無水乙醇Ⅰ,無水乙醇Ⅱ,95%乙醇Ⅰ,95%乙醇Ⅱ,75%乙醇,蒸餾水各10 min。 蘇木精-伊紅(HE)染色按常規方法進行:蘇木素染液染色2 min,蒸餾水洗3 次,鹽酸乙醇2 s,蒸餾水洗3 次,氨水乙醇20 s,蒸餾水洗3 次,伊紅染色1 min,蒸餾水洗3次。 隨后75%乙醇快速脫水,95%乙醇Ⅰ,95%乙醇Ⅱ,100%乙醇Ⅰ,100%乙醇Ⅱ各脫水5 min,二甲苯Ⅰ和二甲苯Ⅱ各15 min,最后中性樹膠封片,制成永久切片。 用正置顯微鏡觀察并采集圖片。
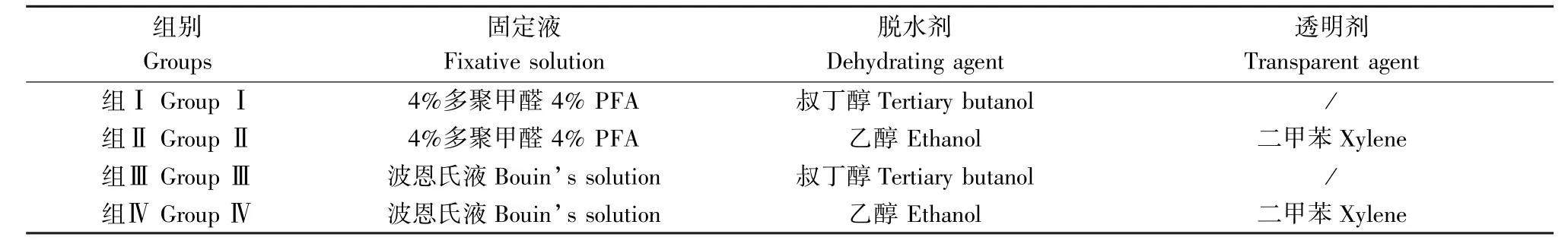
表1 斑馬魚4 dpf 幼魚石蠟切片實驗分組Table 1 Experimental group of 4dpf zebrafish larva for paraffin section
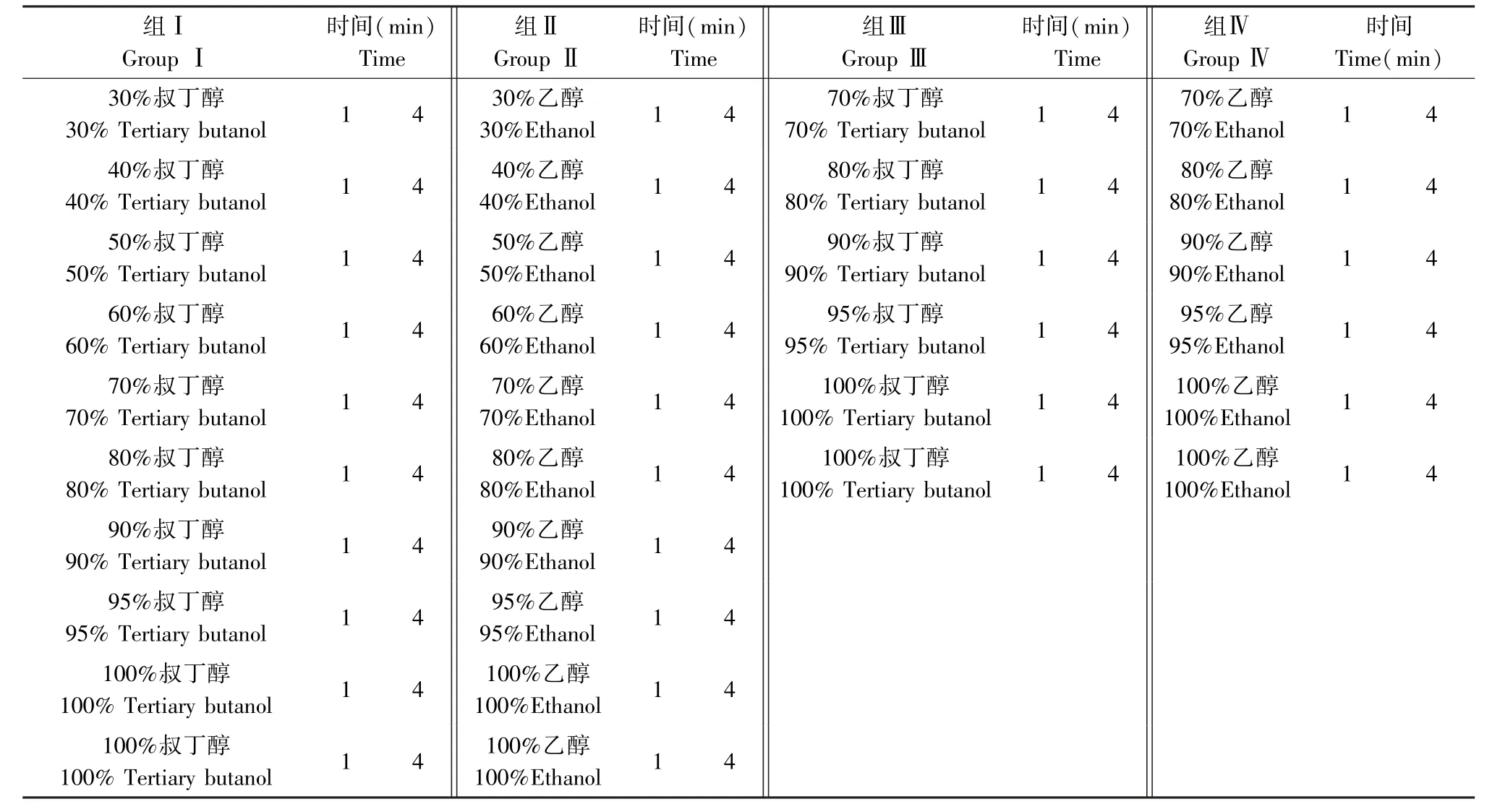
表2 脫水過程Table 2 Process of dehydration
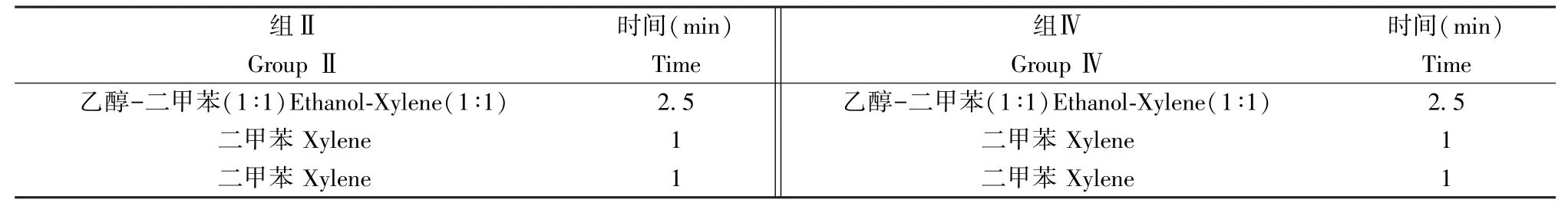
表3 透明過程Table 3 Process of transparency
2 結果
2.1 固定劑對切片效果的影響
參考斑馬魚成魚組織的固定,采用應用較多的單一固定劑4% PFA 和復合固定劑Bouin’s 液分別固定斑馬魚幼魚。 4%多聚甲醛固定的幼魚,后續無論何種脫水條件,腦組織(圖1a、1b、1e、1f)都出現了明顯的收縮和脆裂,骨骼肌纖維也出現不同程度的收縮,間隙異常增寬(圖2a、2b、2e、2f)。 而經Bouin’s 液固定的幼魚,都較好地保持組織的原形,低倍鏡下沒有觀察到明顯的組織脆裂的現象(圖1C、1D、1G、1H)。 但對于幼魚深部的器官,如腸道等則受固定液影響較小,除4% PFA 固定后乙醇梯度脫水1 min 的幼魚(圖2b)以外,其余PFA 固定幼魚的腸道沒有出現類似腦和肌肉組織脆裂的現象。結果詳見圖1。
此外,在固定過程中應注意,為避免機體出現自溶引起組織結構的改變,魚施行安樂死后,應盡快進行固定;固定過程中,由于前期硬度不夠,應確保幼魚水平擺放,避免體軸彎曲而影響后續切片和觀察。
2.2 脫水對切片效果的影響
選用常規的脫水劑乙醇和脫水能力較弱的叔丁醇分別進行脫水。 為防止高濃度脫水劑脫水時間過長導致組織脆化,摸索脫水時間,分別進行1 min 和4 min 梯度脫水。 乙醇屬于非石蠟溶劑,脫水后選擇二甲苯進行透明,叔丁醇為兼石蠟溶劑,無需進行透明,脫水后可直接浸蠟。
對于腦組織,經PFA 固定的幼魚,無論用叔丁醇或乙醇作為脫水劑,脆裂都比較嚴重,叔丁醇脫水(圖1a、1e)的脆裂程度較乙醇脫水(圖1b、1f)稍輕。 對于眼睛,經PFA 固定的幼魚,都出現了明顯的裂痕,其中叔丁醇1 min 梯度脫水的效果最差,裂紋非常嚴重(圖1a)。 在Bouin’s 液固定的魚中,對于腦組織和眼睛,無論是叔丁醇或是乙醇梯度脫水,都獲得了較好的切片效果,切片無褶無裂痕。但乙醇脫水時間為4 min 的樣品,可觀察到輕微的刀痕(圖1H、1h),可能與脫水時間較長,組織硬度較大有關系。 因此,對于腦組織而言,Bouin’s 液固定后,脫水時間不宜過長,叔丁醇或乙醇1 min 梯度脫水即可獲得較好的切片效果。

圖1 4 d 斑馬魚幼魚不同實驗分組的大體和局部切片效果Note.The pictures marked with lower case letters are partial enlarged views of the pictures marked with corresponding upper case letters.A/a, 4% PFA fixation, tert-butanol dehydration for 1 min.E/e, 4% PFA fixation, t-butanol dehydration for 4 min.B/b, 4% PFA fixation, ethanol dehydration for 1 min.F/f, 4% PFA Fixation, ethanol dehydration for 4 min.C/c, Bouin’s solution fixation, tert-butanol dehydration for 1 min;G/g,Bouin’s solution fixation, tert-butanol dehydration for 4 min.D/d, Bouin’s solution fixation, ethanol dehydration for 1 min.H/h, Bouin’s solution fixed, ethanol dehydrated for 4 min.Figure 1 General and local sectioning effects of different experimental groupings of 4dpf zebrafish larva
對于肌肉組織,經PFA 固定的幼魚,無論利用叔丁醇或乙醇作為脫水劑的切片效果差異不大,都出現不同程度的收縮,間隙增寬。 對于Bouin’s 固定的樣品,使用乙醇進行脫水的樣品出現輕微的肌纖維收縮(圖2d、2h),叔丁醇(圖2c、2g)的切片效果優于乙醇。 觀察脫水時間對肌肉組織切片效果的影響發現,脫水時間4 min 樣品(圖2e、2f、2g、2h)的收縮程度明顯小于1 min 梯度脫水的樣品(圖2a、2b、2c、2d)。 因此,對于肌肉組織,Bouin’s 液固定后,使用叔丁醇脫水優于乙醇,且脫水時間不宜過短,4 min 的叔丁醇梯度脫水能達到較好的切片效果。 結果詳見圖2。

圖2 4 d 斑馬魚幼魚不同實驗分組的大體和局部切片效果Note.The pictures marked with lower case letters are partial enlarged views of the pictures marked with corresponding upper case letters.A/a, 4% PFA fixation, tert-butanol dehydration for 1 min.E/e, 4% PFA fixation, t-butanol dehydration for 4 min.B/b, 4% PFA fixation, ethanol dehydration for 1 min.F/f, 4% PFA Fixation, ethanol dehydration for 4 min.C/c, Bouin’s solution fixation, tert-butanol dehydration for 1 min.G/g,Bouin’s solution fixation, tert-butanol dehydration for 4 min.D/d, Bouin’s solution fixation, ethanol dehydration for 1 min.H/h, Bouin’s solution fixed, ethanol dehydrated for 4 min.Figure 2 General and local sectioning effects of different experimental groupings of 4 dpf zebrafish larva
2.3 不同組織最佳的切片條件
對于斑馬魚幼魚的不同組織,由于存在蛋白質,脂肪及水等含量的差異,對切片的條件有不同的要求[12]。 在本文摸索的條件中,對于斑馬魚幼魚的腦組織,最佳的固定液為Bouin’s 液,后續使用乙醇或叔丁醇脫水1 min 可以達到良好的切片效果;對于骨骼肌,最佳的固定液仍是Bouin’s 液,但是對于肌肉組織,叔丁醇脫水的效果明顯優于乙醇,并且脫水4 min 的效果優于脫水1 min 的效果;消化道組織,受不同固定液和脫水液的影響較小,除4%PFA 固定后,乙醇1 min 梯度脫水出現了較明顯的脆裂外,其余固定和脫水條件下,切片效果都較好,沒有顯著差異;對于幼魚眼睛,4% PFA 固定后裂紋明顯,而經Bouin’s 液固定后,除了乙醇梯度脫水4 min 出現輕微刀痕外,都能獲得良好的切片效果。結果詳見表4。
3 討論
斑馬魚由于其獨特的優勢在生命科學領域得到了廣泛的應用。 相較于成魚,斑馬魚胚胎和幼體具有身體透明,便于顯微鏡觀察,數量多,有利于高通量實驗等優點,在藥物發育毒理學,環境毒理學,腫瘤異體移植,遺傳學,疾病動物模型等方面應用更為廣泛[13-14]。 研究者往往通過操作斑馬魚幼魚或胚胎,觀察表型變化,獲得實驗結論。 而組織器官細胞水平的變化是表型變化的根本。 組織切片技術克服了無法觀察組織內部變化的不足,是反映組織實時狀況最有效的手段,甚至是某些診斷和評價的金標準。
隨著斑馬魚應用的日益廣泛,筆者通過搜索引擎發現,研究人員對斑馬魚幼魚石蠟切片方法有較大的需求。 但經文獻搜索,發現國內關于幼魚石蠟切片的文獻非常匱乏。 僅有幾篇關于斑馬魚成魚石蠟切片的文獻[7,14-15]。 斑馬魚幼魚具有與成魚不同的組織特性,加之體型小,較難分離組織器官等特點,亟需一套適用于斑馬魚幼魚整體石蠟切片的方法。
合適的染色前處理是獲得優質組織病理切片的基礎。 筆者通過多輪實驗和實驗條件摸索,獲得了良好的幼魚整體石蠟切片結果。 以下將重點討論實驗中需要注意的問題及解決辦法。
染色前的固定、脫水、透明、浸蠟是影響切片質量至關重要的環節。 處理不當,石蠟切片往往容易出現收縮,裂紋等問題,既不符合石蠟切片的要求,也影響結果的判斷。
固定是石蠟切片制片的關鍵,良好的固定劑能迅速穿透組織,保持組織原形,不發生膨脹或收縮。多聚甲醛是甲醛的聚合物,性質比甲醛穩定,在傳統的石蠟切片組織樣本固定中廣泛應用。 但本實驗結果顯示,斑馬魚幼魚經4% PFA 過夜固定后,導致了幼魚組織不可回復的硬化,無論后續脫水條件如何優化,腦組織和肌肉組織都出現了明顯的裂痕,嚴重影響實驗觀察。 可能與斑馬魚幼魚組織器官的特性有關。 Bouin’s 固定液是一種混合固定劑,對幼魚組織硬化作用適中,后續經過適當的脫水,透明和浸蠟等處理,能獲得較滿意的切片,與斑馬魚成魚結果類似[15]。
脫水就是除去組織內部水分以便后續石蠟的浸入,梯度乙醇是應用最廣泛的脫水劑,但對于斑馬魚幼魚的肌肉組織而言,即使是30%起始的梯度乙醇脫水都能引起肌肉纖維的收縮,說明對于幼魚而言,乙醇作為脫水劑脫水能力過強。 改用叔丁醇后,肌肉收縮現象顯著改善。 另外叔丁醇作為脫水劑兼透明劑,可以獲得良好的脫水效果,同時避免二甲苯透明的環節,減少了導致組織硬化和脆裂的可能。 對于肌肉組織,Bouin’s 液固定后,無論使用乙醇或叔丁醇作為脫水劑,4 min 的脫水效果都優于1 min,可能是與短時間內脫水不盡,殘留在組織細胞中的水分無法與二甲苯相溶,導致石蠟無法完全滲入有關。

表4 不同組織在不同條件下的切片效果Table 4 Effects among different tissues under different conditions
通過條件摸索和優化,本方法制備的石蠟切片能達到石蠟切片的質量要求,可供以斑馬魚幼魚為研究對象的研究者參考。

