miR-181b 調控Mex3B 蛋白對動脈粥樣硬化斑塊形成及分子機制研究
張詩淵
(南昌大學第二附屬醫院超聲科,南昌 330006)
動脈粥樣硬化(atherosclerosis,AS)作為一種具有潛在致命性的累及全身動脈脂質代謝紊亂的慢性炎癥疾病,是造成心腦血管惡性事件的主要原因之一,其中頸動脈為多發部位。 頸動脈粥樣硬化(carotid atherosclerosis,CAS)是缺血性腦卒中的危險因素。 研究表明[1]AS 是一種炎癥性疾病,其發生、發展與動脈內膜中的脂質沉積密切相關,但目前AS 的病理生理機制尚未完全明確。 微小核糖核酸(microRNA,miRNA)是一種內源性的具有調控功能的非編碼 RNA。 研究表明[2]多種miRNA 參與調節心腦血管系統中細胞的增殖、分化、凋亡、衰老等細胞生物學行為。 Li 等[3]研究表明miRNA-21 增強血管平滑肌的細胞增殖,推動AS 的進程。 Gao等[4]報道血漿中的miR-126 和miR-143 的含量可以作為動脈粥樣硬化的新型生物標志物。 近來miR-181b 與 AS 的關系引起關注。 Sun 等[5]研究表明miR-181b 調控Notch1 通路影響AS 血管內皮組織的炎性反應。 Zhong 等[6]研究證實 miR-181b 聯合STAT3 通路影響 AS 細胞模型的凋亡率,但關于miR-181b 對AS 斑塊影響的作用機制未見報道。 肌肉過量蛋白-3(muscle excess protein-3,Mex3)作為早期胚胎發展中的一種RNA 結合蛋白,可以抑制細胞內蛋白的表達。 研究表明[7]在四種人類Mex3 蛋白中,Mex3B 的表達與機體炎癥應激密切相關。 本研究通過維生素D3 聯合高脂飲食法構建動脈粥樣硬化大鼠模型,探討miR-181b 和Mex3B 對動脈粥樣硬化斑塊形成的調控機制,以期為臨床研究提供數據支撐。
1 材料和方法
1.1 實驗動物
7 ~8 周無特殊病原體(specific pathogen free,SPF)級雄性 SD 大鼠 40 只,(200±20)g,由江西中醫藥大學醫學實驗動物科學部提供[SCXK(贛)2018-0003],動物實驗在南昌大學生命科學研究院[SYXK(贛)2015-0002]進行;依照南昌大學醫學院醫學實驗動物科學部實驗動物管理辦法,室溫21℃~25℃下,濕度維持在60%左右,自然光照、標準飼料、自由飲水、單籠飼養一周后用于實驗。 所有動物福利和實驗程序均嚴格遵守我院的《實驗動物的護理和使用指南》及相關道德規范,本研究中涉及動物的使用及操作按3R 原則給與動物人道的關懷,并經本院實驗動物管理倫理委員會批準(IACUC(贛)-2019-076)。
1.2 主要試劑與儀器
miR-181b 抑制物 miR-181b-inhibitor 及 miR-181b 抑制物陰性對照miR-181b-inhibitor-NC 由上海吉瑪技術有限公司設計完成。
維生素D3 注射液(上海通用藥業有限公司,國藥準字:H31022404,規格:1 mL:7.5 mg,以維生素D3 計);高脂飼料(81.3%基礎飼料+10%豬油+5%白糖+3% 膽固醇+0.5%膽酸鈉+0.2%丙基硫氧嘧啶,總能量為6 kcal/g。 等級:A 級)由我院醫學實驗動物中心提供。
LipofectamineTMRNAiMAX 轉染試劑(德國QIAGEN 公司);全蛋白抽提試劑盒(日本TOYOBO公司);PBS 緩沖溶液、雙熒光素酶測定試劑盒、蘇木精伊紅(hematoxylin eosin,E) 試劑盒(美國Invitrogen 公司);腫瘤壞死因子-α(tumor necrosis factoR-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)抗體、基質金屬蛋白酶-9(matrix metalloprotein,MMP-9)抗體(美國 Abcamn 公司);麻醉劑、Mex3B抗體(美國 Jackson 公司);反轉錄試劑盒、Western blot 試劑盒(美國 sigma 公司);油紅 O 染色試劑盒(美國R&D 公司);脫氧核糖核苷酸末端轉移酶介導的缺口末端標記法(terminal-deoxynucleotidyl transferase mediatednick end labeling,TUNEL)試劑盒(美 國 Amresco 公 司 );增 強 化 學 發 光(electrochemiluminescence,ECL)化學發光顯色試劑盒(美國 Millipore 公司)。
YJ-875 A 醫用凈化工作臺、高速低溫離心機(北京六一儀器廠);LIOOS600T 熒光顯微鏡(日本尼康公司);Bio-rad 凝膠成像系統(Bio-rad 公司);-80℃深冷冰箱(德國維根斯公司);Leica RM2135 組織切片機(德國 Leica 公司);RT-PCR 儀(美國 Palo Alto 公司);LOGIQ7 型彩色多普勒超聲成像系統(美國GE 公司);Vevo 2100 高分辨率小動物超聲儀(加拿大 Visual Sonic 公司)。
1.3 實驗方法
1.3.1 動脈粥樣硬化動物模型構建及實驗分組
將40 只 SD 大鼠隨機分成 4 組,每組 10 只,分別為:正常組、模型組、miR-181b-inhibitor-NC 組(對照組)和miR-181b-inhibitor 組(實驗組)。
準確量取2.5 μL 的 LipofectamineTMRNAiMAX分別與 9 μL 的 miR-181b-inhibitor-NC 和 miR-181binhibitor 混合均勻,37℃下靜置2 h。 通過尾靜脈分別注射7 μL 混合液到對照組和實驗組動物體內,注射速度維持在2 μL/min,留針時長5 min,正常組和模型組注射等劑量的生理鹽水,注射完畢24 h 后,模型組、對照組、實驗組大鼠采用維生素D3 聯合高脂飲食法構建動脈粥樣硬化模型[8]。 具體操作如下:將維生素D3 以600000 U/kg 的劑量一次性腹腔注射進大鼠體內后每日以100 g 高脂飼料喂養,正常組大鼠始終以等量基礎飼料喂養。 飲水、光照、溫度恒定不變。
1.3.2 Vevo 2100 超聲儀對各組大鼠的動脈檢測
喂養60 d 后,頸動脈超聲檢查觀察各組大鼠頸動脈內膜是否光滑、有無增生或者斑塊、斑塊部位、大小和回聲點。 沿血管長軸測量管腔動脈后壁內膜-中層厚度(intima-media thickness of the posterior wall of the artery,IMT);將探頭在中點采樣,維持血流和聲速小于60 度,測量大鼠血流動力學參數指標斑塊面積(square,S)等。
1.3.3 HE 染色、油紅O 染色檢測各組大鼠AS 病理改變
超聲檢查完畢后,大鼠禁食12 h,麻醉處理并在顯微鏡下無菌剝離各組大鼠的全主動脈,剔除外膜的脂肪組織,80%的組織標本進行液氮封存,20%的組織標本,56℃水浴1 h,生理鹽水沖洗10 min,10%甲醛溶液固定1 h,石蠟包埋10 min,切片,蒸餾水清洗3 次,依次進行HE、油紅O 染色光鏡下觀察AS病變程度。
1.3.4 TUNEL 染色檢測各組大鼠中動脈組織的細胞凋亡
取出10%各組組織標本,10%甲醛固定,二甲苯浸洗兩次,梯度乙醇浸洗5 min,風干后3%雙氧水-甲醇浸泡10 min,PBS 漂洗3 次,每次3 min,然后4℃預冷乙醇上進行如下操作:0.1% TritonX-100、0.1%緩沖液處理2 min,PBS 漂洗3 次,每次3 min,加入TUNNEL 反應混合液,加封口膜在暗濕盒中反應1 h,溫度37℃,PBS 漂洗,梯度乙醇脫水,二甲苯透明,中性樹脂封片,顯微鏡下觀察。
1.3.5 免疫組化檢測各組大鼠中動脈組織中IL-6、TNF-α 和 MMP-9 的表達
取出10%各組組織標本,常規方法固定,包埋,切片,脫蠟,修復,雙氧水封閉,加入一抗,維持4℃孵育過夜,次日加入二抗,室溫孵育30 min,清洗。加適量顯色劑,蘇木素復染,PBS 清洗,脫水,中性樹膠封片,顯微鏡下觀察并記錄實驗結果;染色評判標準以腫瘤細胞細胞膜和細胞質內出現黃色或棕黃色顆粒為陽性。
1.3.6 qRT-PCR 檢測 miR-181b 和 Mex3B 蛋白的mRNA 的表達
取出10%各組組織標本,提取標本中細胞的總RNA,法測定RNA 濃度和檢測RNA 完整性后[9],上RT-PCR 儀檢測。 用 2-△△CT表示目的基因相對表達量;每個樣本獨立重復測量3 次,引物序列詳見表1。
1.3.7 熒光素酶報告基因分析
取出10%各組組織標本,采用TRIzol 提取總RNA 并逆轉錄合成 cDNA,PCR 擴增 Mex3B 的 3’-非翻譯區,并構建pGL3(pGL3-Mex3B-WT)載體,利用TaKaRa 技術在 pGL3(pGL3-Mex3B-WT)上 miR-181b 結合位點上構建(pGL3-Mex3B-MUT)載體,利用轉染試劑Lipofectamine 2000 將報告載體、mimic control、miR-181b mimic 轉染至人主動脈內皮細胞(human aortic endothelial cells, HAEC)中,轉染成功48 h 后,用雙重熒光素酶報告分析系統(dualluciferase reporter assay system)檢測不同重組質粒的熒光活性從而評估啟動子活性檢測相對熒光素酶活性,報告基因活性為螢火蟲熒光素酶/海腎熒光素酶活性值。
1.3.8 Western blot 檢測各組標本中 Mex3B、IL-6、TNF-α 和 MMP-9 蛋白的表達
取出10%各組組織標本,采用常規方法提取目標蛋白 Mex3B、IL-6、TNF-α 和 MMP-9,經 BCA 試劑盒測定蛋白濃度后,準確量取50 μg,電泳結束后,將樣品蛋白經濕轉法轉至PVDF 轉膜上,加入10%脫脂奶粉封閉3 h,以(1 ∶1500)比例稀釋后,維持4℃孵育過夜,洗滌加入二抗孵育3 h, 增強化學發光ELC 顯色 30 min,經曝光、顯影、定影后,以GAPDH 為內參來表示蛋白的表達水平。
1.4 統計學方法
本實驗采用SPSS 16.0 軟件進行數據統計分析,采用Graphpad 5.0 軟件作圖,兩組間比較采用t檢驗,多組間比較采用方差分析,P<0.05 表示具有統計學意義。
2 結果
2.1 各組大鼠的頸動脈超聲檢測結果
各組大鼠頸動脈超聲結果如圖1 所示,與正常組相比,模型組大鼠頸動脈內膜增生明顯,頸動脈IMT 明顯增大,斑塊S 明顯增大;與模型組相比,實驗組大鼠頸動脈內膜增生明顯減小,頸動脈IMT 明顯減小,斑塊S 明顯減小,差異均具有統計意義(P<0.05);模型組和對照組相比,差異無統計學意義(P>0.05)。
2.2 各組大鼠動脈病理改變檢測結果
HE 染色結果如圖2 所示,正常組動脈結構完整,胞核性狀規則,內膜、中膜以及外膜界限清晰;模型組動脈管壁明顯增厚,僵硬度增加,管腔內可見粥樣或者纖維斑塊,內膜可見白色條紋或者黃白色斑塊;對照組動脈內膜細胞增厚明顯,泡沫狀的細胞大量填充;實驗組動脈壁彈性明顯恢復,內膜細胞性狀較模型組明顯好轉,泡沫細胞的數量明顯減少,管腔內脂斑沉積明顯減少。
油紅O 染色結果如圖3 所示,正常組主動脈結構完整,未見斑塊形成;模型組血管壁質地脆,彈性較差,主動脈內膜中可見大量破損的泡沫細胞,在動脈壁的中膜、內膜均產生明顯的大小不等的AS斑塊,管腔明顯變窄小;對照組斑塊脂質沉積明顯,斑片狀或點狀的斑塊向管腔凸起。 實驗組的動脈壁斑塊分布范圍明顯減小,內膜基本沒有泡沫細胞,血管的彈性有所改善。
2.3 免疫組化檢測各組大鼠AS 中斑塊的穩定
MMP-9 是AS 的形成和維系斑塊穩定性中起關鍵性調節作用的酶。 本研究中采用免疫組化和Western blot 法檢測各組大鼠動脈中MMP-9 的表達情況,結果如圖4 所示,與正常組相比,模型組大鼠MMP-9 的表達明顯升高(P<0.05);與模型組相比,實驗組大鼠動脈中MMP-9 的表達明顯下降,差異均具有統計意義(P<0.05);模型組和對照組相比,差異無統計學意義(P>0.05)。 推斷抑制miR-181b 的表達,能抑制 MMP-9 的表達,減小 AS 中斑塊的形成。
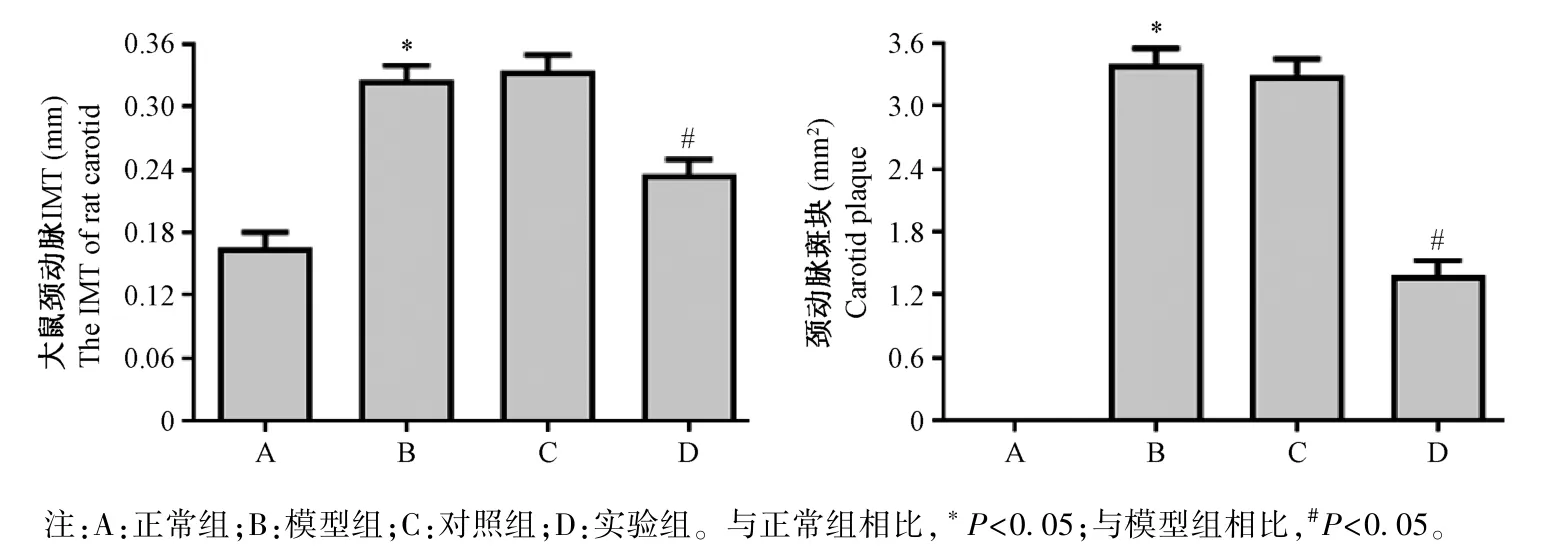
圖1 各組大鼠頸動脈超聲結果(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 1 Carotid ultrasound results of rats in each group
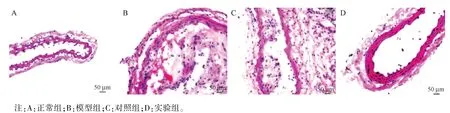
圖2 HE 染色檢測AS 病理改變(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Figure 2 HE staining to detect AS pathological changes
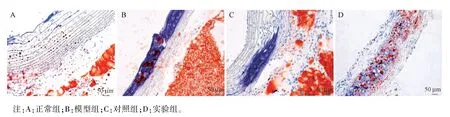
圖3 油紅O 染色檢測各組大鼠動脈壁上的脂質沉積(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Figure 3 Oil red O staining to detect lipid deposition on the arterial wall of each group of rats
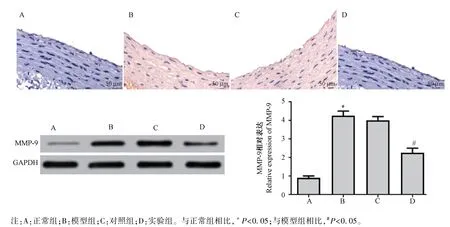
圖4 免疫組化和Western blot 法檢測各組大鼠動脈中MMP-9 的表達(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P <0.05.Compared with model group, #P<0.05.Figure 4 Detection the expression of MMP-9 in the arteries of rats in each group by immunohistochemistry and Western blot
2.4 TUNEL 染色檢測各組大鼠動脈細胞的凋亡
TUNEL 染色結果如圖5 所示,與正常組相比,模型組大鼠動脈上的細胞凋亡率明顯上升(P<0.05);與模型組相比,實驗組大鼠動脈上的細胞凋亡率明顯下降,差異均具有統計意義(P<0.05);模型組和對照組相比,差異無統計學意義(P>0.05)。
2.5 各組大鼠動脈中 IL-6 和 TNF-α 的表達
IL-6 和TNF-α 作為在AS 中炎癥反應的代表因子,本研究中采用免疫組化和Wetern blot 法檢測各組大鼠動脈中IL-6 和TNF-α 的表達情況,結果如圖6、圖7 所示,與正常組相比,模型組大鼠 IL-6 和TNF-α 的表達明顯升高,與模型組相比,實驗組大鼠動脈中IL-6 和TNF-α 的表達明顯下降,差異均具有統計意義(P<0.05),模型組和對照組相比,無明顯差異,不具有統計學意義(P>0.05)。
2.6 Western blot 檢測各組大鼠動脈中Mex3B 蛋白的表達
Western blot 法檢測各組大鼠動脈中蛋白Mex3B 的表達水平如圖8 所示:與正常組相比,模型組動脈中蛋白Mex3B 的表達明顯升高(P<0.05),與模型組相比,實驗組大鼠動脈中蛋白中Mex3B 的表達明顯下降(P<0.05)。 模型組和對照組相比,無明顯差異,不具有統計學意義(P>0.05)。
2.7 qRT-PCR 檢測各組大鼠動脈中miR-181b 和Mex3B 蛋白的 mRNA 的表達
本研究中采用RT-PCR 檢測各組大鼠動脈中miR-181b 和 Mex3B 的 mRNA 表達水平,如圖 9 所示:與正常組比較,模型組 miR-181b 和 Mex3B 的mRNA 表達水平明顯升高(P<0.05);轉染 miR-181b-inhibitor 后,與模型組和對照組相比,實驗組miR-181b 和Mex3B 的mRNA 表達水平明顯降低(P<0.05);模型組和對照組相比,無明顯差異,不具有統計學意義(P>0.05)。
2.8 熒光素酶報告基因分析結果
miR-181b 和Mex3B 蛋白的表達和mRNA 的變化趨勢一致,通過生物信息網站(www.microrna.org)上查詢miR-181b 和Mex3B 存在結合位點(如圖10示)。 采用雙熒光素酶報告基因分析來觀察兩者的關系結果如圖 11 示,轉染 miR-181b 后,野生型Mex3B 的熒光素酶活性被抑制(P<0.05),突變型Mex3B 的熒光素酶活性無明顯變化(P>0.05),說明miR-181b 與Mex3B 具有靶向調控關系。
3 討論
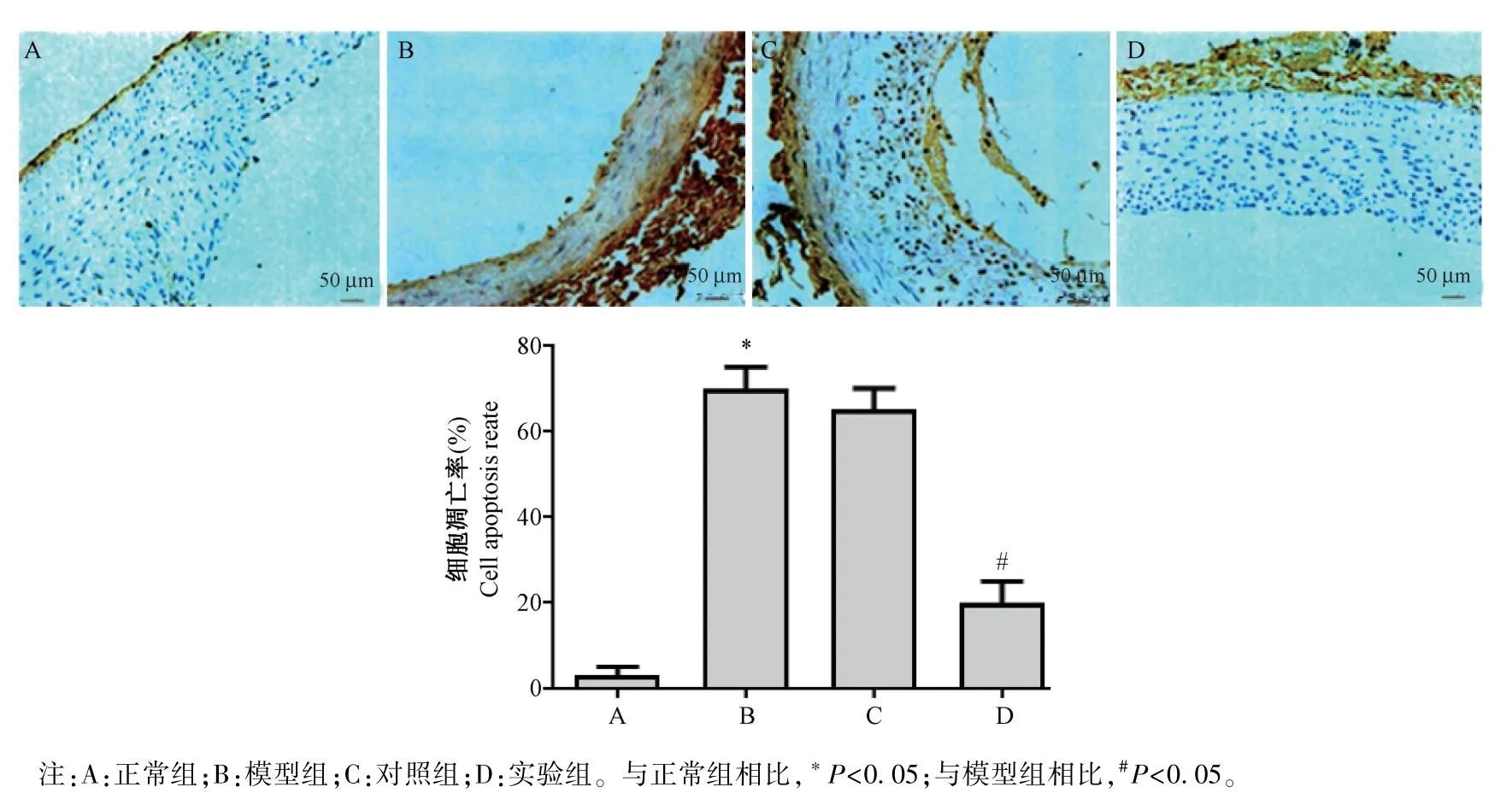
圖5 TUNEL 染色檢測各組細胞的凋亡(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 5 TUNEL staining to detect cell apoptosis in each group
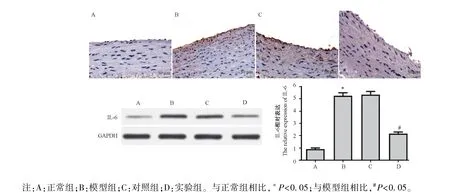
圖6 免疫組化和Western blot 法檢測各組大鼠動脈中IL-6 的表達(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 6 Detection the expression of IL-6 in the arteries of rats in each group by immunohistochemistry and Western blot
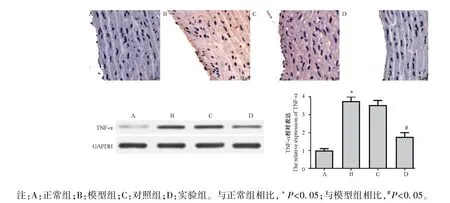
圖7 免疫組化和Western blot 法檢測各組大鼠動脈中TNF-α 的表達(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 7 Detection the expression of TNF-α in the arteries of rats in each group by immunohistochemistry and Western blot
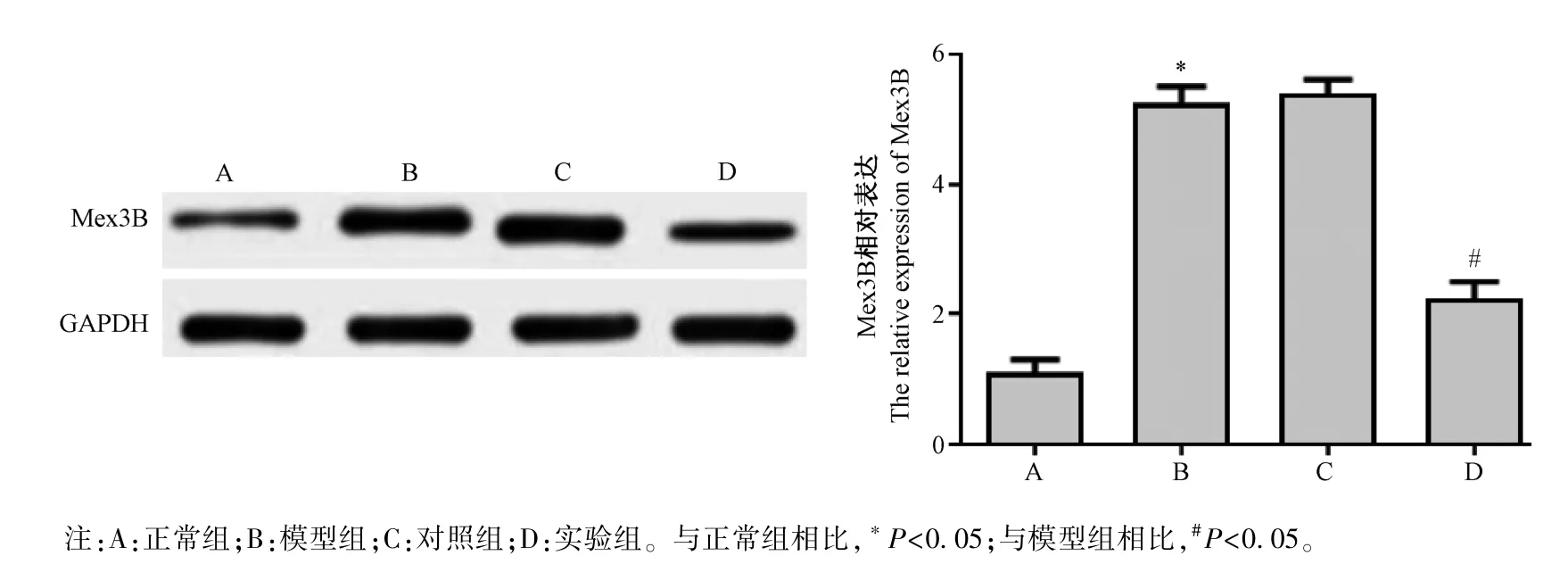
圖8 各組大鼠動脈中Mex3B 蛋白的表達(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 8 Protein expression of Mex3B in the arteries of each group of rats
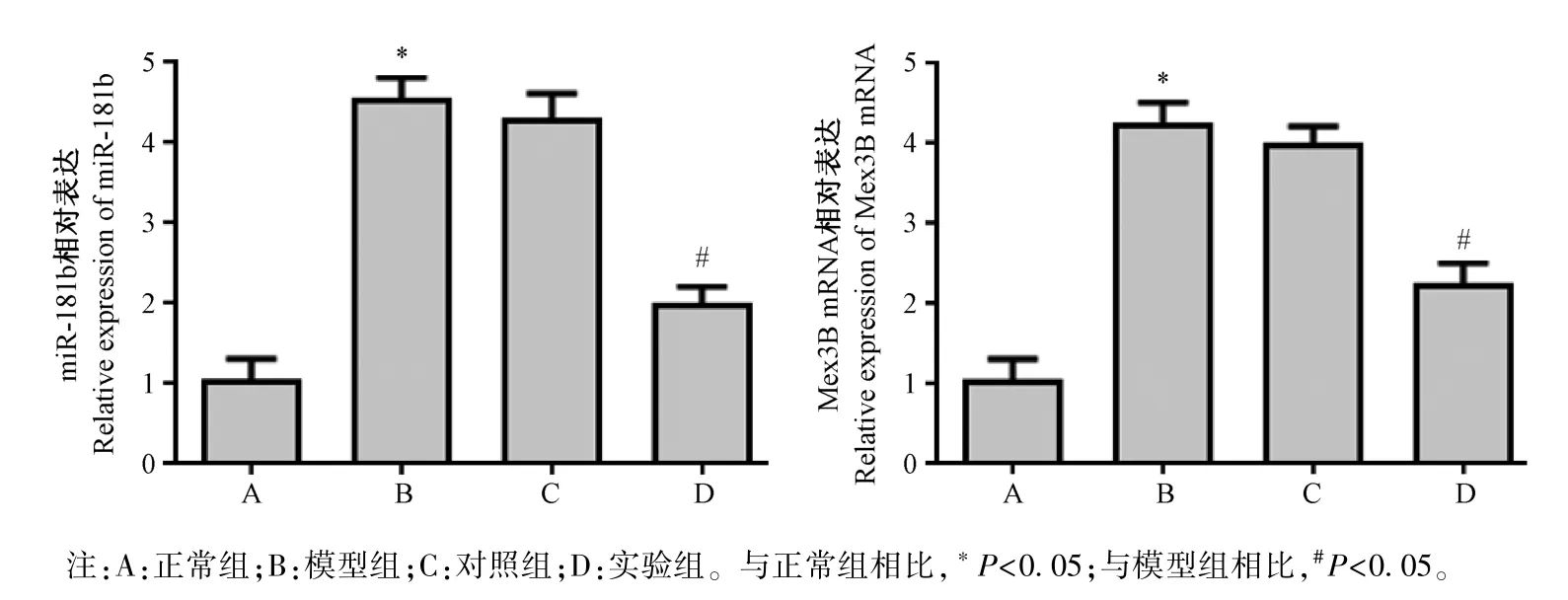
圖9 各組大鼠動脈中miR-181b 和Mex3B 的mRNA 表達水平Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 9 mRNA expression levels of miR-181b and Mex3B in the arteries of rats in each group
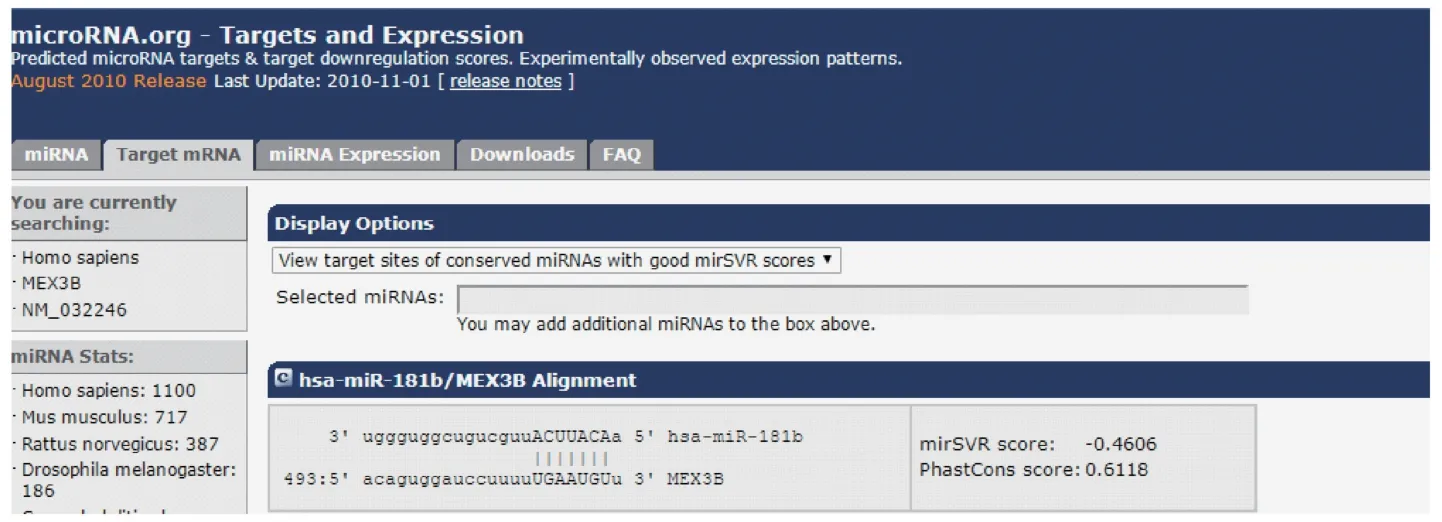
圖10 生物信息網站預測miR-181b 和Mex3B 的關系Figure 10 Relationship between miR-181b and Mex3B predicted by bioinformatics websites
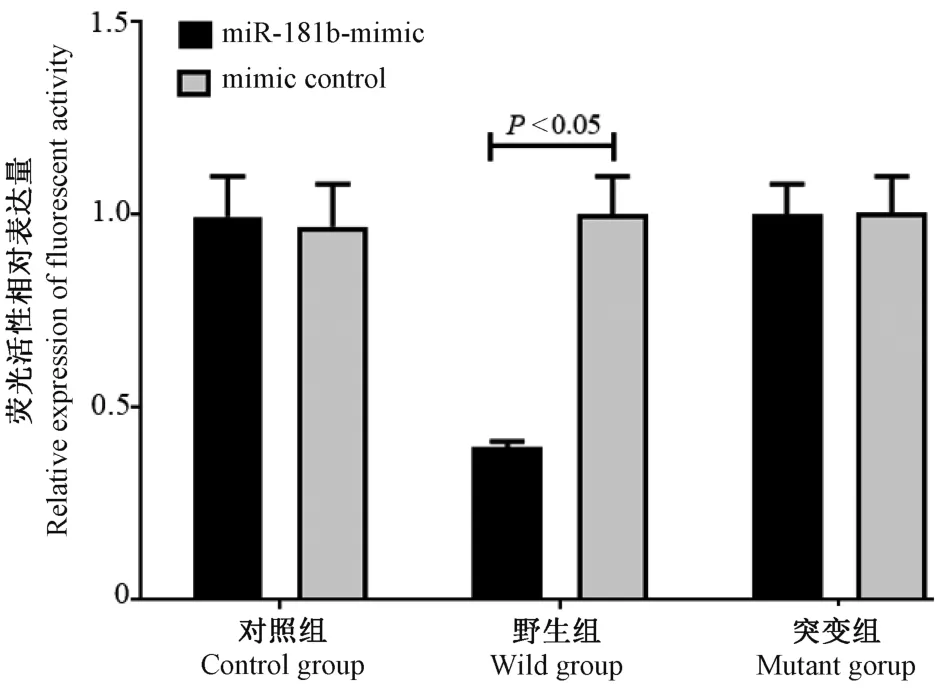
圖11 雙熒光素酶報告基因檢測結果Figure 11 Detection results of the double luciferase reporter gene
AS 能通過引起動脈血管管腔狹窄、循環血流量減少等進而導致機體器官因供血不足而出現各種功能障礙。 因AS 而造成的易損斑塊、血栓脫落當發生腦部位時極易誘發短暫性缺血性腦卒中危及患者生命[10]。 目前臨床上主要通過改善患者的生活方式、調節患者血脂、血糖和血壓緩解病程進展,但尚無根治性手段。 因此開展針對AS 的靶向治療的研究在臨床上具有重大研究意義。
目前,針對AS 的靶向治療尚處于實驗室研究階段。 研究證實[11]miRNA 不僅在AS 中細胞增殖與凋亡、自噬與分化中扮演重要角色,miRNA 作為調控因子影響AS 的各個階段,諸如動脈內皮細胞損傷與功能障礙、泡沫細胞形成與表型轉換、脂質沉積和斑塊形成等[12]。 Ma 等[13]研究證實miRNA-155 參與ApoE-/-小鼠頸動脈粥樣硬化中的細胞自噬。 miR-181b 是miR-181 家族中與心血管疾病關系密切的成員。 研究表明[14]miR-181b 主要通過對血管炎癥以及免疫反應的調控來參與AS 進程。 Di等[15]研究表明miR-181b 能調控基質金屬蛋白酶組織抑制劑-3(tissue inhibitor of metalloproteinase-3,TIMP-3)的表達,影響AS 中微血管壁的穩定。 Sun等[16]研究報道miR-181b 參與調控ApoE-/-小鼠AS中由炎性誘導的細胞凋亡。 黃志勇等[17]研究證實抑制miR-181b 的表達能明顯減輕ox-LDL 誘導的人臍靜脈細胞炎癥損傷。 本研究中轉染miR-181binhibitor 后采用維生素D3 聯合高脂飲食法構建動脈粥樣硬化大鼠模型,結果表明抑制miR-181b 的表達能明顯改善大鼠AS 病理癥狀,改善大鼠動脈的脂質沉積情況,降低動脈中MMP-9 的表達,縮小動脈中斑塊的面積。
研究表明[18]動脈血管壁進展性、慢性的炎癥反應是導致AS 累及全身動脈血管形成斑塊的重要原因。 Zampino 等[19]報道內毒素誘導的炎性反應更容易導致動脈血管發生AS 斑塊病變。 Yang 等[20]研究表明降低炎性因子的表達有助于改善AS 動物模型的癥狀。 Gong 等[21]研究證實抑制AS 中炎性的發展能明顯改善AS 的斑塊的病變面積,促進斑塊的消退。 紀利利等[22]臨床研究結果表明抑制炎性反應能明顯降低頸動脈粥樣硬化患者發生腦梗死的風險。 而MEX3B基因是四種人類同源MEX3 基因的一種。 最新研究表明[23]Mex3B 蛋白是新近發現的細胞質小體的組成部分,與炎性因子的mRNA轉錄、降解等生理過程密切相關。 He 等[24]研究表明在食管癌中,miR-181b 能夠與Mex3B 特異性結影響癌細胞 DNA 的復制以及細胞增殖。 Moududee等[25]研究指出Mex3B 蛋白中環指結構域是泛素E3連接酶的特征結構域,Mex3B 蛋白能通過泛素化作用參與細胞的炎性應激。 Sun 等[26]研究指出miR-181b 影響泛素E3 連接酶的表達降低動脈粥樣硬化中血管內皮中炎性因子的表達。 本研究中RT-PCR和Western blot 結果表明在AS 模型組中 Mex3B 的mRNA 和蛋白的表達升高,炎性因子IL-6 和TNF-α大量表達,AS 損傷明顯。 通過生物信息網站預測miR-181b 和Mex3B 存在靶向結合位點,熒光素酶報告基因分析證實 miR-181b 靶向調控 Mex3B 的表達,Western blot 法結果表明抑制miR-181b 的表達后,Mex3B 的表達明顯下降,炎性因子表達下調。推斷說明miR-181b 通過靶向調控Mex3B 的表達參與AS 中炎性應激,來抑制由炎性導致的AS 斑塊病變。
綜合上述,miR-181b 通過靶向調控Mex3B 的表達參與動脈粥樣硬化中的炎性應激,抑制miR-181b的表達能明顯抑制炎癥反應,減小動脈粥樣硬化中斑塊的形成。 但如何將miR-181b 的靶向作用應用到臨床對動脈粥樣硬化的治療中還需進一步的研究。

