LAMP法與PCR法在食品動物源性成分檢測中的應用
徐帥 郝琴 代艷發(fā) 陳宏波

摘 要:目的:探討和對比食品動物源性成分檢測中環(huán)介導等溫擴增法(LAMP)與實時熒光定量法(PCR)的應用價值。方法:于湖南省汨羅市各大超市抽取樣品并將其作為試驗材料,共抽檢13份。抽檢樣品分別采用LAMP法與PCR法進行檢測,觀察并對比兩種檢測方法各樣品提取DNA濃度的測定結果。結果:3種已知動物源性成分樣品經(jīng)LAMP檢測顯示陽性,且PCR檢測也為陽性;LAMP法檢測時13份樣品中與標簽明示肉源不符的樣品共3份,而PCR法檢測時有4份。兩種檢測方法檢測結果顯示1份樣品檢測結果不同。結論:LAMP法與PCR法在食品動物源性成分檢測中均表現(xiàn)出顯著的應用價值,準確性高,并且具備較好特異性,但本研究中LAMP總用時80 min,較PCR總用時140 min少,更方便進行現(xiàn)場快速抽檢。
關鍵詞:環(huán)介導等溫擴增法;實時熒光定量法;食品;動物源性;成分檢測
目前市場上檢測食品動物源性成分的常見方法以環(huán)介導等溫擴增法(LAMP)、實時熒光定量法(PCR)為主[1] 。本研究于湖南省汨羅市各大超市抽取13份標簽明示含有雞、豬、牛成分的樣品進行分析,探討和對比LAMP法與PCR法在食品動物源性成分檢測中的應用價值。
1 材料與方法
1.1 材料
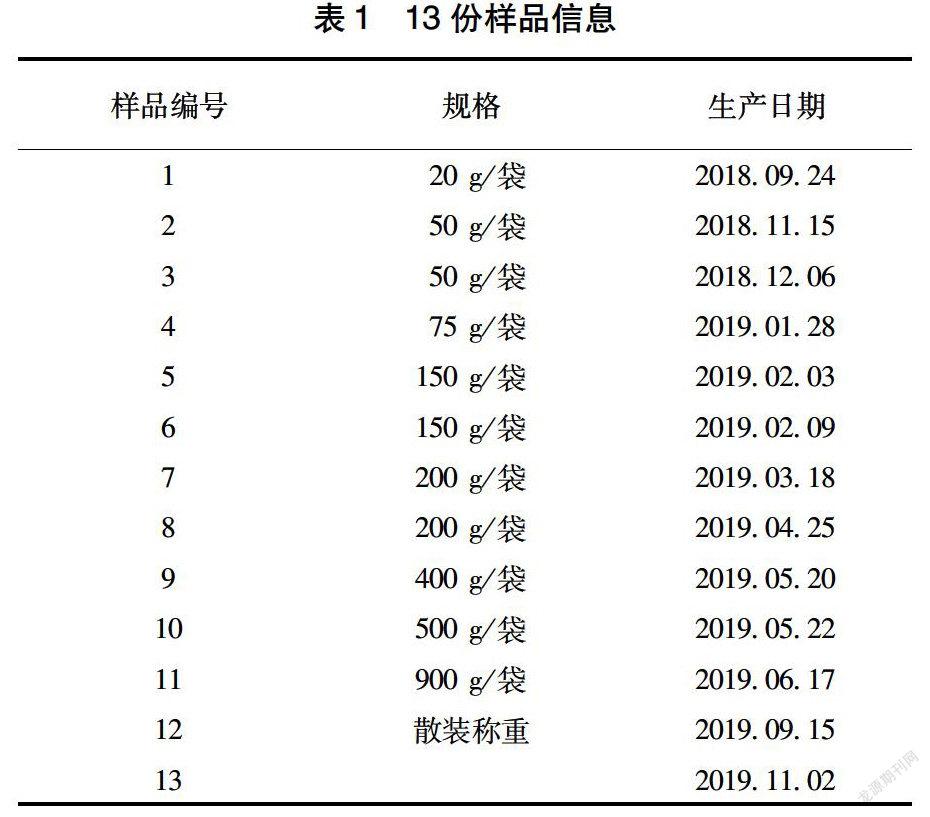
于湖南省汨羅市各大超市抽取樣品并將其作為試驗材料,共抽檢13份,其中,混合肉制品共5份,標簽明示僅含豬成分的5份,標簽明示僅含牛成分的3份(表1)。
1.2 方法
1.2.1 試劑與儀器 (1)廣譜型基因組DNA小量純化試劑盒,Primerdesign生物公司;雞源性、豬源性、牛源性成分實時熒光PCR檢測試劑盒,Primerdesign生物公司。(2)動物組織基因組DNA快速提取試劑盒,賽默飛世爾科技(中國)有限公司;雞源性、豬源性、牛源性檢測試劑盒(恒溫熒光法),賽默飛世爾科技(中國)有限公司。(3)1379型生物安全柜,賽默飛世爾科技(中國)有限公司;5417R型高速冷凍離心機,德國Eppendorf公司;MS3基本型圓周振蕩器,萊貝(上海)科學儀器有限公司;實時熒光定量PCR擴增儀,美國ABI StepOne;308C型恒溫熒光檢測儀,廣州迪澳生物科技有限公司;微量紫外分光光度計,德國Becman公司。
1.2.2 LAMP檢測方法 (1)DNA提取方法:首先取0.5 g樣品并加入磁珠以及1 mL的Buffer A試劑(深圳欣博盛生物科技有限公司)進行破碎處理,65 ℃下熱浴30 min,以5 000 r/min的速度進行離心處理約5 min,取10 μL上清液加至新離心管中并加入1 mL的Buffer B試劑(上海玉博生物科技有限公司)混勻后得到DNA溶液[2] 。(2)鑒定雞源性成分:依據(jù)說明書要求進行,其中,擴增條件:63 ℃ 45 min;擴增體系25 μL:1 μL Bst聚合酶,2 μL模板DNA,20 μL密封液,22 μL反應液[3] 。(3)鑒定豬源性成分:依據(jù)說明書要求進行,其中,擴增條件:63 ℃ 45 min;擴增體系25 μL:1 μL Bst聚合酶,2 μL模板DNA,20 μL密封液,22 μL反應液。(4)鑒定牛源性成分:依據(jù)說明書要求進行,其中,擴增條件:63 ℃ 45 min;擴增體系25 μL:1 μL Bst聚合酶,2 μL模板DNA,20 μL密封液,22 μL反應液。
1.2.3 PCR檢測方法 (1)DNA提取及濃度測定:依據(jù)廣譜型基因組DNA小量純化試劑盒說明書中的步驟和要求提取,測定DNA濃度,記錄測定結果[4] 。(2)鑒定雞源性成分:依據(jù)試劑盒說明書中的步驟和要求進行,其中,擴增體系25 μL:12.5 μL Premix,1 μL Primer Mix,1 μL Probe Mix,l μL模板DNA(10 ng/μL),補足25 μL ddH2O;擴增條件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 30 s,擴增40個循環(huán)并于退火時收集熒光[5] 。(3)鑒定豬源性成分:依據(jù)試劑盒說明書中的步驟和要求進行,其中,擴增體系25 μL:12.5 μL Premix,1 μL Primer Mix,1 μL Probe Mix,l μL模板DNA(10 ng/μL),補足25 μL ddH2O;擴增條件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 30 s,擴增40個循環(huán)并于退火時收集熒光。(4)鑒定牛源性成分:依據(jù)試劑盒說明書中的步驟和要求進行,其中,擴增體系25 μL:12.5 μL Premix,1 μL Primer Mix,1 μL Probe Mix,l μL模板DNA(10 ng/μL),補足25 μL ddH2O;擴增條件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 30 s,擴增40個循環(huán)并于退火時收集熒光。
1.3 觀察指標
(1)分析兩種檢測方法檢測結果,在兩種檢測方法中,均將滅菌水作為空白對照,并且陰性對照為非目標肉中所提取的DNA,陽性對照為雞肉、豬肉、牛肉所提取的DNA[6] 。(2)觀察本研究所選13份樣品提取DNA濃度的測定結果,在檢測過程中取3 μL待測DNA溶液置于核酸蛋白測定儀,測定其濃度并進行對照,其中空白對照仍為滅菌水[7] 。(3)對比兩種檢測方法測定結果。
1.4 統(tǒng)計學方法
各項基線資料及研究數(shù)據(jù)均由SPSS 21.0軟件進行分析。樣本率、計量資料分別采用χ2、t檢驗,并分別采用百分率(%)、均數(shù)±標準(±s)表示,P<0.05表示差異有統(tǒng)計學意義。
2 結果與分析
2.1 LAMP檢測結果分析
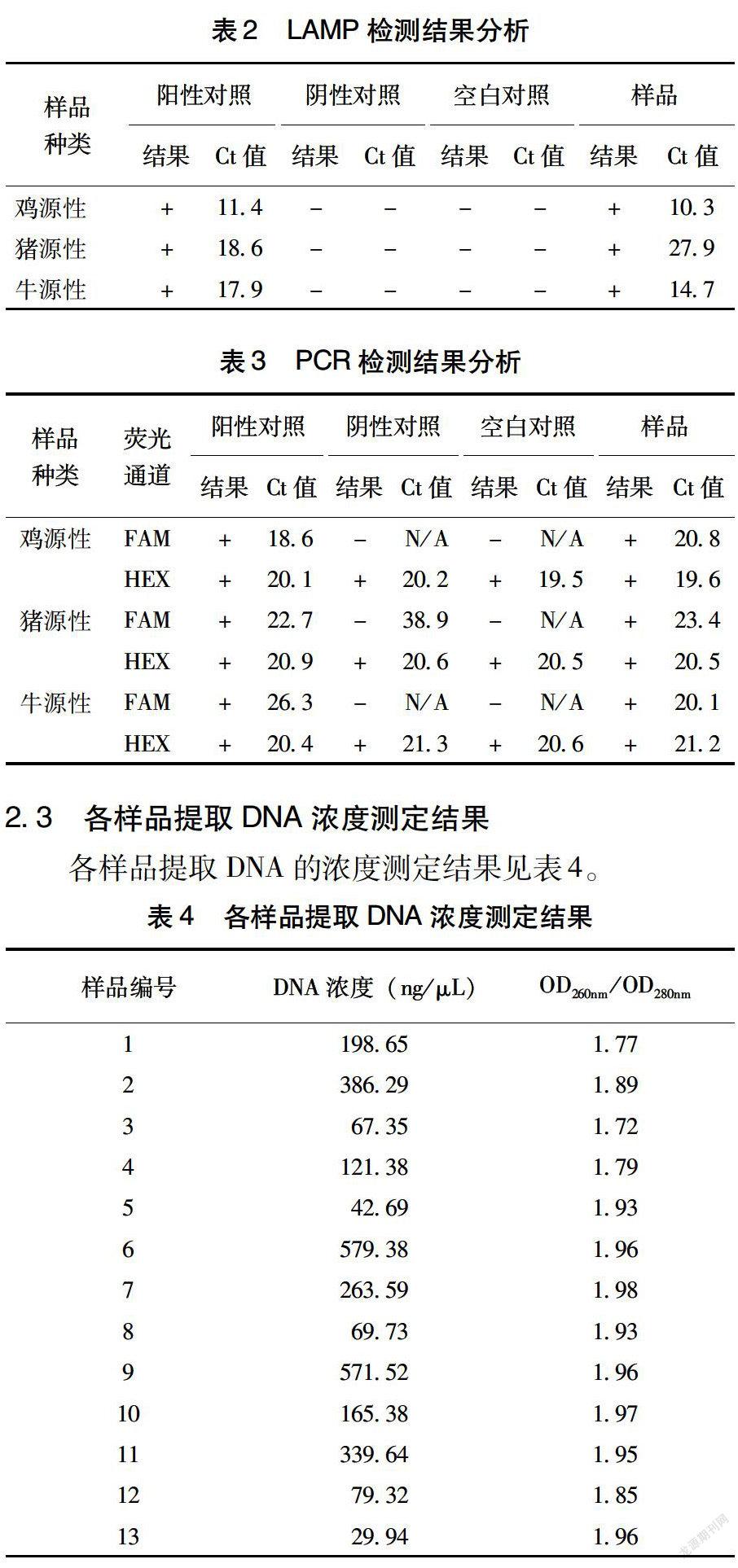
表2數(shù)據(jù)顯示,3種已知動物源性成分樣品檢測結果均為陽性。
2.2 PCR檢測結果分析
表3數(shù)據(jù)顯示,3種已知動物源性成分樣品檢測結果均為陽性。
2.3 各樣品提取DNA濃度測定結果
各樣品提取DNA的濃度測定結果見表4。
2.4 LAMP法與PCR法測定結果對比
表5數(shù)據(jù)顯示,13份檢測樣品中,LAMP法檢測時13份樣品中與標簽明示肉源不符的樣品共3份,而PCR法檢測時有4份,有1份樣品檢測結果不同。
3 討論
劉娜等[8]研究中曾提出,食品藥品檢驗所等監(jiān)管部門工作的落實是有效打擊肉制品不法摻雜、摻假行為的基礎,并認為食品動物源性成分檢測具有準確的指導和判斷價值。近年來,我國生物技術及現(xiàn)代儀器分析技術不斷發(fā)展,在很大程度上指導了食品動物源性成分檢測的方向。目前,食品動物源性成分檢測主要是采用基于核酸的分子生物學技術進行檢測,取得了較為理想的效果[9] 。LAMP與PCR技術近年來應用廣泛,劉艷艷等[10]在研究中建立了驢、馬、驢騾和馬騾皮張四重熒光PCR檢測體系,為羊肉及牛肉的源性成分檢測提供了參考。PCR技術被廣泛應用于動物源性成分檢測中[11] 。但PCR技術對DNA模板的質(zhì)量要求較高,并且檢測時間長、需要昂貴的儀器設備,因此使用存在一定局限性。
LAMP是一門新興的基因擴增技術,余艷玲等[12]研究中曾采用LAMP技術對羅非魚無乳鏈球菌(GBS)進行快速檢測,結果表明,LAMP技術具有較高的靈敏度、特異性、穩(wěn)定性,應用效果較為理想。此外,時建立等[13]也建立了豬源性成分LAMP檢測方法,發(fā)現(xiàn)LAMP技術靈敏度較PCR方法來說高出接近2~5個數(shù)量級,雖然該技術較qPCR方法來說低10倍,達到5.928×10-3 μg/μL,但其反應時間短,最快10 min即可完成反應,成本低,不需專門的儀器,因此更適合食品安全監(jiān)管部門進行現(xiàn)場快速監(jiān)督抽檢。需要注意的是,LAMP技術雖然操作簡單且準確性高,但由于該技術采用粗提方式提取DNA,而且易受樣品基質(zhì)及加工工藝對所提取的核酸質(zhì)量的影響,因此針對部分步驟還需進一步完善,最大程度降低檢測誤差[14] 。本研究兩種檢測方法檢測結果顯示1份樣品檢測結果不同。這一研究與唐善虎等[15]為研究快速鑒別熟制牦牛肉餅中豬肉和雞肉的成分所建立的LAMP檢測體系基本一致。
綜上所述,LAMP法與PCR法均可在食品動物源性成分檢測中使用,但考慮到市場抽檢的特殊性,一般選擇耗時短且操作更簡單的PCR法進行檢測,實用價值更高。◇
參考文獻
[1]麗牧.實時熒光定量PCR法檢測新城疫病毒的方法建立[J].食品安全導刊,2017(3):136-138.
[2]劉娜,楊滴,韓東.食品中鵝源性成分實時熒光PCR檢測方法的建立[J].肉類工業(yè),2016(10):37-39.
[3]Mohon A N,Lee D Y,Bayih A G,et al.NINA-LAMP compared to microscopy,RDT,and nested PCR for the detection of imported malaria[J].Diagnostic Microbiology & Infectious Disease,2016,85(2):149-153.
[4]齊春萌,楊昕霆,薛晨玉.實時熒光PCR法檢測食品中梅花鹿成分[J].食品與生物技術學報,2016,35(10):1088-1092.
[5]黃夢詩,等.海水中副溶血弧菌的可視化LAMP快速檢測方法[J].中國漁業(yè)質(zhì)量與標準,2017,7(6):58-65.
[6]馬芳,張慶利,萬曉媛.基于LAMP技術的對蝦白斑綜合征病毒現(xiàn)場快速高靈敏度檢測試劑盒的評價[J].中國預防獸醫(yī)學報,2016,38(4):316-321.
[7]霍勝楠,等.3種食源性致病菌的實時熒光PCR快速檢測[J].食品研究與開發(fā),2016,37(16):143-147.
[8]劉娜,趙新,陳銳.動物肌肉組織DNA的提取方法及實時熒光定量PCR檢測[J].食品工業(yè)科技,2016,37(18):74-80.
[9]楊艷,等.PCR技術在肉類成分定量分析中的應用研究進展[J].食品工業(yè)科技,2016,37(17):360-365.
[10]劉艷艷,張全芳,卞如如.利用多重熒光定量PCR檢測阿膠原料驢、馬、驢騾和馬騾皮張的源性[J].藥學研究,2016,35(10):569-574.
[11]錢云開,等.實時熒光PCR法快速檢測肉類中貉源性成分[J].中國食品衛(wèi)生雜志,2016,28(5):602-605.
[12]余艷玲,彭昊,馮世文.羅非魚無乳鏈球菌環(huán)介導等溫擴增(LAMP)檢測技術的建立及應用[J].江蘇農(nóng)業(yè)科學,2019,47(13):200-203.
[13]時建立,等.豬流行性腹瀉病毒LAMP檢測方法的建立及初步應用[J].中國動物檢疫,2016,33(7):82-85.
[14]夏雪娟,鄭炯,葉秀娟.實時熒光定量PCR技術監(jiān)測腌制麻竹筍中乳酸乳球菌動態(tài)變化[J].食品科學,2016,37(4):88-92.
[15]唐善虎,李雪,王柳.用LAMP法快速鑒別熟制牦牛肉餅中的豬肉和雞肉成分[J].西南民族大學學報(自然科學版),2018,44(3):237-242.
Abstract:Objective ? To explore and compare the application and value of Loop Mediated Isothermal Amplification(LAMP)and Real-time Fluorescence Quantification(PCR)in the detection of food animal derived ingredients.Method ? A total of 13 samples were collected from supermarkets in Miluo city in Hunan province.Sampling samples were detected by LAMP method and PCR method respectively.The detection results of DNA concentration extracted from each sample were observed and compared.Result ? The samples of three known animal origin components were positive by LAMP test,and PCR test was also positive.Among 13 LAMP test,there were 3 samples inconsistent with the meat source indicated by the label,while 4 samples were detected by PCR.The results of the two methods showed that the results of one sample were different.Conclusion ? Both LAMP method and PCR method have significant application value,high accuracy and good specificity in the detection of food animal derived ingredients,but the total time of LAMP is 80 min less than that of PCR 140 min,which is more convenient for spot rapid sampling.
Keywords:Loop Mediated Isothermal Amplification(LAMP);Real-time Fluorescence Quantitative Method(PCR);food;animal origin;component detection

