補充ω-3脂肪酸改善代謝綜合征患者脂代謝的研究
張永 張靜 于志盟 陶揚 劉鹿 劉英華


摘 要:目的:觀察補充ω-3脂肪酸膳食補充劑對代謝綜合征患者脂代謝的影響并初步探討其機制。方法:采用隨機雙盲臨床對照研究方法,按入選標準納入60名代謝綜合征患者,隨機分為2組,分別服用安慰劑和ω-3脂肪酸補充劑,ω-3脂肪酸組劑量為每人每日1 000 mg[二十碳五烯酸(EPA)+二十二碳六烯酸(DHA)],干預時間12周。在實驗開始前和實驗結束時,測量血壓及體成分,檢測血脂、血清炎性因子(包括腫瘤壞死因子、白介素-2、白介素-6、白介素-8)、血清多不飽和脂肪酸等。結果:干預12周后,ω-3脂肪酸補充劑組的甘油三酯水平及載脂蛋白B的水平顯著下降,炎性因子白介素-6、白介素-8、腫瘤壞死因子α顯著降低,血清EPA、DPA、DHA顯著升高,ω-6/ω-3 PUFA比值顯著下降,且與安慰劑對照組相比差異均有統計學意義(P<0.05)。結論:補充ω-3脂肪酸可能通過下調ω-6/ω-3 PUFA比值抑制炎癥反應改善代謝綜合征患者的脂代謝水平。
關鍵詞:ω-3脂肪酸;脂代謝;代謝綜合征
代謝綜合征(metabolic syndrome,MS)是一組以肥胖、高血糖、血脂異常以及高血壓等聚集發病、嚴重影響機體健康的臨床癥候群,是一組在代謝上相互關聯的危險因素的組合[1] 。2010—2012年中國居民營養與健康狀況監測發現,我國MS的患病率逐年升高,發病年齡出現低齡化,MS的4項組分患病率比較顯示,以血脂異常率和超重/肥胖率最高,分別是33.7%、32.3%,高血壓率為22.4%,血糖升高率為16.2%,嚴重影響了人類健康。MS的發生受膳食營養、生活習慣、環境及遺傳等多方面因素共同作用,其中膳食營養是關系最為密切的。有研究發現,ω-3脂肪酸可能具有改善脂代謝的作用[2],但針對MS人群的干預研究不多。本研究通過隨機雙盲臨床對照干預研究,觀察補充ω-3脂肪酸膳食補充劑對代謝綜合征患者脂代謝紊亂及炎癥因子表達的影響,為尋找MS營養干預新途徑提供科學依據。
1 資料與方法
1.1 研究對象
選擇中國人民解放軍總醫院第一醫學中心門診確診的MS患者60例。實驗對象入選條件:年齡18~70歲,無嚴重肝、腎、胃病,自愿參加研究,且符合MS診斷標準[1]者。本研究經中國人民解放軍總醫院醫學倫理委員會批準(倫審第S2018-008-02號),所有志愿者均簽署知情同意書。
1.2 實驗分組與干預
采用隨機雙盲臨床對照研究方法,將入選的志愿者隨機分為2組,每組30人,分別服用安慰劑和ω-3脂肪酸補充劑。ω-3脂肪酸補充劑為含二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的軟膠囊(EPA+DHA總量250 mg/粒),安慰劑為橄欖油軟膠囊,兩種干預物外形一致,均由上海展望生物科技有限公司提供。ω-3脂肪酸軟膠囊及橄欖油軟膠囊服用方法:1次2粒,1日2次,每天早、晚餐后服用,連續服用12周。ω-3脂肪酸每日補充量為1 000 mg(EPA+DHA)。
1.3 觀察指標
研究開始前對所有研究對象均進行個人基本信息調查和膳食調查。研究期間每2周隨訪1次,記錄膳食日記。研究前及干預12周時分別對受試者進行血壓測定,人體成分分析及空腹血液標本采集。
(1)人體成分測定:采用北京四海華辰科技有限公司提供的BAS-H 進行測定,可測定人體身高、體重、肌肉重、脂肪重、內臟脂肪面積等。(2)血生化檢測:谷草轉氨酶(GOT)、谷丙轉氨酶(GPT)、肌酐(Cr)、尿素氮(BUN)、空腹血糖(FPG)、血清膽固醇(TC)、血清甘油三酯(TG)、載脂蛋白A1(ApoA1)、載脂蛋白B(ApoB)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、血尿酸(BUA)等,由解放軍總醫院第一醫學中心檢驗科檢測。(3)炎性因子:腫瘤壞死因子(TNF-α)、白介素-2(IL-2)、白介素-6(IL-6)、白介素-8(IL-8)的蛋白表達,由解放軍總醫院第一醫學中心檢驗科檢測。(4)血清ω-3及ω-6脂肪酸:ω-3系列脂肪酸,包括α-亞麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)、二十二碳六烯酸(DHA);ω-6系列脂肪酸,包括亞油酸、γ-亞麻酸、花生四烯酸(AA);采用AB SCIEX公司設備的液相色譜質譜聯用法(LC-MS/MS)檢測。
1.4 質量控制
研究開始前對研究對象進行健康教育及飲食指導,并根據每位入選研究對像的年齡、身高、體重情況確定每日各類食物的攝入量,要求每位入選的研究對象按推薦的每日各類食物的攝入量安排飲食,并每2周填寫3 d(含1個周六或周日)的膳食日記。血壓及體成分檢測由經培訓的固定人員測量。血液樣本均同批次送檢。
1.5 統計學處理
數據采用SPSS 17.0統計軟件進行處理及分析。數據用均數±標準差(±s)表示。兩組之間數據比較采用t檢驗。計數資料采用卡方檢驗。P<0.05為差異有統計學意義。
2 結果與分析
2.1 性別及年齡分布情況
共有2人退出研究,實際獲得有效數據58例,失訪率3.3%。ω-3脂肪酸組30例,平均年齡57±17歲,男性13例、女性17例;對照組28例,平均年齡59±9歲,男性13例、女性15例。兩組性別分布及平均年齡無統計學差異(P>0.05)。
2.2 膳食攝入情況
兩組之間的平均每日膳食攝入量、蛋白質、脂肪、碳水化合物及蛋白質產熱百分比、脂肪產熱百分比、碳水化合物產熱百分比無顯著性差異(P>0.05)(表1)。
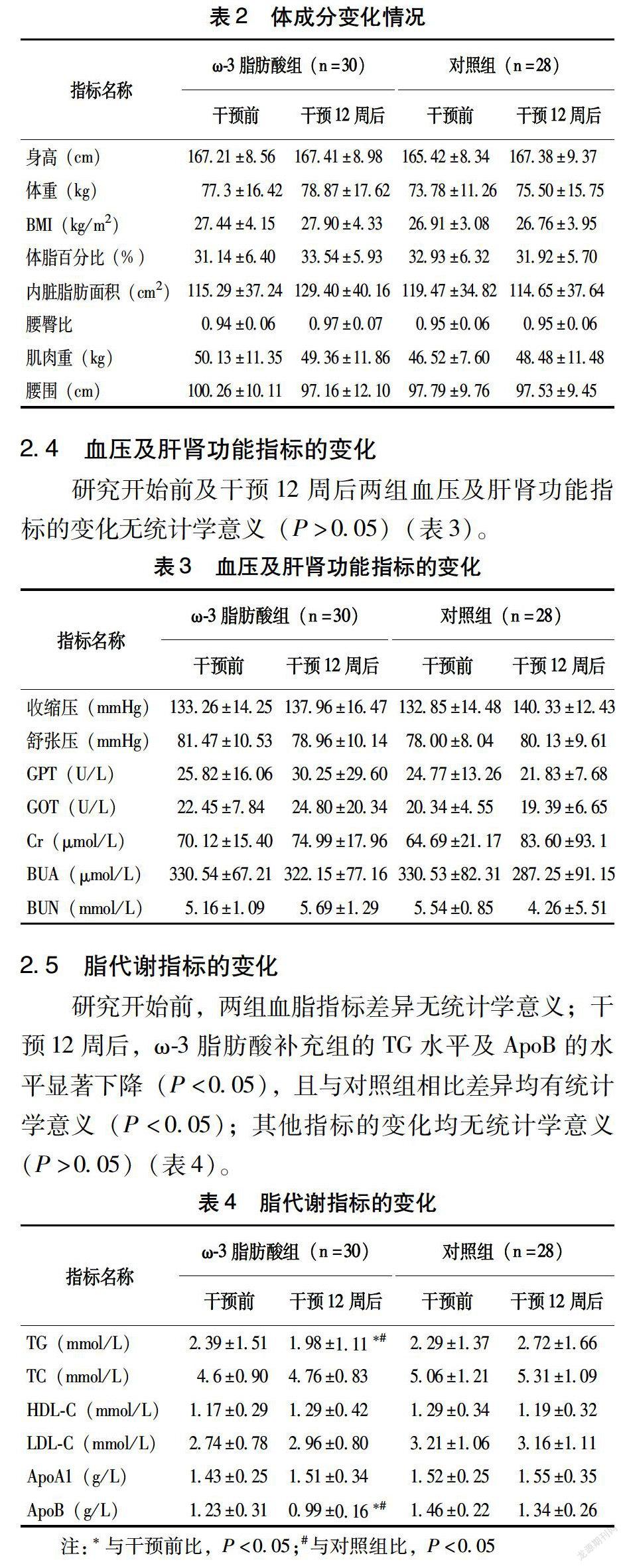
2.3 體成分的變化
研究開始前及干預12周后兩組體成分的變化無統計學意義(P>0.05)(表2)。
2.4 血壓及肝腎功能指標的變化
研究開始前及干預12周后兩組血壓及肝腎功能指標的變化無統計學意義(P>0.05)(表3)。
2.5 脂代謝指標的變化
研究開始前,兩組血脂指標差異無統計學意義;干預12周后,ω-3脂肪酸補充組的TG水平及ApoB的水平顯著下降(P<0.05),且與對照組相比差異均有統計學意義(P<0.05);其他指標的變化均無統計學意義(P>0.05)(表4)。
2.6 炎性因子的變化
研究開始前,兩組血清炎性因子水平差異無統計意義;干預12周后,ω-3脂肪酸補充組的炎性因子IL-6、IL-8、TNF-α顯著降低(P<0.05),且與對照組相比差異均有統計學意義(P<0.05);其他指標的變化均無統計學意義(P>0.05)(表5)。
2.7 ω-6和ω-3脂肪酸的變化
研究開始前,兩組血清ω-6和ω-3脂肪酸水平差異無統計意義;干預12周后,ω-3脂肪酸補充組的EPA、DPA、DHA、∑ω-3 PUFA顯著升高(P<0.05),且與對照組相比差異均有統計學意義(P<0.05);干預12周后,ω-3脂肪酸補充組的ω-6/ω-3 PUFA比值顯著下降(P<0.05),且與對照組相比差異均有統計學意義(P<0.05);其他指標的變化均無統計學意義(P>0.05)(表6)。
3 討論
MS是一組復雜的代謝紊亂癥候群,是心腦血管疾病發病的高危因素,其發生機制到目前為止仍不清楚。對MS發生機制的共同認識是以胰島素抵抗為核心、由慢性炎癥因子參與作用的結果。正常情況下,機體內環境處于穩態水平,炎癥和代謝各自及相互之間均保持一種動態平衡狀態。當機體發生代謝紊亂時,打破了機體這種平衡狀態,引起免疫系統的失衡,激發炎癥信號傳導通路,促使機體釋放一系列炎癥因子,某些炎癥因子甚至放大自身炎癥反應,形成炎癥瀑布效應,進一步使機體發生胰島素抵抗,從而導致代謝綜合征的發生[3-4] 。炎癥因子在MS發生發展中扮演的角色越來越成為人們關注和研究的熱點。其中,TNF-α是最早、最重要的炎性介質,目前許多研究證實其與胰島素抵抗有關,進而與MS發生發展密切相關[3] 。此外,C反應蛋白、白細胞介素、脂肪因子、白細胞、單核細胞趨化蛋白-1、胰高血糖素樣肽-1、單核細胞趨化蛋白-1等炎癥因子也直接或間接參與胰島素抵抗及代謝綜合征發生發展過程,并相互作用[4] 。本研究發現,MS的患者血清炎性因子TNF-α、IL-2、IL-6、IL-8等的表達均高于正常人群參考值范圍。通過補充ω-3多不飽和脂肪酸能夠降低MS患者炎性因子TNF-α、IL-2、IL-6、IL-8等的表達,以往的研究也發現,補充ω-3多不飽和脂肪酸可以降低MS患者體內IL-6的表達[4-7] 。
研究發現,ω-3多不飽和脂肪酸可以降低TG、提高HDL等水平[8-14],一項長達25年的追蹤觀察也得到了一致結論,ω-3多不飽和脂肪酸確實可以降低MS的發病率[15] 。而本研究發現,補充ω-3多不飽和脂肪酸能夠降低MS患者血清TG和ApoB的水平,但未觀察到對TC、HDL-C和LDL-C的明顯作用。有研究發現,維持體內較低的ω-6/ω-3 PUFA比值,能夠降低體內的炎癥水平[16] 。而ω-6/ω-3 PUFA比值的升高也會增加肥胖的風險[17] 。本研究通過補充ω-3脂肪酸增加了MS患者血清中EPA、DPA、DHA等ω-3 PUFA的水平,降低了ω-6/ω-3 PUFA比值,也從這一角度驗證了補充ω-3脂肪酸對MS患者體內炎癥因子的表達的抑制作用。
綜上所述,通過補充ω-3脂肪酸增加MS患者體內ω-3 PUFA水平,降低ω-6/ω-3 PUFA比值,抑制MS患者體內炎癥反應從而改善了MS患者的脂代謝,但本研究納入患者數量不多,干預劑量沒有進一步進行階梯分組,因此還需要更深入的研究和探討,為MS的防治提供新的營養干預方向和科學依據。◇
參考文獻
[1]中華醫學會糖尿病學分會.中國2型糖尿病防治指南(2017年版)[J].中華糖尿病雜志,2018,10(1):4-67.
[2]Pirillo A,Catapano AL.Omega-3 polyunsaturated fatty acids in the treatment of hypertriglyceridaemia[J].Int J Cardiol,2013,170(2 Suppl 1):S16-S20.
[3]李紹臣,王建文,郭琳娜,等.炎癥相關因子在代謝綜合征形成中的作用研究[J].陜西醫學雜志,2016,45(5):560-562.
[4]那瑛,蘭麗珍.炎癥因子與代謝綜合征相關性研究的進展[J].中華臨床醫師雜志(電子版),2017,11(7):1200-1203.
[5]Tardivo AP,Nahas-Neto J,Orsatti CL,et al.Effects of omega-3 on metabolic markers in postmenopausal women with metabolic syndrome[J].Climacteric,2015,18(2):290-298.
[6]Perez-Martinez P,Delgado-Lista J,Garcia-Rios A,et al. Glucokinase regulatory protein genetic variant interacts with omega-3 PUFA to influence insulin resistance and inflammation in metabolic syndrome[J].Plos One,2011,6(6):e20555.
[7]Tousoulis D,Plastiras A,Siasos G,et al.Omega-3 PUFAs improved endothelial function and arterial stiffness with a parallel antiinflammatory effect in adults with metabolic syndrome[J].Atherosclerosis,2014,232(1):10-16.
[8]Angela P,L CA.Omega-3 polyunsaturated fatty acids in the treatment of atherogenic dyslipidemia[J].Atherosclerosis Supplements,2013,14(2):237-242.
[9]Venturini D,Simo ANC,Urbano MR,et al.Effects of extra virgin olive oil and fish oil on lipid profile and oxidative stress in patients with metabolic syndrome[J].Nutrition,2015,31(6):834-840.
[10]Abete I,Goyenechea E,Zulet MA,et al.Obesity and metabolic syndrome:potential benefit from specific nutritional components[J].Nutr Metab Cardiovasc Dis,2011,21(Suppl2):B1-B15.
[11]Tardivo AP,Nahas-Neto J,Orsatti CL,et al.Effects of omega-3 on metabolic markers in postmenopausal women with metabolic syndrome[J].Climacteric,2015,18(2):290-298.
[12]Benito P,Caballero J,Moreno J,et al.Effects of milk enriched with omega-3 fatty acid,oleic acid and folic acid in patients with metabolic syndrome[J].Clin Nutr,2006,25(4):581-587.
[13]Taghizadeh M,Jamilian M,Mazloomi M,et al.A randomized-controlled clinical trial investigating the effect of omega-3 fatty acids and vitamin E co-supplementation on markers of insulin metabolism and lipid profiles in gestational diabetes[J].J ClinLipidol,2016,10(2):386-393.
[14]Bremer AA,Stanhope KL,Graham JL,et al.Fish oil supplementation ameliorates fructose-induced hypertriglyceridemia and insulin resistance in adult male rhesus macaques[J].J Nutr,2014,144(1):5-11.
[15]Yong-Seok K,Pengcheng X,Carlos I,et al.Intake of fish and long-chain omega-3 polyunsaturated fatty acids and incidence of metabolic syndrome among American young adults:a 25-year follow-up study[J].European Journal of Nutrition,2016,55(4):1707-1716.
[16]DiNicolantonio JJ,O’Keefe JH.Importance of maintaining a low omega-6/omega-3 ratio for reducing inflammation[J].Open Heart,2018,5(2):e000946.
[17]Simopoulos AP.An Increase in the omega-6/omega-3 fatty acid ratio increases the risk for obesity[J].Nutrients,2016,8(3):128.
Abstract:Objective ? To investigate the effects of ω-3 fatty acids on glucose and lipid metabolism in patients with metabolic syndrome and preliminary study on its mechanism.Method ? Totally 60 patients with metabolic syndrome were randomly divided into two groups,taking placebo and ω-3 fatty acids for 12 weeks.The dosage of ω-3 fatty acids was 1 000 mg(EPA+DHA)per person per day.At the beginning and end of the study,blood pressure,body composition,blood glucose,blood lipids,serum inflammatory factors(including tumor necrosis factor,interleukin-2,interleukin-6,interleukin-8),serum polyunsaturated fatty acids,etc.were measured.Result ? At the end of the study,the levels of triglycerides and ApoB in the ω-3 fatty acid supplement group were significantly reduced,interleukin 6,interleukin 8,and tumor necrosis factor alpha were significantly reduced,and serum EPA,DPA and DHA were significantly increased,and the ratio of ω-6/-ω3 PUFA decreased significantly,and they were significantly different from the placebo group(P<0.05).Conclusion ? ω-3 fatty acids improve lipid metabolism in patients with metabolic syndrome by reducing the ratio of ω-6/ω-3 PUFA and inhibiting the inflammatory response.
Keywords:ω-3 fatty acids;lipid metabolism;metabolic syndrome

