雞胚營養組合物對衰老大鼠基因損傷修復的影響
祁昱 白麗民 馬佳 潘岳 劉兵 賈莉


摘要:目的:觀察雞胚營養組合物對衰老大鼠基因損傷修復的影響,探討其延緩衰老的可能機制。方法:采用D半乳糖建立衰老SD大鼠動物模型,每日1次頸背部皮下注射 D半乳糖500mg/(kg·d),連續造模90天,對照組頸背部皮下注射等劑量的生理鹽水注射液。從第1天起,雞胚營養組合物組、雞胚組、營養組合物組、蛋清組,分別以相應劑量對大鼠進行灌胃,每天1次,直至第90天,拉頸處死大鼠。取各組大鼠肝臟、骨髓和腦組織,采用RTPCR法檢測各組織修復基因的表達情況。結果:與衰老模型組相比,雞胚營養組合物組衰老大鼠肝臟和骨髓組織中錯配修復基因MSH2表達量升高(P<005);雞胚營養組合物組衰老大鼠肝臟組織中同源重組修復基因Xrcc1、Xrcc2、骨髓中同源重組修復基因Rad51以及腦組織中同源重組修復基因Rad51、Xrcc1表達量升高(P<005)。結論:雞胚營養組合物能夠修復衰老大鼠肝臟、骨髓和腦組織基因的損傷,此可能為其延緩衰老的作用機制之一。
關鍵詞:衰老;雞胚;營養組合物;修復基因
研究表明,氨基酸、核苷酸、維生素等營養物質有助于基因的復制以及損傷基因的自主修復[12]。雞胚蛋含有大量生物活性物質[3]。因此,本研究采用D半乳糖建立衰老動物模型,探討雞胚營養組合物對衰老大鼠基因損傷修復系統的影響,為雞胚營養組合物對延緩衰老的臨床治療提供科學依據。
1材料與方法
11材料
實驗動物:SD大鼠60只,由大連醫科大學實驗動物中心提供(SYXK 20130006)。營養組合物:由大連金斧公司提供,由賴氨酸、色氨酸、精氨酸、甘氨酸、牛磺酸、核苷酸、維生素C、維生素D、維生素B12、葉酸、鈣、鐵、鋅、硒等52種物質組成,按原方比率配方,經水煎、超聲、濃縮,配制成口服液,分裝備用。
主要試劑及儀器:D半乳糖(美國Sigma公司)、PCR儀(BIORAD)、凝膠成像分析儀(美國UVP公司AUTO MULTICHEMI)。
12大鼠衰老模型的建立
50只SD大鼠每日頸背部皮下注射D半乳糖500mg/kg,連續注射90天。正常對照組10只SD大鼠每日頸背部皮下注射等劑量的生理鹽水。每日稱重,并調整造模用藥的劑量。
13實驗分組及流程
60只SD大鼠隨機分為6個組:①正常對照組,10只大鼠,每日1次頸背部皮下注射500mg/(kg·d)的生理鹽水,②衰老模型組,10只大鼠,每日1次注射D半乳糖500mg/(kg·d),連續造模90d;③雞胚營養組合物組,10只大鼠,建模的同時以雞胚(用量同雞胚組)和營養組合物混合物進行灌胃;④雞胚組,10只大鼠,建模的同時選取第3天胚齡的雞蛋,每個雞蛋取3mL雞胚液,以1mL雞胚液對大鼠進行灌胃;⑤營養組合物組,10只大鼠,建模的同時,1~15天以0381 6g/d 對大鼠進行灌胃,16~30天以0763 2g/d 對大鼠進行灌胃,30~90天以1144 8g/d對大鼠進行灌胃;⑥蛋清組,10只大鼠,建模的同時選取未受精的雞蛋,每個雞蛋取3mL蛋清,以1mL蛋清液對大鼠進行灌胃(由于雞胚組、營養組合物組皆含有氨基酸類,因此特設蛋清組)。直至第90天,頸椎脫臼處死大鼠,每組留取大鼠肝臟組織,骨髓以及腦組織進行RTPCR檢測。
14RTPCR
141Trizol法提取總RNA取大鼠肝臟、骨髓和腦組織各100mg,加入1mL Trizol,室溫靜置5min;加入02mL氯仿,4℃,12 000g離心15min;加入等體積異丙醇,混勻,;棄上清,加入1mL預冷的75%乙醇, 充分洗滌沉淀, 4℃,7 500g離心5min;加入10μL DEPC水;紫外分光光度計測定A260和A280,以檢測RNA含量和純度。
142RTPCR分析反轉錄體系20μL,包含樣品RNA 1μL,按照TaKaRa的反轉錄試劑盒提供的說明書進行操作。反轉錄反應條件為:65℃ 1min,30℃ 5min,65℃ 15min,98℃ 5min,5℃ 5min。PCR反應體系50μL,包含反轉錄液10μL。PCR反應條件:94℃預變性1min;97℃變性20s,64℃退火20s, 72℃ 20s延伸,循環30次;72℃延伸5min,4℃恒定。取5μL PCR擴增產物經1%瓊脂糖凝膠電泳,紫外燈下凝膠成像。引物見附表。
15統計學分析
數據以均數±標準差表示,采用SPSS 170統計學軟件進行分析,P<005為有統計學意義。
2結果與分析
21雞胚營養組合物對衰老大鼠錯配修復基因的影響
圖1A顯示,在肝臟組織中,與正常對照組大鼠錯配修復基因MSH2(075±008)相比,衰老模型組MSH2表達量(036±002)下降(P<005);與衰老模型組相比,雞胚組和營養組合物組MSH2表達量均升高 (P<005),但其表達量均低于雞胚營養組合物組(057±005),蛋清組大鼠MSH2表達量無明顯變化(P>005);而錯配修復基因PMS2、MLH1、MSH3在肝臟組織中無明顯變化(P>005)。圖1B顯示,在骨髓組織中,與正常對照組大鼠MSH2(046±007)相比,衰老模型組MSH2表達量(020±004)下降(P<005);與衰老模型組相比,雞胚組和營養組合物組大鼠MSH2表達量升高(P<005),但其表達量仍低于雞胚營養組合物組(043±006),蛋清組大鼠MSH2表達量無明顯變化(P>005);而錯配修復基因PMS2、MLH1、MSH3在骨髓組織中無明顯變化(P>005)。圖1C顯示,在腦組織中,各組錯配修復基因無明顯變化(P>005)。
22雞胚營養組合物對衰老大鼠同源重組修復基因的影響
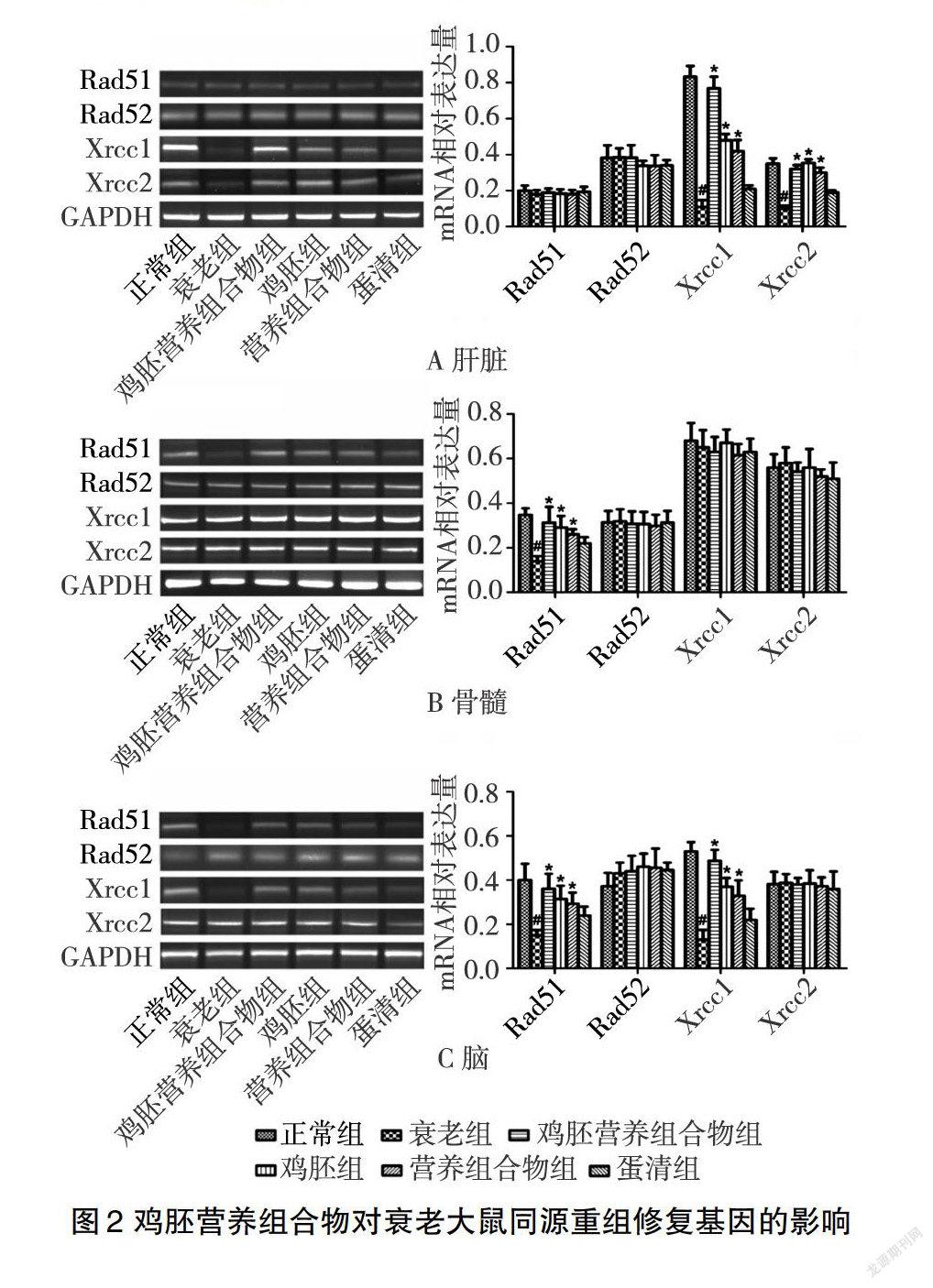
圖2A顯示,在肝臟組織中,與正常對照組中大鼠同源重組修復基因Xrcc1(082±006)和Xrcc2(038±003)相比,衰老模型組中Xrcc1(017±004)、Xrcc2(015±002)表達量均降低(P<005);與衰老模型組相比,雞胚和營養組合物處理衰老大鼠后,Xrcc1、Xrcc2表達量均升高(P<005),但雞胚營養組合物組中Xrcc1(077±007)、Xrcc2(036±002)表達量最高,而蛋清組大鼠Xrcc1、Xrcc2表達量無明顯變化(P>005);而重組修復基因Rad51、Rad52在肝臟組織中無明顯變化(P>005)。
圖2B顯示,在骨髓中,與正常對照組中大鼠同源重組修復基因Rad51(035±003)相比,衰老模型組Rad51(014±002)表達量下調(P<005);與衰老模型組相比,蛋清組Rad51表達量無明顯變化(P>005),雞胚營養組合物組、雞胚組、營養組合物組中大鼠Rad51表達量均上調(P<005),但雞胚營養組合物組大鼠Rad51(031±007)表達量最高;而重組修復基因Rad52、Xrcc1、Xrcc2在骨髓中均無明顯變化(P>005)。
圖2C顯示,在腦組織中,與正常對照組中大鼠同源重組修復基因Rad51(040±007)和Xrcc1(056±006)的相比,衰老模型組Rad51(015±002)、Xrcc1(015±005)表達量均降低(P<005);雞胚和營養組合物處理衰老大鼠后,Rad51、Xrcc1表達量均增高(P<005),但雞胚營養組合物組中Rad51(036±007)、Xrcc1(047±007)表達量最高;與衰老模型組相比,蛋清組大鼠Rad51、Xrcc1表達量均無明顯變化(P>005);而重組修復基因Rad52、Xrcc2在腦組織中無明顯變化(P>005)。
3討論
探討雞胚營養組合物調節修復損傷DNA的能力對于延緩衰老,預防老年性疾病方面具有重要的臨床應用[45]。
有文獻證實,錯配修復基因MSH2缺失會造成微衛星不穩定,從而加速衰老[67]。本研究顯示,雞胚營養組合物可以有效恢復衰老大鼠肝臟和骨髓組織中MSH2的表達量,這表明雞胚營養組合物能夠修復機體因衰老造成的錯配修復基因缺失。本研究顯示,雞胚營養組合物可以有效恢復衰老大鼠肝臟、骨髓和腦組織中Rad51的表達水平,表明雞胚營養組合物可以在一定程度上延緩細胞衰老。進一步研究顯示,同源重組修復基因Xrcc1的部分丟失會導致小鼠腦損傷增加,小鼠缺血性中風恢復能力降低[8]。我們的研究結果同樣證實了雞胚營養組合物促進衰老大鼠肝臟及腦中Xrcc1的表達,進而對衰老大鼠同源重組修復基因的損傷具有恢復作用。
綜上所述,雞胚營養組合物可以有效提高衰老大鼠DNA損傷修復能力,為其應用于臨床延緩衰老的治療提供了科學依據。◇
參考文獻
[1]Ou HL, Schumacher B DNA damage responses and p53 in the aging process [J] Blood,2018,131(5): 488495
[2]苗小艷,賈莉,楊佩滿營養組合物對再生障礙性貧血小鼠肝干細胞的影響[J]中國老年學雜志,2015,35(13):35363538
[3]李曦 雞胚蛋對免疫力低下小鼠的免疫調節功能研究[D]江南大學,2012
[4]Bonnet A E, Marchalant Y Potential Therapeutical Contributions of the Endocannabinoid System towards Aging and Alzheimers Disease [J] Aging and Disease,2015, 6(5): 400405
[5]Chatterjee N,Walker GC Mechanisms of DNA damage, repair, and mutagenesis[J] Environ Mol Mutagen,2017,58(5): 235263
[6]Li Z,et al DNA mismatch repair and the DNA damage response[J] DNA Repair (Amst),2016(38):94101
[7]李勇,金梅花,全吉淑,等錯配修復蛋白MSH2和MSH6在衰老SD大鼠組織中的表達及其意義[J]延邊大學醫學學報,2010,33(4):249250
[8]Ghosh S, Canugovi C, Yoon JS, ,et al Partial loss of the DNA repair scaffolding protein, Xrcc1, results in increased brain damage and reduced recovery from ischemic stroke in mice[J] Neurobiol Aging,2015, 36(7): 23192330

