幾種茶多糖對糖尿病模型小鼠血糖的影響
劉丹奇 任發政 侯彩云



摘要:目的:研究和對比白茶、綠茶和紅茶粗制多糖(crude tea polysaccharides,CTPs)的降血糖效果及機理。方法:分別選取壽眉、龍井、白琳工夫作為白茶、綠茶和紅茶的代表,制備粗多糖。以鏈脲佐菌素誘導小鼠糖尿病模型,二甲雙胍作為陽性對照,研究粗制茶多糖對小鼠體重、空腹血糖、胰島素抵抗指數、葡萄糖耐量和胰腺組織病變情況的影響,qPCR測定小鼠肝臟中相關基因表達水平。結果:CTPs均具有降血糖功效,白茶、綠茶、紅茶多糖的空腹血糖下降率分別為470%、478%、367%;CTPs均可改善小鼠葡萄糖耐量,下調Foxo1、G6Pc、PEPCK和TXNIP基因的表達量。結論:本實驗劑量條件下,研究所選粗制茶多糖提取物均具有降血糖效果,其中綠茶多糖作用最明顯。
關鍵詞:茶多糖;降血糖;糖代謝
糖尿病常用治療藥物有多種毒副作用[12],因此尋求天然植物來源的安全功效成分十分必要。茶多糖是茶葉中存在的一類具有多種生物活性的多糖復合物,多為與蛋白質結合的酸性糖蛋白[3]。Zhou等[4]研究發現,茶多糖可能是粗老茶治療糖尿病的主要藥理成分。也有研究表明,茶多酚和茶色素等成分均具有降血糖效果[57]。劉安軍等[8]研究發現,茶多酚可以作為茶多糖的協同因子,共同發揮降血糖作用,效果優于茶多糖單獨干預組。本實驗室前期研究中也發現,白茶壽眉粗多糖提取物的降血糖效果優于多糖含量相對更高的黃大茶粗多糖提取物,茶多糖的含量與降血糖效果未呈正相關規律。近年來研究表明,茶葉種類對茶多糖的降血糖活性會產生影響[9],但相關研究較少,對于白茶茶多糖缺少深入研究和對比。本研究在實驗室前期基礎上,以壽眉白茶多糖作為研究對象,選取龍井綠茶多糖及白琳工夫紅茶多糖作為對照,旨在研究不同種類茶葉多糖降血糖效果的差異性,并進一步探究其具體作用機制。
1材料與方法
11材料、試劑與實驗動物
白茶壽眉、綠茶龍井、紅茶白琳工夫,購于北京馬連道茶城。鏈脲佐菌素(streptozotocin,STZ),美國Sigma公司;鹽酸二甲雙胍片,中美上海施貴寶制藥有限公司;異丙醇、氯仿、無水乙醇等(分析純),北京化工廠;考馬斯亮藍蛋白測定試劑盒,南京建成生物工程研究所;小鼠胰島素測定試劑盒,江蘇菲亞生物科技有限公司;Trizol試劑,碧云天生物科技有限公司;EvaGreen 2X qPCR MasterMixNo Dye試劑盒、5X AllInOne RT MasterMix試劑盒,美國ABM公司;測定基因相關引物,生工生物工程(上海)股份有限公司;SPF級4周齡雄性ICR小鼠,許可證號SCXK(京)20160002,北京斯貝福生物技術有限公司;45%脂肪供能高脂高糖飼料及小鼠維持飼料,北京華阜康生物科技股份有限公司。動物實驗于屏障環境動物房[溫度(22±2)℃、濕度50%±5%、壓差20~50 Pa,12 h晝夜交替]進行,遵循國家及提供實驗動物單位的實驗動物福利規則和制度。
12儀器與設備
T 6新世紀紫外可見分光光度計、RE52 AA真空旋轉蒸發儀、真空冷凍干燥機、Roche活力型血糖儀、Thermofisher Nanodrop 2000核酸蛋白檢測儀、Nikon Eclipse Ci光學顯微鏡、Biometra Tpersonal梯度PCR儀、Roche lightcycler 96熒光定量PCR儀等。
13方法
131粗制茶多糖的制備與理化成分測定茶葉使用萬能粉碎機磨碎,過40目篩備用。準確稱量茶粉,參照保健食品功能學評價程序與檢驗方法規范中動物實驗受試物相關的制備方法[10],茶水比為1∶15,80℃水浴浸提1h,減壓過濾,保留濾液,濾渣重復于80℃水浴浸提1h,再次減壓過濾。合并兩次濾液,冷卻一段時間后于55℃條件下旋轉蒸發得到濃縮液。之后在濃縮液中加入4倍體積的95%乙醇,超聲溶解30min后,4 000 r/min離心15min,將沉淀物真空冷凍干燥36 h,分別得到粗制白茶多糖(CWP)、粗制綠茶多糖(CGP)、粗制紅茶多糖(CBP),在4℃下密封保存[11]。分別采用苯酚硫酸比色法[12]測定茶多糖含量、考馬斯亮藍試劑盒法測定蛋白質含量、福林酚法[13]測定茶多酚含量、三氯化鋁比色法[14]測定總黃酮含量。
132動物實驗小鼠置于屏障環境動物房適應性喂養7 d后,隨機選取其中10只喂養維持飼料,作為正常對照組(NC),其余小鼠喂養45%高脂高糖飼料。連續喂養4w后,禁食12h(隔夜),小鼠腹腔注射配制的STZ溶液110 mg/(kg·BW)。1w后測定血糖,空腹血糖(FBG)≥111mmol/L視為造模成功[15]。將造模成功后的小鼠按照FBG情況隨機分為模型對照組(MC)、陽性對照組(PC)、CWP干預組、CGP干預組和CBP干預組,每組10只小鼠。茶多糖干預組參照已有研究[16],制定小鼠灌胃劑量為300mg/(kg·d)。PC組選用鹽酸二甲雙胍,根據成年人的每日最大劑量(15 g),按照文獻相關方法換算后,制定小鼠用藥劑量為250mg/(kg·d)[17]。
133葡萄糖耐量實驗4w干預結束前,將所有小鼠禁食不禁水15h(隔夜),取小鼠尾尖血,使用血糖儀測定FBG,作為0時血糖。測定之后馬上給每只小鼠灌胃15g/(kg·BW)葡萄糖,記錄灌胃后30、60、90、120 min血糖,并繪制時間血糖折線圖[18],按照式(1)計算每組折線的曲線下面積(AUC)。
AUC(mmol·h/L)=(A/2+B+C+D+E/2)/2(1)
式(1)中,A、B、C、D、E分別表示0、30、60、90、120 min時刻的血糖值。
134生化指標檢測4w干預結束后,將小鼠禁食12h(隔夜),內眥采血,斷頸處死。將血樣在4℃、4 000r/min條件下離心15min,分離血清樣本,于-20℃條件下保存。按照試劑盒說明書方法測定血清中胰島素(FIS)含量。
135胰腺組織病理學分析剖取小鼠胰腺組織,置于體積為胰腺組織10倍的4%多聚甲醛固定液中固定48h。常規取材,脫水,石蠟包埋,制片(4μm厚),HE染色,光學顯微鏡觀察胰腺組織的病理學變化,并以200倍視野拍照保存。
136實時熒光定量PCR檢測Trizol試劑抽提小鼠肝臟RNA,使用氯仿、無水乙醇等試劑對RNA進行清洗處理。檢測RNA濃度及質量后,按試劑盒標明的梯度程序反轉錄制備cDNA第一鏈,-20℃條件下保存。熒光定量采用10μL體系,按照試劑盒標明的梯度程序:95℃ 10 min、95℃ 15 s、60℃ 60 s,循環45次。以 GAPDH 為內參基因,采用2-(ΔΔCT)法[19]對各基因的表達水平進行分析。測定基因:叉頭轉錄因子(Foxo1)、葡萄糖6磷酸酶(G6Pc)、磷酸烯醇式丙酮酸羧化酶(PEPCK)和硫氧還蛋白互作蛋白(TXNIP),引物序列如表1所示。
14數據處理
采用SPSS 200軟件進行統計學分析,以均數±標準誤差(X±SE)表示;組間均數比較采用單因素方差分析,P<005表示差異顯著、P<001表示差異極顯著。圖像采用Origin 80軟件處理。
2結果與分析
21茶多糖的主要成分
由表2可知,CWP中的多糖含量最高且顯著高于CGP,粗制茶多糖提取物均含有多種雜質成分。
22茶多糖的降血糖作用相關測定結果分析
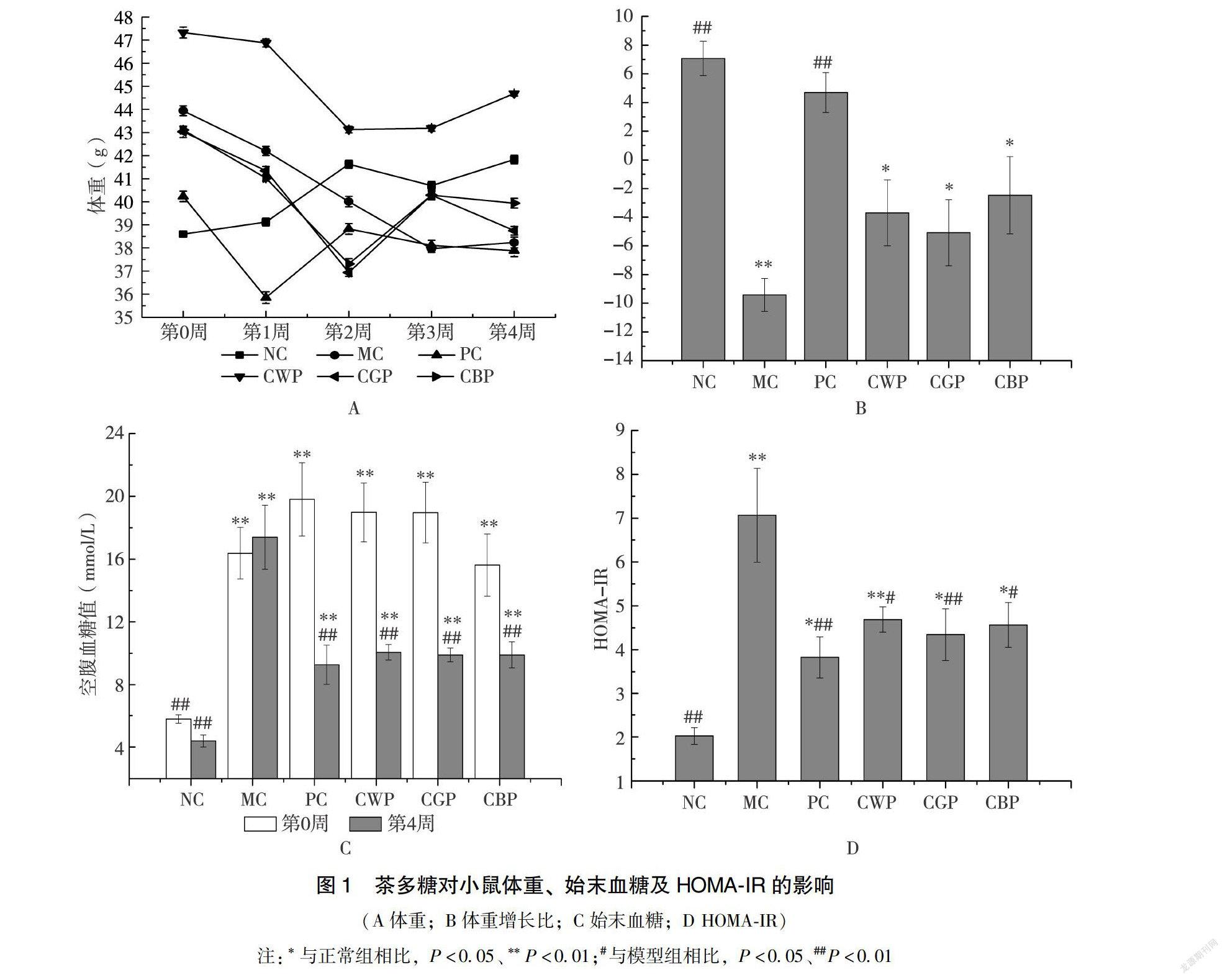
221茶多糖對糖尿病小鼠體重、始末血糖及胰島素抵抗(HOMAIR)指數的影響造模成功后的小鼠均出現典型的“三多一少”癥狀,且體重變化較為明顯。小鼠FBG在造模成功后會有顯著上升,4w灌胃干預對小鼠糖尿病的治療效果則可以通過最后1周和造模成功時FBG的變化來表明。改善小鼠的胰島素抵抗水平可有效提高胰島素敏感性,從而改善高胰島素血癥,降低小鼠血糖水平,衡量的指標之一為HOMAIR指數[2021],計算公式為式(2):
HOMAIR=FBG*FIS/225(2)
如圖1A所示,NC組體重較為穩定,MC及PC組體重波動幅度較大,整體呈下降趨勢。多糖干預組中CWP體重與其他組差異較為明顯,但干預組均呈現整體下降趨勢,在第3、4周趨于平緩甚至體重有所回升。為更加明顯區分組間差異性,計算各組的體重增長百分比。如圖1B所示,MC組、CTPs組均呈現負增長,未表現出較好的改善效果。如圖1C所示,小鼠在造模成功后測定初始FBG,各組間無顯著差異(P>005)。MC組經4w喂養后,FBG有所升高,但并未達到顯著水平。藥物和多糖干預組4w喂養后FBG均降低,PC、CWP、CGP、CBP組的血糖下降率分別為532%、470%、478%、367%。可知CTPs組降血糖效果均略遜于PC組,其中CGP組效果最好。如圖1D所示,小鼠造模成功后的IR值明顯增加,其中MC組和CWP組極顯著高于NC組(P<001),同時CWP組和CBP組顯著低于MC組(P<005),對緩解小鼠胰島素抵抗水平有一定效果,PC組及CGP組則極顯著低于MC組(P<001),均有很好地緩解胰島素抵抗效果,多糖組中CGP組效果較好。
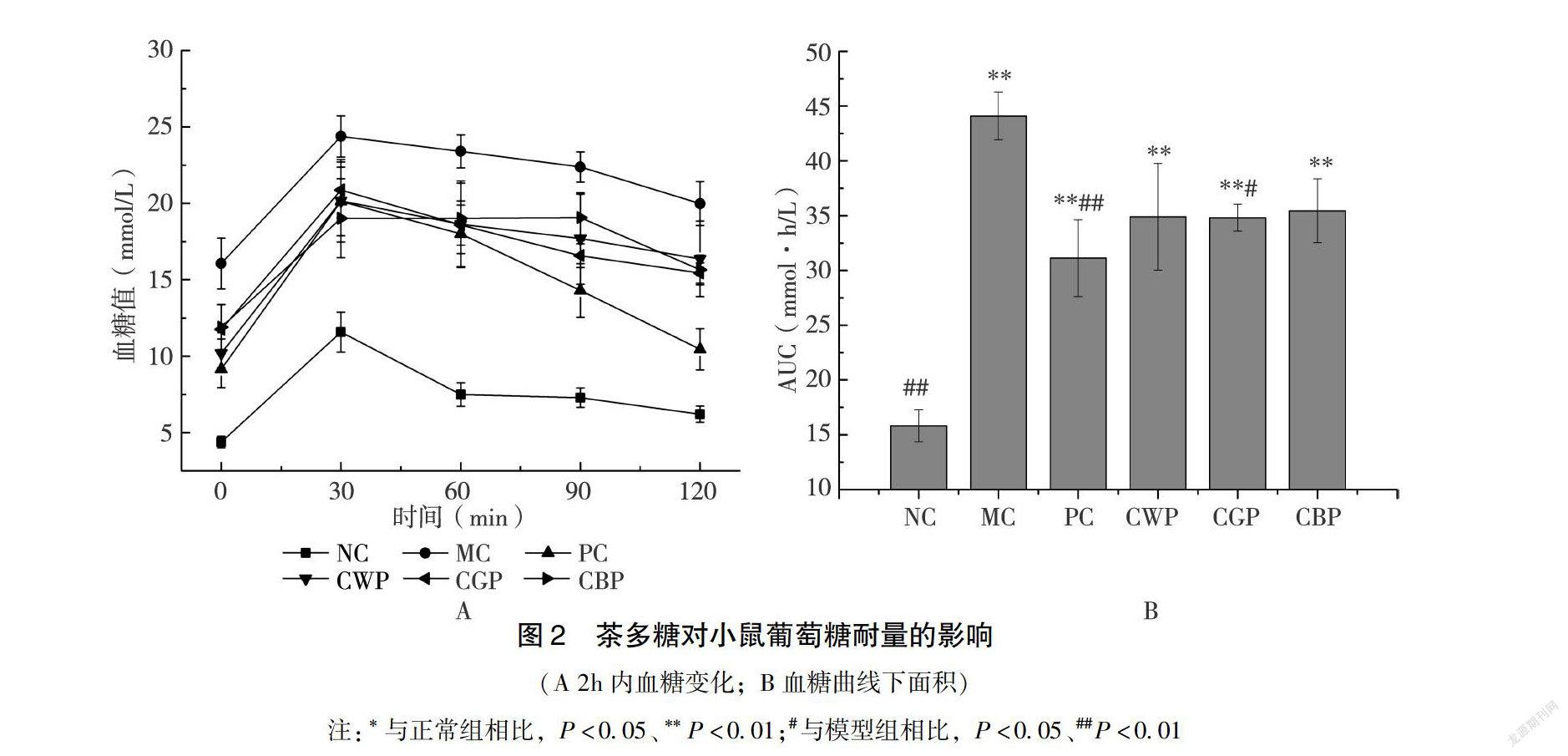
222茶多糖對糖尿病小鼠葡萄糖耐量的影響口服葡萄糖耐量試驗(OGTT)是一種葡萄糖負荷試驗,已廣泛應用于臨床實踐中[22]。小鼠在4w喂養結束后進行該試驗,如圖2A所示,多數干預組血糖值灌胃葡萄糖30min后達到頂峰,之后逐步下降,少數干預組(CWP、CBP)血糖值在30~90min之間變化緩慢。NC組小鼠血糖在120min時恢復正常,MC組血糖下降較為緩慢,表現出明顯的葡萄糖不耐受。為區分其他干預組的組間差異,對曲線AUC進行計算,如圖2B所示,CWP組和CBP組較MC組有所下降,但未達到顯著水平(P>005);CGP組顯著低于MC組(P<005),顯示出較好地改善小鼠葡萄糖耐量的效果。
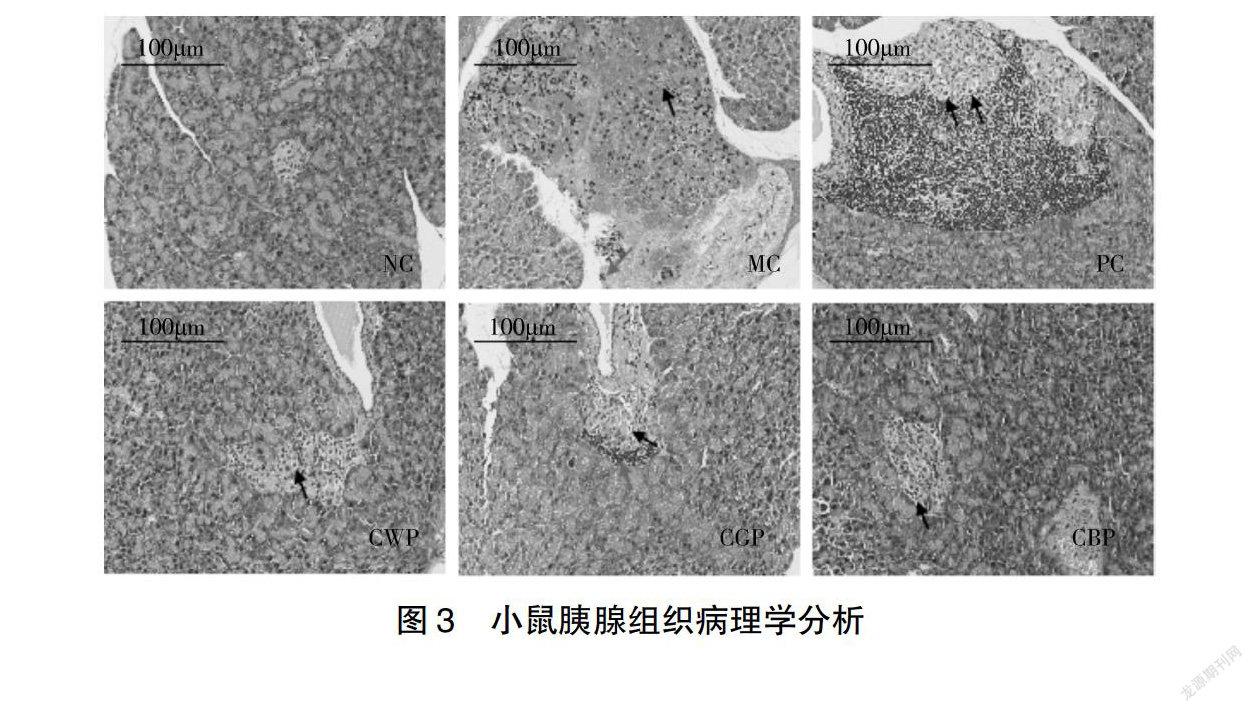
223小鼠胰腺組織的病理學分析如圖3所示,NC組小鼠胰島性狀規則,胰島細胞分布均勻,腺泡細胞形態正常,組織未發生病變。MC組小鼠胰島形狀不規則,腺泡結構被破壞,腺泡大量消失(黑色箭頭所示),并伴有組織增生,可見較多絲網狀物質(紅色剪頭所示),整體表明MC組胰島損傷嚴重,有脂肪變性征兆。PC組胰島性狀不規則,大量胰島細胞胞質疏松或呈空泡狀(黑色箭頭所示),局部胰島附近可見淋巴細胞浸潤(紅色剪頭所示),整體表明PC組小鼠胰島細胞損傷較嚴重,可見二甲雙胍藥物對改善小鼠胰腺組織病變的效果并不明顯。CTPs干預組中,CWP組小鼠胰島形狀不規則,少量胰島細胞胞質呈空泡狀(黑色箭頭所示),組織整體未見明顯異常;CGP組小鼠胰島形狀不規則,部分胰島細胞胞質呈空泡狀(黑色箭頭所示),一處胰島周圍有少量淋巴細胞灶性浸潤(紅色剪頭所示),未見其他明顯異常;CBP組小鼠胰島形狀不規則,少量胰島細胞胞質呈空泡狀(黑色箭頭所示),未見其他明顯異常。整體表明,CTPs均能部分改善小鼠胰腺組織的病理狀態,但組間差異不明顯。
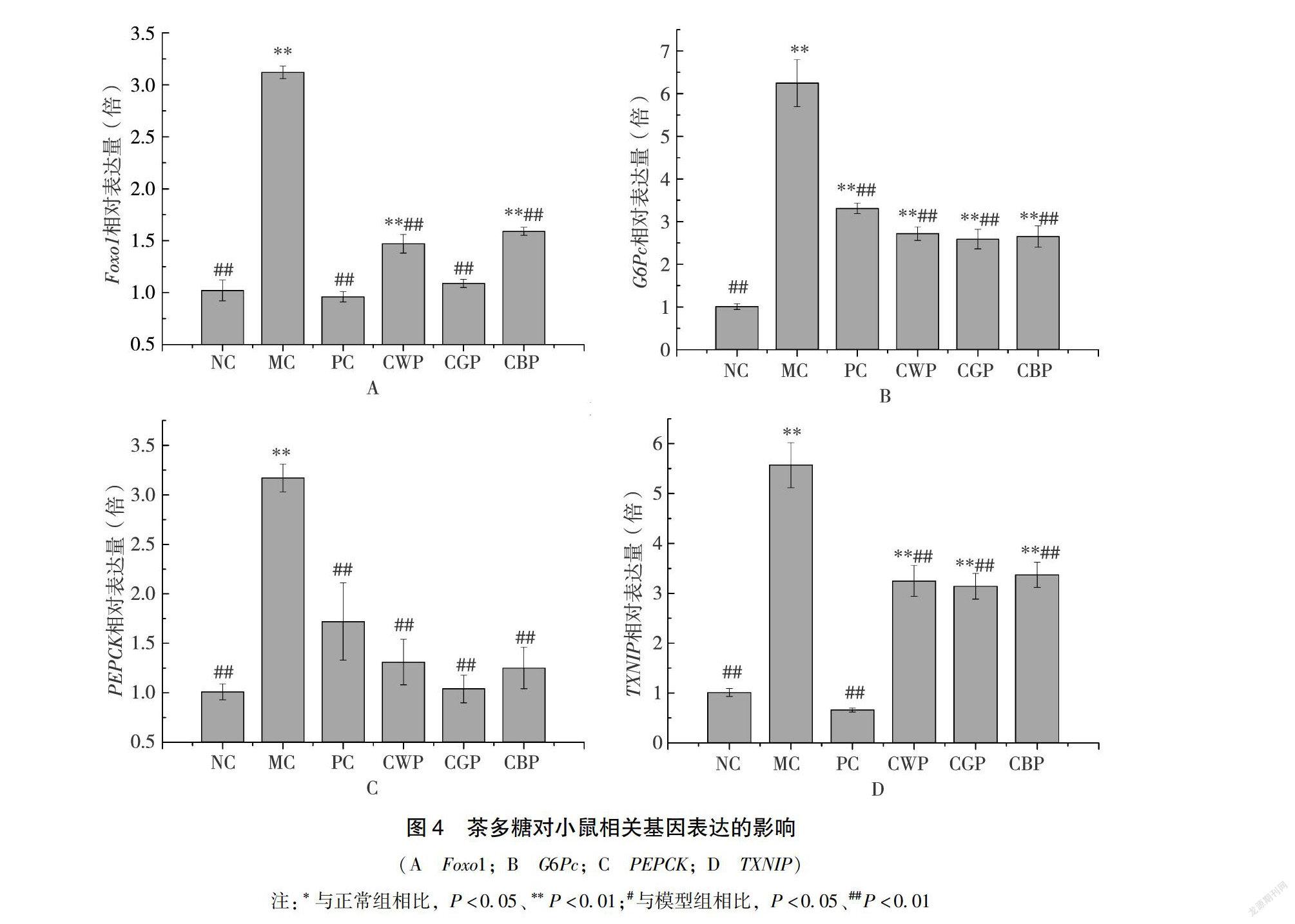
224茶多糖對糖尿病小鼠肝組織相關基因表達的影響Foxo1基因是胰島β細胞的一種關鍵調控因子,對其增殖存在抑制作用[23],進而導致胰島素分泌減少,破壞糖代謝平衡,使血糖升高。由圖4A可知,MC組的基因相對表達量極顯著高于NC組(P<001),干預組與MC組相比均極顯著下調了基因相對表達量(P<001),其中CGP效果最優。G6Pc基因和PEPCK基因均為糖異生途徑調控基因,在肝臟中表達量的增加會促進非糖物質轉化為葡萄糖,進而轉運至血管中提高血糖水平[24]。由圖4B、C可知,MC組的兩種基因相對表達量均極顯著高于NC組(P<001),藥物和多糖干預組則與MC組相比均能夠極顯著下調兩種基因的相對表達量(P<001),但各組之間無顯著差異(P>005)。其中CGP效果最優。TXNIP基因是一種細胞炎癥分子,其表達量的增加會促進胰島β細胞的凋亡[25]。由圖4D可知,MC組的相對表達量極顯著高于NC組(P<001),與MC組相比,藥物與多糖干預組均能極顯著下調基因相對表達量(P<001)。多糖組效果均明顯弱于PC組,其中CGP在多糖干預組中效果最優,表明其在消除炎癥方面具有優勢。
3討論
本研究選取的茶多糖提取物均可改善小鼠的糖尿病癥狀。以血糖下降率為主要指標來看,降血糖效果整體呈現出綠茶多糖>白茶多糖>紅茶多糖的規律,未與茶多糖的含量呈正相關,但隨茶多酚含量的增加而提高。這表明茶葉中影響降血糖活性的因子不僅茶多糖一種,在茶多糖含量相對較少時,茶多酚可能會成為發揮降血糖功效的主要因子,也可能與茶多糖存在協同效應,進一步佐證了實驗室前期在白茶和黃茶粗多糖的研究中得到的茶多糖并不是唯一降血糖因子的結果。實驗所選茶多糖在調節糖尿病代謝途徑相關基因表達方面也具有一定作用,均可下調糖異生途徑關鍵基因G6Pc和PEPCK的表達量,抑制葡萄糖的生成,進而降低血糖。同時,茶多糖均可下調Foxo1基因的表達,減弱對胰島β細胞的抑制,從而增加胰島素分泌,改善糖尿病癥狀。此外,茶多糖對炎癥分子TXNIP基因的表達也有抑制作用,緩解胰島β細胞的凋亡,進而增加胰島素分泌。茶多糖的降血糖活性會受到很多因素影響,降糖作用途徑較多,靶點也不止一處[24],純度、劑量、吸收方式等因素對其降血糖活性的影響及茶多糖的其他作用途徑和降糖靶點有待進一步研究。◇
參考文獻
[1]宋林珍,朱麗云,高永生,等茶多糖的結構特征與降血糖活性[J].食品科學,2018,39(19):162168
[2]Bergenstal R M,Wysham C,Macconell L,et alEfficacy and safety of exenatide once weekly versus sitagliptin or pioglitazone as an adjunct to metformin for treatment of type 2 diabetes (DURATION2):a randomised trial[J].Lancet,2010,376(9739):431439
[3]邵淑宏烏龍茶多糖理化性質及抗氧化、降血糖活性研究[D].杭州:浙江大學,2015
[4]Zhou XL,et alEffects of soluble tea polysaccharides on hyperglycemia in alloxandiabetic mice[J].Journal of Agricultural and Food Chemistry,2007,55(14):55235528
[5]楊馮,趙國華茶多酚降血糖研究進展[J].食品工業科技,2009(9):324327
[6]丁仁鳳,何普明,揭國良茶多糖和茶多酚的降血糖作用研究[J].茶葉科學,2005,25(3):219224
[7]侯辰俠,楊哲,楊超,等茶葉不同提取成分降血糖作用的研究與比較[J].現代生物醫學進展,2010,10(12):22412243
[8]劉安軍,鄧穎,王雅靜茶多糖及協同因子的降血糖作用研究[J].現代食品科技,2012,28(2):139141
[9]倪德江,謝筆鈞,宋春和不同茶類多糖對實驗型糖尿病小鼠治療作用的比較研究[J].茶葉科學,2002,22(2):160163
[10]中華人民共和國衛生部保健食品檢驗與評價技術規范(2003年版)[S].北京:衛生部衛生法制與監督司編印,2003:115117
[11]Wang H,Shi S,Bao B,et alStructure characterization of an arabinogalactan from green tea and its antidiabetic effect[J].Carbohydrate Polymers,2015,124:98108
[12]張媛媛,張彬苯酚硫酸法與蒽酮硫酸法測定綠茶茶多糖的比較研究[J].食品科學,2016,37(4):158163
[13]中華人民共和國國家質量監督檢驗檢疫總局GB/T 8313—2008中華人民共和國國家標準茶葉中茶多酚和兒茶素含量的檢測方法[S].北京:中國標準出版社,20080504
[14]馬陶陶,等三氯化鋁比色法測定中藥總黃酮方法的探討[J].時珍國醫國藥,2008,19(1):5456
[15]Islam M S,Loots T DExperimental rodent models of type 2 diabetes:a review[J].Methods & Findings in Experimental & Clinical Pharmacology,2009,31(4):249
[16]倪德江,等綠茶、烏龍茶、紅茶的茶多糖組成、抗氧化及降血糖作用研究[J].營養學報,2004(1):5760
[17]黃繼漢,黃曉暉,陳志揚,等藥理試驗中動物間和動物與人體間的等效劑量換算[J].中國臨床藥理學與治療學,2004,9(9):10691072
[18]玄光善,潘士佳,南姬桑葉有效成分降糖作用研究[J].食品科學,2011(7):323326
[19]Livak K J,Schmittgen T DAnalysis of relative gene expression data using realtime quantitative PCR and the 2-ΔΔCT method[J].Methods,2012,25(4):402408
[20]李秀鈞,錢榮立胰島素抵抗及其臨床意義[J].中國糖尿病雜志,1999(3):163167
[21]Tang W,Li S,Liu Y,et alAntidiabetic activity of chemically profiled green tea and black tea extracts in a type 2 diabetes mice model via different mechanisms[J].Journal of Functional Foods,2013,5(4):17841793
[22]Garancini M P,et alPrevalence of NIDDM and impaired glucose tolerance in Italy:an OGTTbased population study[J].Diabetologia,1995,38(3):306313
[23]黃荷Foxo1對糖尿病胰腺β細胞的作用[J].內科,2009,4(3):404407
[24]Wu J,Shi S,Wang H,et alMechanisms underlying the effect of polysaccharides in the treatment of type 2 diabetes:a review[J].Carbohydrate Polymers,2016(144):474494
[25]Shalev ALack of TXNIP protects βcells against glucotoxicity[J].Biochemical Society Transactions,2008,36(Pt 5):963965

