氨基酸聚合物用于提高凍干過程中蛋白穩定性的研究
李 冰, 叢自豪, 肖希勉, 武月銘, 劉潤輝
(華東理工大學生物反應器工程國家重點實驗室,超細材料制備與應用教育部重點實驗室,教育部醫用生物材料工程研究中心,材料科學與工程學院,上海 200237)
β-半乳糖苷酶(β-Gal)是糖苷水解酶(GH-A)超家族的成員,可以水解半乳糖苷內的糖苷鍵以釋放半乳糖[1]。β-Gal 活性降低或缺失會導致消化乳糖能力下降。研究表明全球約有65%的人遭受乳糖不耐癥的困擾[2],因此,β-Gal 在乳制品行業中被廣泛用于制造低乳糖和無乳糖的乳制品[3]。此外,β-Gal 作為熒光探針的酶標,用于觀察卵巢癌的轉移,在遺傳學治療領域具有非常重要的意義[4]。蛋白質在水溶液中會受到含水制劑的活性分子對其化學以及物理穩定性的影響,所以需要將其通過冷凍干燥制成凍干粉,以便長期儲存和使用。然而,在溫度極低、濃度變化、低壓操作、pH 改變和干燥失水等條件下會導致蛋白失活和二級結構改變,因此在冷凍、干燥和再水化過程中維持β-Gal 的結構、構象穩定性和活性仍然受到挑戰,β-Gal 在凍干前需加入蛋白質穩定劑以維持其在冷凍干燥過程中的活性。
蛋白質穩定劑有氨基酸[5-7]、糖[8-10]、蛋白[11]、鹽[12-13]、聚合物[14-21]等,氨基酸能夠在冷凍狀態下增加水的表面張力[7],蔗糖[22-23]、海藻糖[18,24]等糖類可以保留蛋白質附近的水分子,其與蛋白質形成的氫鍵可以在冷凍干燥過程中穩定蛋白質。此外,聚合物如聚(乙二醇)[25]、聚(乙烯亞胺)[16]、羥丙基-β-環糊精[14]可用作添加劑以防止蛋白質的聚集和變性。
本文選擇兩種單一手性L-氨基酸進行合成,并將其共混聚合物作為蛋白穩定劑。這是因為L-氨基酸不僅比外消旋氨基酸便宜而且容易降解成人體必需氨基酸;此外,根據水的替代機理,聚L-谷氨酸(PLG)能夠與蛋白質形成氫鍵并在凍干過程中取代水分子以防止蛋白聚集[5,7,26];玻璃化轉變機理也表明聚L-賴氨酸(PLL)的非晶結構可以降低蛋白玻璃化轉變溫度[27-28]。通過雙(三甲基硅基)氨基鋰(LiHMDS)引發的快速氨基酸環內酸酐(NCA)聚合,制備了PLG、PLL氨基酸聚合物,該聚合物具有對水分不敏感、反應速率快的特性,可用于快速篩選合適的蛋白保護劑[29-30]。
1 實驗部分
1.1 實驗試劑
L-谷氨酸-5-叔丁酯:純度98%,阿拉丁試劑(上海)有限公司;Nε-(叔丁氧基羰基)-L-賴氨酸:純度98%,上海邁瑞爾化學技術有限公司;三光氣:純度99%,北京伊諾凱科技有限公司;α-蒎烯:純度99%,北京伊諾凱科技有限公司;β-半乳糖苷酶:5 000 U,阿拉丁試劑(上海)有限公司;2-硝基苯基-β-D-吡喃半乳糖苷(ONPG):純度99%,阿拉丁試劑(上海)有限公司;LiHMDS:純度99%,西格瑪-奧德里奇(上海)貿易有限公司;DMEM 培養液,GE 醫療生命科學部;3-(4,5-二 甲 基 噻 唑-2)-2,5-二 苯 基 四 氮 唑 溴 鹽(MTT):純度98%,上海麥克林生化科技有限公司;其他化學試劑均購于上海泰坦科技股份有限公司,使用前無進一步處理。
1.2 測試與表征儀器
核磁共振波譜儀(德國Bruker 公司,AVANCEⅢ 400 MHz 型):重水(D2O)為溶劑;凝膠滲透色譜:Waters 1515 等強度HPLC 泵;Waters 2414 示差折光檢測器(RI);東曹TSKgel Alpha-3000 柱(粒徑為7 μm);東曹TSKgel Alpha-2500 柱(粒徑為7 μm),柱溫箱溫度為50 °C,檢測器溫度為35 °C;流動相為含10 mmol/L 溴化鋰的二甲基甲酰胺(DMF),流速1 mL/min,標準樣為聚甲基丙烯酸甲酯;酶標儀為Molecular Devices SpectraMax M2。
1.3 NCA 單體的合成
1.3.1Nε-(叔丁氧基羰基)-L-賴氨酸-N-羧酸-環內酸酐(Boc-L-Lys NCA)的合成 Boc-L-Lys NCA 合成路線如圖1 所示[31]。在高純氮氣保護下,將Nε-(叔丁氧基羰基)-L-賴氨酸(10.00 g,40.60 mmol)和α-蒎烯(16.98 mL,107.18 mmol)分別加入250 mL 圓底燒瓶中。再加入干燥的四氫呋喃(THF)溶劑使單體懸浮。將三光氣(5.30 g,17.86 mmol)提前溶解在干燥THF 中,冰浴及氮氣保護下將其注入上述圓底燒瓶中,使單體濃度為0.3 mol/L。將反應瓶轉移至50 °C油浴鍋里反應并保持2 h,點板監控反應結束后撤掉油浴,使用低溫冷凝旋蒸除去多余THF 并立即加入100 mL 乙酸乙酯(EA),轉移至500 mL 的分液漏斗中,加入100 mL 冰水萃取1 次,收集有機相并用100 mL冷的飽和食鹽水洗滌1 次,無水硫酸鎂干燥后過濾,使用干燥的EA 和石油醚(PE)混合溶劑重結晶3 次(EA 與PE 體積比為4∶5),在充滿氮氣的手套箱中過濾得到白色粉末狀晶體5.30 g,產率為48%。1.3.2L-谷氨酸-5-叔丁基-N-羧酸-環內酸酐(tBu-LGlu NCA)的合成tBu-L-Glu NCA 合成路線如圖2所示[32]。在高純氮氣保護下,將L-谷氨酸-5-叔丁酯(5.00 g,24.60 mmol)和α-蒎烯(9.35 mL,59.04 mmol)分別加入250 mL 圓底燒瓶中。再加入干燥的THF 溶劑使單體懸浮。將三光氣(2.92 g,9.84 mmol)提前溶解在干燥的THF 中,冰浴及氮氣保護下將其注入上述圓底燒瓶中,使單體濃度為0.3 mol/L。將反應瓶轉移至50 °C 油浴鍋里反應并保持2 h,點板監控反應結束后撤掉油浴,使用低溫冷凝旋蒸除去多余THF 并立即加入100 mL EA,轉移至500 mL 的分液漏斗中,加入100 mL 冰水萃取1 次,收集有機相并用100 mL 冷的飽和食鹽水洗滌1 次,無水硫酸鎂干燥后過濾,使用干燥的EA 和PE 混合溶劑重結晶3 次(EA 與PE 體積比為1∶2),在充滿氮氣的手套箱中過濾得到白色粉末狀晶體3.10 g,產率為55%。
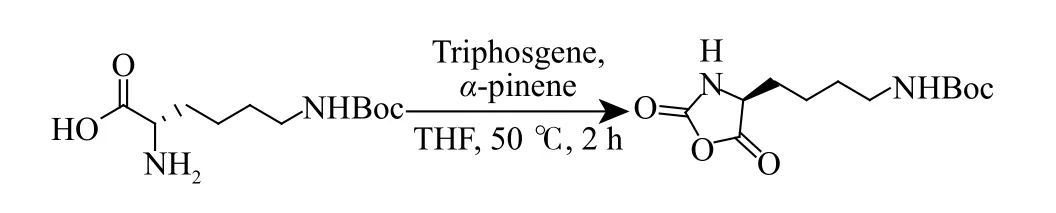
圖1 Boc-L-Lys NCA 合成路線Fig.1 Synthetic route of Boc-L-Lys NCA
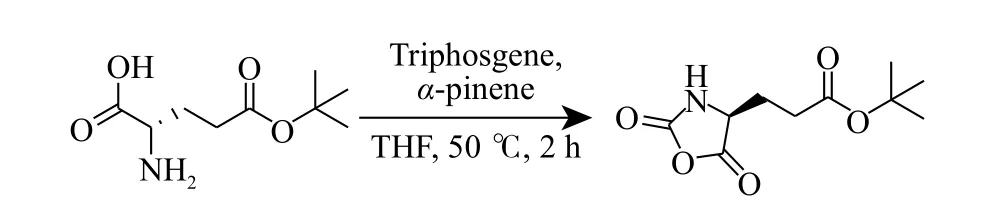
圖2 tBu-L-Glu NCA 合成路線Fig.2 Synthetic route of tBu-L-Glu NCA
1.4 氨基酸聚合物的合成
1.4.1 聚L-賴氨酸的合成 以Boc-L-Lys NCA 為單體,LiHMDS 為引發劑,在手套箱里進行快速聚L-賴氨酸(PLL)的聚合反應,步驟如圖3 所示。稱量Boc-L-Lys NCA(40.8 mg,0.15 mmol)放入干燥的10 mL反應瓶中,向瓶中加入0.1 mol/L LiHMDS 的THF 溶液(0.3 mL,0.03 mmol),調節單體濃度為0.1 mol/L,薄層層析(TLC)板監測反應結束后,滴加甲酸淬滅反應。用THF-石油醚沉淀體系,重復溶解-沉淀-離心過程3 次,抽真空干燥后得到了一系列側鏈帶Boc 保護的PLL 均聚物。Boc 保護基團用三氟乙酸(CF3COOH)脫除,再采用甲醇-無水乙醚沉淀體系,通過重復溶解-沉淀-離心過程3 次得到用于提高蛋白穩定性的脫保護的PLL 均聚物。

圖4 聚L-谷氨酸的合成路線Fig.4 Synthetic route of PLG
1.4.2 聚L-谷氨酸的合成 以tBu-L-Glu NCA 為單體,LiHMDS 為引發劑,在手套箱里進行快速聚L-谷氨酸(PLG)的聚合反應,步驟如圖4 所示。稱量tBu-L-Glu NCA (103.15 mg,0.45 mmol)放入干燥的10 mL反應瓶中,向瓶中加入0.1 mol/L LiHMDS 的THF 溶液(0.45 mL,0.045 mmol),調節單體濃度為0.1 mol/L,TLC 板監測反應結束后,滴加甲酸淬滅反應。采用THF-石油醚沉淀體系,重復溶解-沉淀-離心過程3 次,抽真空干燥后得到了一系列側鏈帶tBu 保護的PLG 均聚物。tBu 保護基團用CF3COOH 脫除,再采用甲醇-無水乙醚沉淀體系,通過重復溶解-沉淀-離心過程3 次得到用于提高蛋白穩定性的脫保護的PLG 均聚物。
1.5 氨基酸聚合物共混后在凍干條件下保護蛋白效果測試

1.6 細胞毒性測試

1.7 溶血測試

2 結果與討論
2.1 聚合物的表征
聚合物的GPC 表征結果如表1 所示。通過GPC 表征的數均分子量(Mn)可以計算聚合度(DP)。由表1 可知PLL 的分散性指數(?)為1.18,分子量分布較為均一,聚合度為19;PLG 的分散性指數為1.23,聚合度為22。聚合反應結束后,取少量反應液在反應瓶中并加入對叔丁基芐胺繼續反應12 h 進行封端,用于核磁表征,結果如圖5 所示。通過苯上的氫確定均聚物的聚合度,PLL 和PLG 經對叔丁基芐胺封端后,由NMR 表征的聚合度分別為18 和23(表1),與GPC 表征的結果相差不大,符合陰離子活性聚合的基本特征,且所得聚合物結構參數與單體投料比一致。
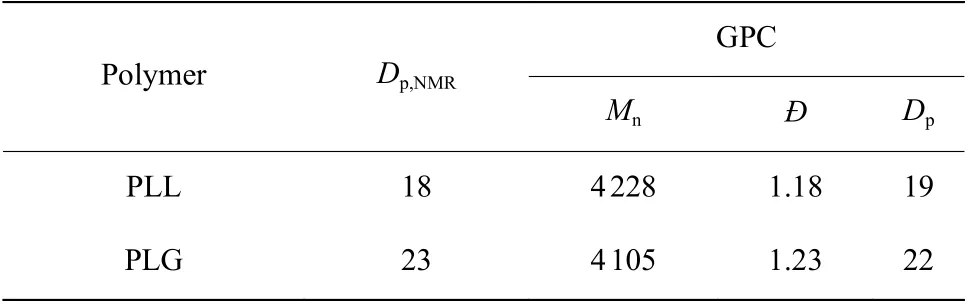
表1 PLL 和PLG 在側鏈被保護狀態下的1H-NMR 和GPC 表征結果Table 1 1H-NMR and GPC characterization results of PLL and PLG at the sidechain protected stage
2.2 氨基酸聚合物在凍干條件下保護蛋白效果分析
以保存在4°C 未被凍干破壞的新鮮的蛋白活性作為初始活性(100%),分別測試了PLL 與PLG(質量濃度均為1.33 mg/mL)以不同質量分數共混后的共混物(以x%PLL+y%PLG 表示,x%,y%分別表示PLL 和PLG 的質量分數)在凍干條件下對蛋白的保護效果,結果如圖6 所示。不同質量分數的PLL 與PLG 共混對蛋白的保護效果不同,隨著PLG 質量分數的增加,保護效果逐漸增強。未被保護的β-Gal 蛋白在經歷冷凍循環后活性只剩下38%,20% PLL 與80% PLG 共混后,蛋白活性明顯提升至77%,活性提高了39%,保護效果非常明顯。有文獻報道[5,27-28],蛋白的凍干包括冷凍和干燥兩個過程,在冷凍過程中,蛋白的pH 會發生改變,此時氨基酸類聚合物可以與蛋白周圍的水結合,來維持蛋白的三維構象。當蛋白被干燥時,氨基酸聚合物可以替代水分子,與蛋白表面的殘基相互作用,進而維持其結構。蛋白表面有很多帶電荷的殘基,選用帶正電荷的PLL 與帶負電荷的PLG 以不同質量比進行共混,也可以平衡蛋白表面的電荷。
2.3 氨基酸聚合物對顯色劑的影響
采用酶標儀對蛋白與顯色劑結合后的顯色產物進行β-Gal 的活性檢測。為了排除氨基酸聚合物與顯色劑反應對結果可能造成的干擾,將聚合物與顯色劑混合,在暗處孵育后,在相應的波長處測試吸光度值,根據1.5 節公式計算出相應的顯色劑活性,結果如圖7 所示,結果表明PLL 與PLG 的共混液不與顯色劑ONPG 反應,可以確定顯色劑僅僅顯示蛋白的活性。
2.4 氨基酸聚合物的細胞毒性
PLL 與PLG 共混液對成纖維細胞NIH 3T3 和人臍靜脈內皮細胞(HUVEC)的細胞毒性如圖8 所示。由圖可知,當PLL 的質量分數不高于50%時,共混液中NIH 3T3 和HUVEC 的細胞存活率都維持在80%以上,隨著PLL 質量分數的增加,毒性總體上有所升高,細胞存活率有所下降,說明在PLL 的質量分數不高于50%時,PLL 與PLG 共混液作為一種蛋白保護劑可應用于對體內蛋白的保護。
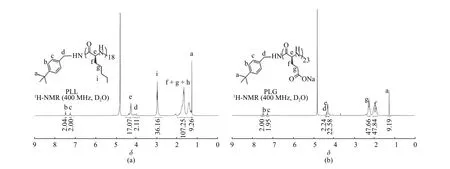
圖5 對叔丁基芐胺封端的PLL(a)和PLG(b)在脫保護狀態下的核磁共振氫譜圖Fig.5 1H-NMR spectra of PLL (a) and PLG (b) on 4-tert-butylbenzylamine terminal functionalization at the deprotected stage
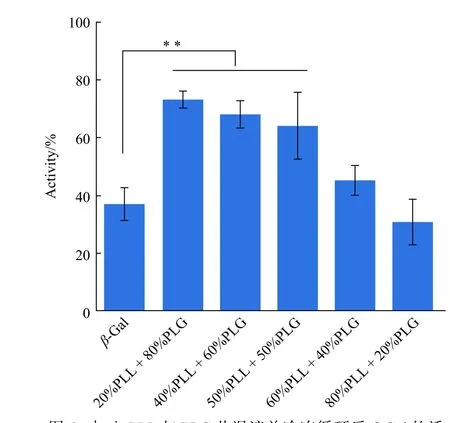
圖6 加入PLL 與PLG 共混液并冷凍循環后β-Gal 的活性(每個樣品重復3 次,**: p < 0.01)Fig.6 Activity of β-Gal added PLL and PLG blending following lyophilization (n=3 for all samples, **: p< 0.01)

圖7 PLL 與PLG 共混液對ONPG 的反應活性Fig.7 Reaction activity of PLL and PLG blending for ONPG
2.5 氨基酸聚合物的溶血活性
溶血活性是檢測蛋白保護劑生物相容性的指標,溶血活性值過高將被限制用于體內。PLL 與PLG 共混液對人血紅細胞的溶血活性如圖9 所示。當PLL 的質量分數小于50%時,共混液對人血紅細胞沒有明顯的溶血活性,當PLL 的質量分數大于50%時,有部分人血紅細胞被破壞。這個結果也與細胞毒性的測試結果相符。說明當PLL質量分數小于50%時,PLL 與PLG 共混液適合作為蛋白的保護劑。
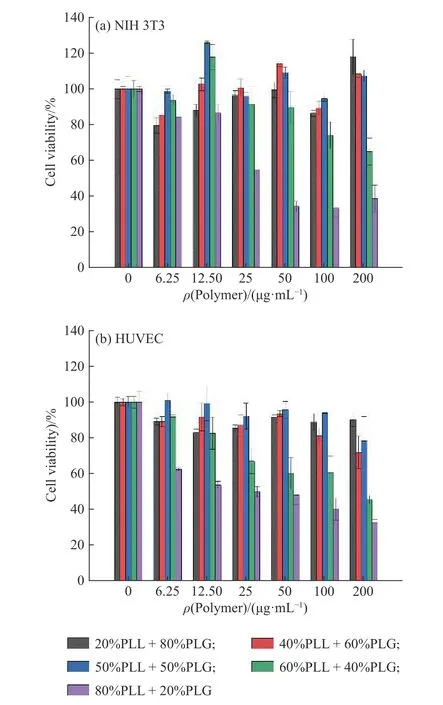
圖8 PLL 與PLG 共混液對NIH 3T3 成纖維細胞(a)和對HUVEC(b)細胞毒性的影響Fig.8 Influence of PLL and PLG blending on NIH 3T3 fibroblast cells cytotoxicity (a) and HUVEC cytotoxicity (b)
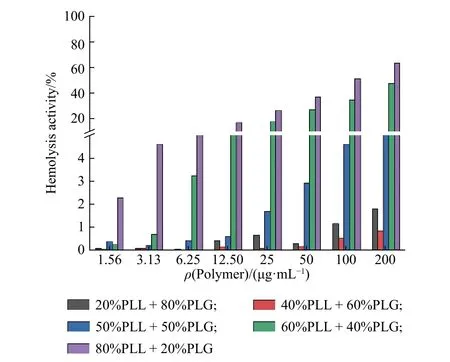
圖9 PLL 與PLG 共混液對人血紅細胞的溶血活性Fig.9 Hemolysis activity of PLL and PLG blending for human red blood cell
3 結 論
(1)以LiHMDS 為引發劑,將Boc-L-LysNCA和tBu-L-Glu NCA 兩種單體進行開環聚合,聚合反應可在10 min 之內完成。
(2)PLL 與PLG 的共混液對凍干過程中的β-Gal有很好的保護效果,20%PLL-80% PLG 共混液保護下凍干后的蛋白活性(77%)與未加保護劑時的蛋白活性(38%)相比提高約1 倍。
(3)PLL 與PLG 的共混液對NIH 3T3 成纖維細胞和HUVEC 細胞具有低毒性,對人血紅細胞具有低溶血活性,表明其可用作體內的蛋白保護劑。

