非酒精性脂肪性肝炎患者血清成纖維細胞生長因子-21和脂聯素水平變化及其臨床意義探討*
陳麗麗,符茂雄,劉正金,方其超,張 茂
流行病學研究[1,2]發現,隨著社會經濟生活水平的提高和人們生活方式的轉變,非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)在全球范圍內的發病率呈逐年遞增趨勢,嚴重影響患者身體健康及生活質量。目前,對NASH的發病機制尚不清楚。有關文獻[3,4]指出,成纖維細胞生長因子-21(fibroblast growth factor 21,FGF21)作為內源性調節物質代謝因子,可由肝臟分泌,參與胰島素分泌的調控和糖脂代謝。脂聯素(adiponectin,APN)作為胰島素增敏劑,可促進骨骼肌細胞的脂肪酸氧化和糖吸收,明顯加強胰島素抑制糖原異生的作用,進而可抑制肝臟的糖生成,是聯系代謝紊亂性疾病與心血管疾病的樞紐。相關研究[5]發現,NASH患者胰島素敏感性降低。本研究探討了NASH患者血清FGF21和APN水平的變化,以期為臨床診治提供參考依據。
1 資料與方法
1.1 一般資料 2018年7月~2019年8月我院就診的NASH患者41例,男28例,女13例;年齡45~68歲,平均年齡為(56.75±5.01)歲。符合《非酒精性脂肪性肝病診療指南》[6]中關于NASH的診斷標準,均經影像學檢查顯示呈彌漫性脂肪性肝炎,未接受過任何藥物治療。排除標準:由其他原因引起的肝炎,如病毒性肝炎、藥物性肝損傷、肝豆狀核變性等;近期進行過放化療;使用免疫抑制劑、抗生素等藥物治療;凝血功能異常;⑥伴有嚴重的感染性或血液性疾病;具有嚴重的過敏史;精神異常;哺乳期和妊娠期婦女。另選擇41例同期健康人群作為對照組,男25例,女16例;年齡47~65歲,平均年齡為(55.25±4.01)歲。兩組性別和年齡比較,差異無統計學意義(P>0.05),具有可比性。所有受試者簽署知情同意書,本研究經我院醫學倫理委員會審核同意開展。
1.2 肝活檢 根據肝組織病理學檢查結果,將NASH分為輕度、中度和重度。
1.3 臨床檢測 采用葡萄糖氧化酶法檢測空腹血糖(fasting blood glucose,FBG)水平;采用化學發光法檢測空腹胰島素(fasting insulin,FINS)水平。應用公式計算穩態模型胰島素抵抗(homeostasis model insulin resistance,HOMA-IR)指數,即HOMA-IR=(FBG×FINS)/22.5,所用試劑盒均購自美國貝克曼庫爾特有限公司;采用ELISA法檢測血清FGF21水平;采用放射免疫法檢測血清APN水平。
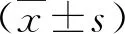
2 結果
2.1 兩組血清指標水平比較 NASH患者血清FGF21、FBG和FINS水平均顯著高于,而血清APN和HOMA-IR水平顯著低于健康人,差異具有統計學意義(P<0.05,表1)。
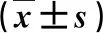
表1 兩組血清指標比較
2.2 不同程度NASH患者血清指標比較 重度NASH患者血清FGF21、FBG和FINS水平均顯著高于中度組和輕度組,而血清APN和HOMA-IR水平均顯著低于中度組和輕度組,差異具有統計學意義(P<0.05,表2)。
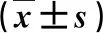
表2 不同程度NASH患者血清指標比較
2.3 存在與無合并癥的NASH患者血清指標比較 本組合并有高血壓、糖尿病或/和高脂血癥的NASH患者血清FGF21、FBG和FINS水平均顯著高于,而血清APN和HOMA-IR水平均顯著低于無合并癥者,差異具有統計學意義(P<0.05,表3)。

表3 有與無合并癥的NASH患者血清指標比較
3 討論
NASH是以彌漫性肝實質細胞脂肪蓄積、變性、壞死以及炎性細胞浸潤為特征的一種臨床綜合征,該病嚴重威脅我國居民的身體健康[7,8]。研究[9,10]發現,當NASH發生時,患者會出現胰島素抵抗。FGF21主要在脂肪細胞和肝組織表達,可作為判斷NASH發展進程的重要指標。APN作為聯系代謝紊亂性疾病與心血管疾病的樞紐,可明顯改善患者肝臟和脂肪組織胰島素抵抗。因此,本研究通過檢測血清FGF21和APN及胰島素抵抗在NASH和同期健康人群的水平變化,以期為臨床預防和控制NASH的發生發展提供依據。
多項研究[11-13]報道,NASH的發生與患者肥胖和血脂水平關系密切,主要體現在,多數NASH患者均有不同程度的體質量超標現象,且當NASH發生時,易導致患者體內糖脂代謝出現異常變化。也有學者[14,15]指出,NASH患者會出現胰島素抵抗等表現,從而可導致患者發生肝源性糖尿病,導致血糖水平異常升高。本研究結果發現,NASH患者FBG和FINS水平均顯著高于同期健康人群,HOMA-IR顯著低于同期健康人群,分析得出以上結果的原因在于,NASH患者與健康人群相比,其細胞膜上的胰島素受體敏感性下降,細胞內糖代謝的能力下降,肝細胞脂肪變性,脂肪分解代謝減弱,導致脂肪在NASH患者體內積聚[16-18],從而使得患者FBG和FINS水平呈現不同程度的升高,HOMA-IR呈現不同程度的下降。
相關文獻[19,20]指出,FGF21是一種新近發現的脂肪細胞因子,主要在肝臟和脂肪細胞中表達,可參與NASH患者糖脂代謝及胰島素分泌調控。當出現NASH時,血清FGF21水平異常升高;APN可反映NASH患者肝臟胰島素抵抗情況。當NASH發生時,血清APN水平異常降低。本研究結果與上述研究結果相似,NASH患者血清FGF21水平顯著高于健康人群,血清APN水平顯著低于健康人群,提示當NASH發生時,患者體內血清FGF21水平異常升高,而血清APN水平異常降低。也有學者指出,FGF21參與胰高血糖素誘導的脂肪分解。當NASH發生時,能激活并誘導FGF21在肝臟中的表達,使得FGF21水平在患者血清中異常升高;在出現NASH時,患者體內的腺苷酸活化蛋白激酶受到抑制,導致NASH患者糖脂代謝出現異常,從而抑制葡萄糖利用和脂肪酸氧化,導致脂肪組織異常分泌APN,使其在NASH患者血清水平異常升高。此外,本研究通過比較不同程度病情的NASH患者及合并與未合并高脂血癥的NASH患者血清FGF21、APN及FBG、FINS和HOMA-IR水平發現,重度NASH組患者血清FGF21顯著高于中度組和輕度組,血清APN和HOMA-IR水平均顯著低于中度組和輕度組,中度組NASH患者血清FGF21水平顯著高于輕度組,血清APN及FBG、FINS和HOMA-IR水平均顯著低于輕度組,在合并有高血壓、糖尿病和高脂血癥等疾病的NASH患者血清FGF21、FBG和FINS水平均顯著高于未合并者,血清APN和HOMA-IR水平均顯著低于未合并者,說明合并有高血壓、糖尿病和高脂血癥的NASH患者及嚴重的NASH患者體內血清FGF21水平顯著升高,而血清APN和HOMA-IR水平顯著降低。分析原因在于合并有高血壓、糖尿病和高脂血癥等疾病的NASH患者發病時,其肝臟多種酶的生物學活性下降。當患者肝臟多種酶的生物學活性下降時,易導致NASH患者肝細胞出現脂肪變性,肝細胞再生功能受到抑制,使得肝細胞脂代謝減慢,增加了肝臟脂肪的蓄積,導致患者體內血脂水平異常變化,進而出現胰島素抵抗和糖脂代謝異常,導致患者胰島素分泌失調及脂肪分解異常,進一步加重病情,故NASH患者體內血清FGF21水平隨著疾病嚴重程度的加重呈升高趨勢,而血清APN和HOMA-IR水平呈降低趨勢。因此,血清FGF21和APN及胰島素抵抗水平可作為診斷NASH患者的生物標志物。
綜上所述,血清FGF21水平在伴有高脂血癥的NASH患者升高,而血清APN和胰島素抵抗水平降低,且隨著疾病嚴重程度的加重NASH患者血清FGF21水平呈升高趨勢,血清APN和胰島素抵抗水平呈降低趨勢。檢測NASH患者血清FGF21、 APN和胰島素抵抗水平,有助于評估患者病情,該結果值得臨床進一步研究。

