倒春寒脅迫與恢復對茅蒼術生長、生理及關鍵酶基因的影響
夏 蘊 巢建國* 谷 巍 盛業龍 王玉卓 惠西珂 王 凱 王圓圓
(1.南京中醫藥大學, 江蘇南京210023; 2.常州市孟河雙峰中草藥科技有限公司, 江蘇常州213000)
溫度作為環境因素之一,為影響植物抗寒凍性的重要因子[1]。當植物面臨低溫時,會通過一系列響應表現以減少低溫帶來的損傷。研究低溫對黃瓜[2]、薏苡[3]、紅蕓豆[4]等的影響,發現低溫會抑制植物、作物株高、莖粗等生長指標的增加,造成生長減緩。研究[5?7]表明,低溫下植物可溶性蛋白含有量增加,抗氧化酶活性提高,以增強抵御低溫的能力,同時,低溫也會造成植物葉綠素含有量下降,丙二醛含有量增加。另外,溫度的改變會使植物基因表達等信號轉導產生變化,低溫下平歐雜交榛葉片ChaCBF1 表達量就隨時間延長而升高[8]。可見,植物應對低溫產生的一系列變化與其抗寒抗冷能力息息相關。
蒼術Atractylodes Lancea(Thunb.) DC.作為常用中藥,在臨床和藥用價值上起到了相當重要的作用。茅山為其道地產區,近年來,低溫寒流天氣頻頻發生,對植物生長發育和產量形成造成了一定影響。而有關茅蒼術應對低溫等不良環境的研究報道較少,因此,本實驗通過模擬倒春寒期間低溫脅迫來探究茅蒼術對低溫的感應變化、基因表達變化,以期為茅蒼術抗冷性種植提供參考。
1 材料與方法
1.1 實驗材料與設計
1.1.1 試驗地信息 試驗地位于江蘇省常州市新北區雙峰中草藥基地內,地理位置為北緯32°01′28.97″,東經119°47′56.60″。本實驗于2018 年12 月28 日將收集的茅蒼術種苗(產自江蘇茅山地區),經須根修剪、多菌靈浸泡等處理后進行種植,經南京中醫藥大學中藥資源與開發教研室巢建國教授鑒定為菊科植物蒼術Atractylodes lancea(Thunb.) DC.的根莖。
1.1.2 實驗設計 待出苗后且長出5 至7 片葉片時,利用人工培養箱分別對茅蒼術幼苗進行倒春寒溫度 (10、15 ℃) 模擬,并模擬較適宜生長溫度(25 ℃) 作為對照組,每組8 盆,一盆3 株,期間給予正常水分,光照強度均為3 000 lux,光照和黑暗時間均為12 h,實驗前均在自然條件環境下生長,待脅迫結束恢復自然生長。脅迫期間觀察各溫度組種苗生長情況,記錄,進行外觀表征測定,并測定脅迫前后與恢復期如株高、莖粗、葉綠素、丙二醛等一系列生理指標,進行分析。
1.2 指標測定與方法
1.2.1 倒春寒模擬脅迫期間茅蒼術幼苗植株冷害指數統計方法 觀察并統計脅迫前后茅蒼術幼苗的外觀形態特征,計算各組冷害指數。冷害指數分級如下: 0 級為葉片無枯萎,呈現略微皺縮狀態;1 級為1~2 片葉片發黃,呈現輕微萎焉狀態;2 級為3~4 片葉片發黃,呈現輕、中度萎焉狀態;3 級為4 片以上葉片發黃,呈現中度萎焉狀態;4 級為葉片出現干枯、倒伏現象,卷曲嚴重,呈現重度萎焉狀態。參照Semeniuk[9]、李小玲等[10]研究方法,按公式冷害指數= (∑冷害級數×相應株數) / (最高級數×總株數)進行計算,∑冷害級數×相應株數為各組對應冷害級別株數之和。
1.2.2 倒春寒模擬脅迫期間茅蒼術幼苗生長指標測定方法 測定脅迫前后茅蒼術幼苗的生長指標,具體為株高(cm) 用直尺測定,莖粗(mm) 用游標卡尺測定。
1.2.3 倒春寒模擬脅迫期間茅蒼術幼苗生理指標測定方法 選取各組大小、長勢相近的植株葉片,混勻,去除葉脈,剪碎,每組3 個重復,進行以下生理指標測定: 過氧化物酶(POD) 和還原型谷胱甘肽(GSH) 含有量均采用試劑盒(北京索來寶生物科技有限公司) 進行測定,葉綠素含有量測定用乙醇法,可溶性蛋白含有量測定用考馬斯亮藍法 (其回歸方程為Y=0.000 7X+0.705),丙二醛(MDA) 含有量測定用硫代巴比妥酸法。
1.2.4 倒春寒模擬脅迫期間茅蒼術幼苗葉片關鍵酶基因測定方法 分別于脅迫期間的第5、15 天時采集茅蒼術幼苗葉片,用液氮處理后存放在-80 ℃冰箱中,采用RNA 提取試劑盒[天根生化科技(北京) 有限公司] 說明書方法提取低溫脅迫期間茅蒼術葉片的RNA,反轉錄為cDNA,最后進行PCR 熒光定量測定,反應程序為94 ℃預變性5 min,94 ℃變性30 s,62 ℃退火30 s,72 ℃延伸40 s,45個循環。根據課題組前期實驗篩選出的內參基因,利用2-ΔΔCt法(以25 ℃組為參照) 進行計算,對比不同低溫對其關鍵酶基因表達量差異,從而進行分析。qRT?PCR 引物序列見表1。

表1 qRT?PCR 引物序列
1.3 數據處理與分析 生長指標和生理生化指標均利用SPSS 22.0 進行單因素差異分析,并應用GraphPad Prism 5軟件進行圖表繪制。
2 結果與分析
2.1 倒春寒模擬脅迫期間茅蒼術幼苗植株情況 實驗前茅蒼術幼苗葉片均呈完全舒展狀態,處于正常生長期。圖1顯示,經低溫脅迫后,茅蒼術葉片均出現不同程度脫水、變軟、卷曲、皺縮和萎焉等現象,且15 ℃組葉片黃化現象比10 ℃組嚴重。據統計,至10 ℃組倒春寒模擬脅迫結束時,有50%幼苗葉片無枯萎現象,僅有略微皺縮,有25%幼苗葉片表現出輕中度萎焉,僅有12.5%幼苗葉片出現輕微萎焉和重度萎焉表現,其冷害指數為0.281。至15 ℃組倒春寒模擬脅迫結束時,12.5% 植株有輕微黃葉,但無明顯枯萎情況,25%植株出現個別黃葉,呈現輕微、中度萎焉狀態,僅有12.5%植株出現葉片皺縮、卷曲嚴重,呈重度萎焉狀態,還伴有倒伏現象,其冷害指數為0.438。

圖1 倒春寒低溫脅迫對茅蒼術外觀形態的影響
2.2 倒春寒模擬脅迫前后茅蒼術幼苗生長情況 圖2 顯示,通過對比倒春寒模擬脅迫前后的茅蒼術生長速率表現,發現各組株高、莖粗生長速率有所差異。15 ℃組茅蒼術株高、莖粗生長速率和25 ℃組無明顯差異,而10 ℃組茅蒼術株高、莖粗生長速率明顯下降,且與15、25 ℃組均呈顯著性差異。表明15 ℃處理下茅蒼術仍能維持正常生長,而10 ℃處理下茅蒼術株高、莖粗生長受到一定抑制,生長減緩。
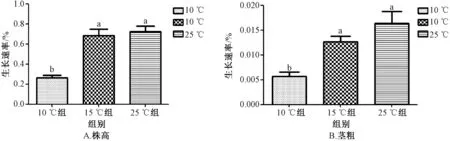
圖2 倒春寒低溫脅迫對茅蒼術株高、莖粗的影響
2.3 生理生化指標測定
2.3.1 葉綠素總量測定 圖3 顯示,無論是倒春寒脅迫后期還是恢復期階段,10 ℃組和25 ℃組葉綠素含有量均呈不斷增加趨勢,而15 ℃組則呈先上升后下降趨勢。經脅迫后,15 ℃組增加明顯,與25 ℃組比較增加了5.740%,但無顯著性差異;與10 ℃組比較增加了16.216%,有顯著性差異。而后恢復正常生長發現,10 ℃組和15 ℃組同期葉綠素含有量均低于25 ℃組,比較25 ℃組,10 ℃組降低了13.012%,15 ℃組降低了14.760%,且2 組均與其呈顯著性差異。
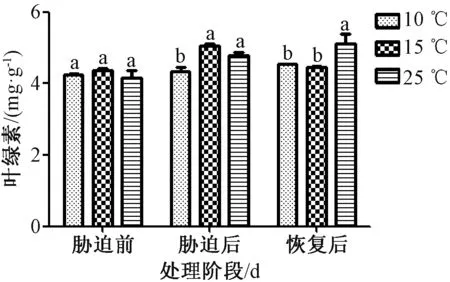
圖3 倒春寒低溫脅迫對茅蒼術葉綠素總量的影響
2.3.2 丙二醛含有量測定 圖4 顯示,三組丙二醛含有量變化趨勢各不相同。10 ℃組呈持續上升情況,15 ℃組表現為先上升后下降趨勢,25 ℃組則為先降后升情況。經低溫脅迫后,發現15 ℃組丙二醛含有量大大增加,同期約為25 ℃組的4 倍多,且與25 ℃組有顯著性差異,而10 ℃組丙二醛含有量雖然也有所上升,但與25 ℃組不呈顯著性差異。經過恢復后,發現10 ℃組和25 ℃組丙二醛含有量仍有增加,而15 ℃組丙二醛含有量有所回落,但15 ℃組仍高于10、25 ℃組,同比為10 ℃組的40.759%,同比為25 ℃組的28.919%,且與其他2 組均呈顯著性差異。

圖4 倒春寒低溫脅迫對茅蒼術丙二醛含有量的影響
2.3.3 過氧化物酶(POD) 活性測定 圖5 顯示,25 ℃組POD 活性為先降后升趨勢,而10、15 ℃組均為先上升后下降趨勢。經脅迫后發現,10 ℃組與25、10 ℃組與15 ℃組均呈顯著性差異,與25 ℃組比較,10 ℃組同期增加了43.678%,與15 ℃組比較,10 ℃組同期降低24.902%;同時,15 ℃組與25 ℃組呈極顯著性差異,與其比較,同期增加了79.456%。經恢復后可見,15 ℃組POD 含有量雖然有所下降,但仍與10 ℃組呈顯著性差異,與25 ℃組呈極顯著性差異。

圖5 倒春寒低溫脅迫對茅蒼術POD 活性的影響
2.3.4 還原型谷胱甘肽(GSH) 含有量測定 圖6 顯示,10、15 ℃組GSH 含有量始終呈上升趨勢,而25 ℃組呈先下降后上升趨勢。經脅迫后發現,10 ℃組與25 ℃組呈顯著性差異,與25 ℃組比較,10 ℃組同期增加了61.750%,15 ℃組與25 ℃組呈極顯著性差異,與其比較,同期增加了244.057%。經恢復后可見,15 ℃組仍然呈增加走勢,并與10 ℃組呈顯著性差異,與25 ℃組呈極顯著性差異。

圖6 倒春寒低溫脅迫對茅蒼術GSH 含有量的影響
2.3.5 可溶性蛋白質含有量測定 圖7 顯示,10、25 ℃組可溶性蛋白質含有量均為先降低后上升趨勢,而15 ℃組則是先增加后下降情況。經脅迫后發現,15 ℃組可溶性蛋白質含有量大幅增加,且與10、25 ℃組均有顯著性差異,同比10 ℃組增加了111.581%,同比25 ℃組增加了85.661%。而后經過短暫恢復后可見,10 ℃組和25 ℃組可溶性蛋白質含有量都有所上升,15 ℃組則有所降低,此時15 ℃組和25 ℃組差異不明顯,但其與10 ℃組有顯著性差異。

圖7 倒春寒低溫脅迫對茅蒼術可溶性蛋白質含有量的影響
2.4 倒春寒低溫脅迫對茅蒼術葉片關鍵酶基因表達量的影響 圖8A 顯示,經脅迫5 d 后,25 ℃組法尼基焦磷酸合酶(FPPS) 基因表達量大幅上調,而10 ℃組和15 ℃組FPPS基因表達量均有所下降。表明低溫會使茅蒼術葉片FPPS基因表達受到抑制。而后經15 d 脅迫后,25 ℃組FPPS基因表達量變幅不大,15 ℃組FPPS基因表達量仍呈持續下降趨勢,10 ℃組則有所回升。圖8B 顯示,經5 d 脅迫后,3組3?羥基?3?甲基戊二酸單酰輔酶A 還原酶(HMGR) 基因表達量均為上升情況,其中10 ℃組增幅明顯,表明低溫使茅蒼術葉片HMGR基因表達上調,而后經15 d 脅迫后,與25 ℃組比較,10、15 ℃組HMGR基因表達量均有所下降,表明HMGR基因與脅迫時間有緊密聯系。

圖8 倒春寒低溫脅迫對茅蒼術葉片關鍵酶基因表達量的影響
3 討論
本實驗中,與25 ℃組比較,15 ℃組茅蒼術幼苗初期受冷影響表現不明顯,只有少數植株有輕微冷害和重度冷害表現。而10 ℃組幼苗受冷害影響較明顯,表明溫度越低,受冷害程度越明顯。結果表明溫度越低,茅蒼術萎焉、發黃越嚴重[11?12]。可見,葉片受冷程度表現可作為評判植物冷害程度最直觀的依據。植物的生長情況一定程度上可反映其對周遭環境的適應性,以及自身抗性的強弱程度。本實驗中,10 ℃、15 ℃組茅蒼術幼苗相對25 ℃組而言,株高、莖粗生長速率均有所下降,且溫度越低,其生長速率受抑制越顯著,表明低溫確實會使植物生長受到一定抑制[13?14]。但目前低溫對藥用植物生長的影響研究和報道甚少,其結論和作用機理還需進一步研究、考證。
溫度為影響植物體內光合色素變化的主要因素之一,當植物遇到逆境時,其葉綠素含有量會作出相應變化[15?16]。本實驗中,經低溫脅迫后,15 ℃組葉綠素含有量高于25 ℃組,而10 ℃組則低于25 ℃組,可能與低溫下植物體內葉綠素合成受阻有關,推測在15 ℃處理下,茅蒼術體內葉綠素合成還未達到抑制溫度[17?18],但與歐俊梅等[19]研究結果是相反的,表明不同植物應對低溫時,其葉綠素總量響應變化各異。
丙二醛是評價植物應對逆境時的受損程度和體現自身抗性的主要指標[20]。本實驗中,當遭受低溫脅迫后,2 低溫組丙二醛含有量相較25 ℃組均有所增加,并隨溫度下降而降低。表明低溫對茅蒼術幼苗造成了一定傷害,同時,丙二醛含有量隨溫度降低而下降,可能與植株的承受范圍有關,也可能與細胞膜內代謝體系暫時性失衡有關[21?23]。經恢復后,各組丙二醛含有量有所降低,但15 ℃組仍處于較高水平,表明溫度越高,對茅蒼術傷害越大,但其可通過自身調節以恢復至正常水平。
低溫下,植物會產生一系列活性氧等有害物質,此時,通過調節體內抗氧化酶活性來減少氧化損傷[24]。本實驗中,當茅蒼術感受低溫時,其POD 活性和GSH 含有量均有所上升,表明茅蒼術對低溫有一定的耐受力和抗性,POD和GSH 兩者在抵御低溫時起到了重要作用[25]。同時,較25 ℃組而言,溫度越低,其POD 活性和GSH 含有量增幅也隨之減少,表明隨著溫度的降低,其酶活力會逐漸受到抑制,在一定程度上可通過調節酶活性來增強其抗性[26]。
可溶性蛋白質為維持植物滲透平衡的重要調節物質之一,其具有一定保水能力。本實驗中,不管是低溫脅迫后還是經恢復生長后,與25 ℃組比較,15 ℃組可溶性蛋白質含有量大大增加,而10 ℃組則有所下降,表明溫度與可溶性蛋白質含有量呈正相關,表明茅蒼術可承受10 ℃以上溫度,隨著溫度的降低,其保水能力也逐漸減弱。在一定范圍內,可溶性蛋白質含有量的升高,推測與新蛋白質或抗冷性蛋白質合成有關[27?28]。也有研究[29]表明可溶性蛋白質也可反映植株抗性的強弱,關于其對低溫的響應變化機制仍需深入研究。
據悉,FPPS 和HMGR 是三萜類成分合成的限速酶[30]。本實驗中,低溫脅迫初期時,茅蒼術葉片中FPPS 表達量均有所下調,且溫度越低,下調越明顯,表明茅蒼術葉片FPPS 表達量受抑制程度與溫度有緊密聯系[31]。隨著低溫的延長,10 ℃組FPPS 表達量又有所回升,推測與脅迫程度不斷加重有關,具體原因有待探究。本實驗中,茅蒼術葉片HMGR 表達量經低溫脅迫均為先升后降趨勢,且溫度越低,表現越明顯,在一定范圍內,茅蒼術葉片HMGR 表達量受低溫影響而上調,隨后下降,可能與其脅迫程度和抗冷能力有關[32]。
總體而言,低溫下茅蒼術出現萎焉、變薄等現象且生長遲緩,葉片黃化,低溫對其造成一定傷害。但茅蒼術仍可通過提高酶活系統,調節可溶性蛋白質含有量,協調FPPS、HMGR基因共同作用來抵御低溫,具有一定耐冷性。

