注射用重組抗腫瘤壞死因子-α人鼠嵌合單克隆抗體病毒去除/滅活工藝的建立及效果驗證
邵順儒 楊冬芝 侯盛
摘要:旨在建立注射用重組抗腫瘤壞死因子-α人鼠嵌合單克隆抗體病毒去除/滅活工藝,并進行效果驗證。膜過濾工藝去除病毒驗證結果表明,膜過濾后的蛋白質回收率在98%以上,分子排阻色譜純度在膜過濾前后沒有明顯變化;經測試,膜過濾后小鼠白血病病毒、小鼠微小病毒、呼腸孤病毒滴度的降幅均大于4 lg TCID50/0.1 mL。低pH值孵放滅活病毒驗證工藝結果表明,低pH值孵放前后蛋白質含量、分子排阻色譜純度沒有明顯變化;測試結果表明,室溫處理時間≥0.5 h,小鼠白血病病毒、偽狂犬病毒的滴度降幅均大于4 lg TCID50/0.1 mL。該去除/滅活效果均符合《生物組織提取制品和真核細胞表達制品的病毒安全性評價技術審評一般原則》的要求,建立的工藝有效保證了產品的質量及安全性。
關鍵詞:注射用重組抗腫瘤壞死因子-α人鼠嵌合單克隆抗體;膜過濾病毒去除;低pH值孵放病毒滅活;分子排阻色譜純度;蛋白質回收率;半數組織培養感染劑量
中圖分類號:R915 ?文獻標志碼: A ?文章編號:1002-1302(2020)15-0077-06
根據《藥品注冊管理辦法》要求,對于動物源性單克隆抗體重組生物制品,在工藝上要進行病毒去除/滅活驗證。按病毒去除/滅活[1-2]方式的不同,清除病毒的方法可分為膜過濾法[3]、色譜法[4-5]、超短時微波加熱法、巴氏消毒法、干熱法、有機溶劑/去污劑(S/D)法和低pH值孵放法[6]。《生物組織提取制品和真核細胞表達制品的病毒安全性評價技術審評一般原則》(下文簡稱《一般原則》)中要求,驗證研究的目的是為了獲取充足的試驗研究數據以證明生產工藝中是否包含有效的病毒去除/滅活工藝步驟。《一般原則》要求生產工藝中必須包含病毒去除/滅活的有效工藝步驟,若不包含,則應根據不同品種的特點增加相應的處理方法,并不得改變制品原有的質量。對于從生物組織中提取制成的生物制品,在工藝上應有2個有效工藝步驟從機制上進行互補,對于非脂包膜病毒,應不少于1個工藝有效步驟有效去除和/或滅活作用;對于通過真核細胞表達的生物制品,要求至少有一個工藝有效步驟,能夠有效去除和/或滅活非脂包膜病毒[7]。對于低pH值病毒滅活工藝,非特異模型病毒建議選擇有包膜的、對理化條件耐受能力強且耐受范圍廣的病毒種類,如偽狂犬病病毒;對于納米膜的過濾工藝,建議選擇粒徑小的病毒種類,如鼠細小病毒。另外,對病毒去除/滅活的驗證要注意工藝過程對樣品質量的影響。應考察在工藝處理前后,純度、蛋白質含量、蛋白質回收率等的差異或變化能否確保產品符合質量標準規定。只有在確保工藝處理前后上述質量指標的差異或變化不明顯,才能認為設定的病毒去除/滅活工藝條件是有效的。在工藝驗證中,應采用大生產工藝參數中的最差條件在小試生產規模下進行。如在開展低pH值法滅活病毒驗證時,采用實際生產pH值、蛋白含量標準規定的最高限與溫度范圍最低限。在進行膜過濾去除病毒的效果驗證時,采用實際生產壓力和上樣量范圍的上限[8]。按照《一般原則》規定,本試驗建立了注射用重組抗腫瘤壞死因子-α人鼠嵌合單克隆抗體(簡稱“注射用壞死因子抗體”)膜過濾病毒去除工藝和低pH值孵放病毒滅活工藝,前者選取小鼠白血病病毒、小鼠微小病毒、呼腸孤病毒作為指示病毒,后者選取小鼠白血病病毒、偽狂犬病毒作為指示病毒,分別進行去除/滅活工藝驗證,本試驗結果可為該單抗制品的病毒安全性研究提供參考。
1 材料與方法
1.1 病毒及細胞
小鼠白血病病毒起始滴度為6.750 lg TCID50/0.1 mL(其中TCID50表示半數組織培養感染劑量),用貓星形膠質細胞進行培養;小鼠微小病毒的起始滴度為6.875 lg TCID50/0.1 mL,用小鼠皮下結締組織細胞進行培養;呼腸孤病毒的起始滴度為 7.250 lg TCID50/0.1 mL,用幼倉鼠腎細胞進行培養;偽狂犬病毒的起始滴度為 6.875 lg TCID50/0.1 mL,用豬腎細胞進行培養。上述病毒及細胞均由中國食品藥品檢定研究院保存。
1.2 注射用壞死因子抗體
該注射用壞死因子抗體樣品由泰州邁博太科藥業有限公司制備,其中納米膜過濾病毒去除工藝所用注射用壞死因子抗體樣品為純化工藝中通過疏水層析收集的樣品,批號分別為008-201702、008-201703、008-201704。pH值法滅活病毒工藝所用樣品為親和層析收集的樣品,批號分別為 cCC-20170311、cCC-20170321、008-201704。
1.3 膜過濾病毒去除工藝的建立及驗證
1.3.1 膜過濾病毒去除工藝的建立 預過濾膜(型號為Viresolve Prefilter)和除病毒過濾膜(型號為Viresolve Pro)均購自美國Millipore公司。取純化工藝中疏水層析收集批號分別為008-201702、008-201703、008-201704的樣品,每批分別經過Viresolve Prefilter預過濾和Viresolve Pro除病毒過濾膜(除病毒過濾膜面積為3.1 cm2,過濾壓力為220 kPa)過濾,每個病毒、每批樣品的體積均在 280 mL 以上。
1.3.2 分子排阻色譜純度、蛋白質回收率的檢測 考察膜過濾去除病毒工藝對過濾前后樣品分子排阻色譜純度、蛋白質總量的影響。取膜過濾前后的樣品,用高效液相色譜(HPLC)方法檢測分子排阻色譜純度,根據膜過濾前后的總蛋白質量計算蛋白質的回收率。
1.3.3 膜過濾病毒去除工藝的效果驗證
1.3.3.1 病毒的滴定 (1)選用小鼠白血病病毒為指示病毒。將貓星形膠質細胞以6×104個/mL的密度加入96孔細胞培養板中,每孔0.1 mL;在 37 ℃ 培養箱中培養 24 h,設二氧化碳含量為5%,待細胞鋪滿后,將各對照及處理后的樣品進行連續稀釋,稀釋倍數為10-1~10-11;在細胞培養板的第1列至第11列加入稀釋10-1~10-11倍的病毒 0.1 mL/孔;在第12列加入細胞培養基,作為細胞對照;將上述培養板放進溫度為37 ℃、含5% CO2的培養箱內,每天觀察、記錄病變細胞數(孔),直至細胞對照孔內的細胞無法維持正常形態,采用96孔細胞病變法進行病毒滴定,按Karber法計算小鼠白血病病毒滴度。(2)選用小鼠微小病毒作為指示病毒。培養用細胞為小鼠皮下結締組織細胞,采用與小鼠白血病病毒同樣的方法計算小鼠微小病毒滴度。(3)選用呼腸孤病毒作為指示病毒。培養用細胞為幼倉鼠腎細胞,采用與小鼠白血病病毒相同的方法計算呼腸孤病毒滴度。
1.3.3.2 病毒去除效果的驗證 取批號為 008-201702、008-201703、008-201704的純化工藝中疏水層析收集的樣品各280 mL以上,分別進行預過濾,取預過濾后的樣品按照2%的比例加入指示病毒,混勻,采用設置的膜去除病毒工藝過濾上樣液,分別在膜過濾體積為200、240 mL及過濾終點取樣,進行殘余病毒滴度的檢測,檢測方法同小鼠白血病病毒。每種指示病毒均用每批上樣液測試2次。
1.4 低pH值孵放法病毒滅活工藝的建立及驗證
1.4.1 病毒滅活工藝的建立 采用親和層析收集樣品,批號分別為cCC-20170311、cCC-20170321、008-201704,每批樣品分別用25 mmol/L檸檬酸酸鹽(pH值為2.8~3.2)或1 mol/L Tris-base調節pH值至3.8,于18 ℃放置4 h后分別于0.5、1.0、2.0、4.0 h取樣,用1 mol/L Tris-base調節pH值至中性。
1.4.2 滅活病毒的工藝對分子排阻色譜純度、蛋白質含量影響的檢測 取低pH值孵放前后的樣品,用HPLC方法檢測分子排阻色譜純度,再通過紫外分光光度法檢測蛋白質含量。
1.4.3 滅活病毒的工藝效果驗證
1.4.3.1 病毒的滴定 選用小鼠白血病病毒、偽狂犬病毒作為指示病毒,小鼠白血病病毒用貓星形膠質細胞培養,偽狂犬病毒用豬腎細胞培養,具體方法同“1.3.3”節,分別滴定并計算小鼠白血病病毒及偽狂犬病毒的滴度。
1.4.3.2 病毒滅活效果的驗證 各取5 mL cCC-20170311、cCC-20170321、008-201704親和層析收集的樣品,用1 mol/L Tris-base調節pH值至中性,制備對照樣品。取1.96 mL細胞培養基,加入0.04 mL病毒,使病毒的最終占比為2%,制備病毒對照樣品。各取5 mL cCC-20170311、cCC-20170321、008-201704親和層析收集的樣品,用 1 mol/L Tris-base調節pH值至中性,按照2%的比例分別加入0.102 mL指示病毒(小鼠白血病病毒、偽狂犬病毒),混勻后除菌過濾,取出2 mL并凍存于-70 ℃環境下,作為零點對照樣品;再取出2 mL并于 18 ℃ 放置4 h,凍存于-70 ℃環境下,作為終點對照樣品。
各取20 mL cCC-20170311、cCC-20170321、008-201704親和層析收集的樣品,每批分別用 25 mmol/L 檸檬酸鹽(pH值為2.8~3.2)或 1 mol/L Tris-base調節pH值至3.8,按照2%的比例分別加入0.408 mL指示病毒(小鼠白血病病毒、偽狂犬病毒)混勻,于18 ℃放置4 h,分別于0.5、1.0、2.0、4.0 h取樣,用1 mol/L Tris-base調節pH值至中性,除菌過濾后作為處理后樣品。樣品對照、病毒對照、零點對照、終點對照及處理后樣品在處理結束后立即凍存于-70 ℃下,樣品滴定時于室溫復溶。具體方法同“1.3.3”節,分別滴定并計算小鼠白血病病毒及偽狂犬病毒的滴度,每種指示病毒均用每批的上樣液測試2次。
2 結果與分析
2.1 病毒去除工藝的建立及驗證
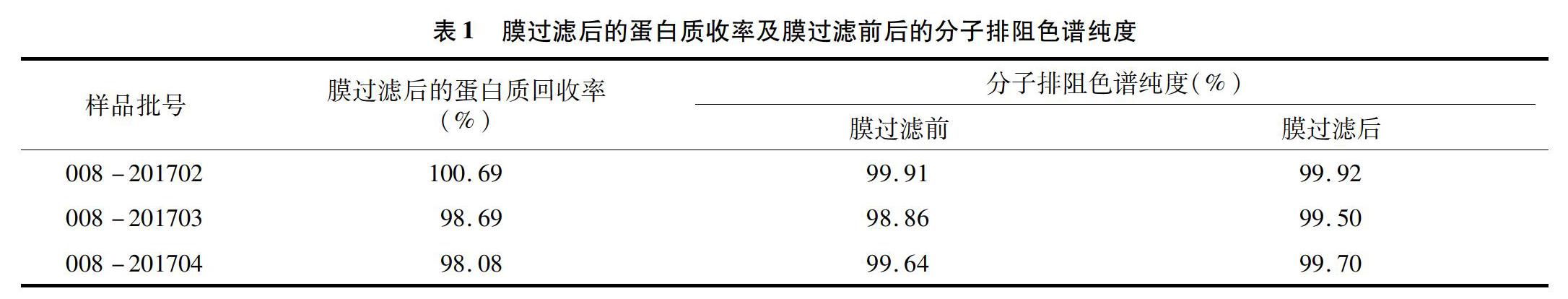
2.1.1 膜過濾對蛋白質回收率及分子排阻色譜純度的影響 由表1可以看出,膜過濾去除病毒工藝處理的蛋白質回收率均在98%以上,膜過濾前后分子排阻色譜純度均在98%以上,表明膜過濾后回收率較高,膜過濾對純度基本無影響,采用膜過濾法去除病毒的工藝是可行的。
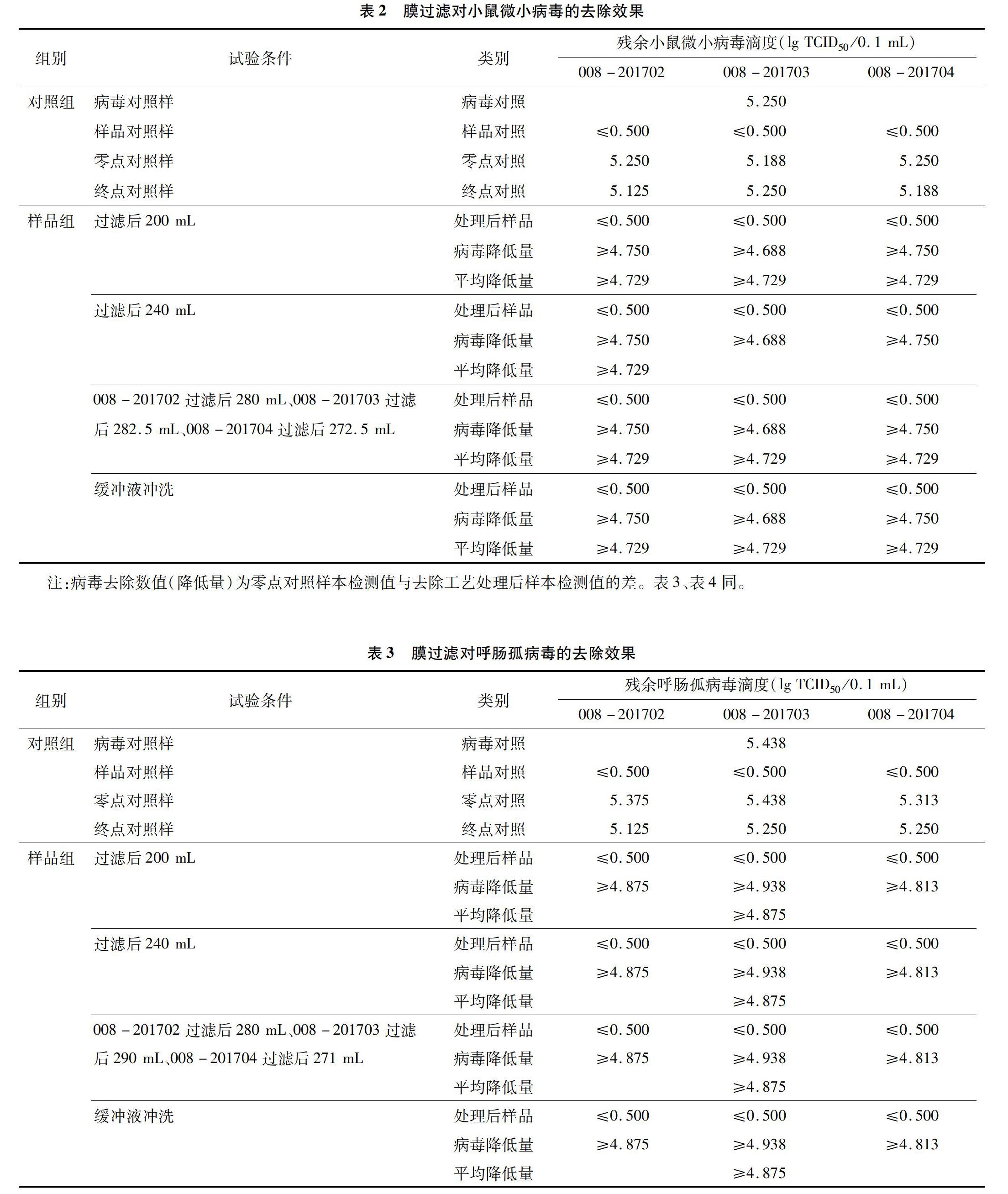
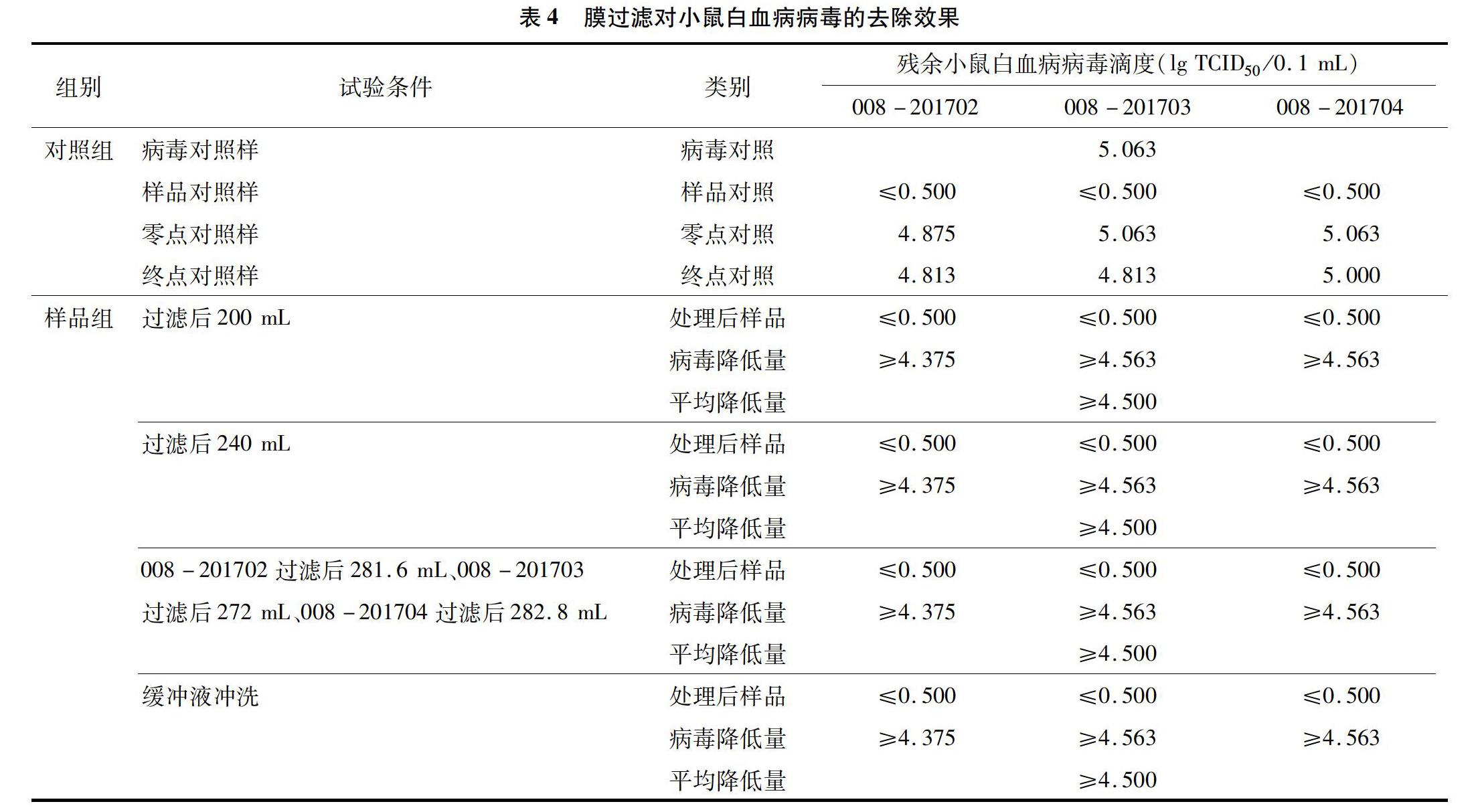
由表2可以看出,當濾出液體積達280 mL(008-201702)、282.5 mL(008-201703)、272.5 mL(008-201704)時,樣品的小鼠微小病毒下降滴度分別為4.750、4.688、4.750 lg TCID50/0.1 mL,均>4 lg TCID50/0.1 mL。由表3可以看出,當濾出液體積達280 mL(008-201702)、290 mL(008-201703)、271 mL(008-201704)時,樣品的呼腸孤病毒下降滴度分別為4.875、4.938、4.813 lg TCID50/0.1 mL,均>4 lg TCID50/0.1 mL。由表4可以看出,當濾出液體積達281.6 mL(008-201702)、272 mL(008-201703)、282.8 mL(008-201704)時,樣品的小鼠白血病病毒下降滴度分別為4.375、4.563、4.563 lg TCID50/0.1mL,均>4 lg TCID50/0.1 mL,過濾后的樣品符合《一般原則》的要求,表明該工藝可有效去除病毒。
2.2 病毒滅活工藝的建立及驗證
2.2.1 低pH值孵放對蛋白質含量及分子排阻色譜純度的影響 從表5可看出,低pH值孵放在病毒滅活前后對樣品蛋白質含量及純度均無明顯影響。
2.2.2 低pH值孵放病毒滅活工藝效果的驗證結果 從表6可以看出,指示病毒小鼠白血病病毒經低pH值孵放滅活0.5 h后,cCC-20170311、cCC-20170321、008-201704的小鼠白血病病毒下降滴度分別達4.438、4.563、4.375 lg TCID50/0.1 mL,均>4 lg TCID50/0.1 mL。由表7可以看出,指示病毒偽狂犬病毒經低pH值孵放滅活0.5 h后,cCC-20170311、cCC-20170321、008-201704的偽狂犬病毒下降滴度分別達4.875、4.938、4.750 lg TCID50/0.1 mL,均≥4 lgTCID50/0.1 mL,隨著處理時間的延長,指示病毒小鼠白血病病毒、偽狂犬病毒的下降滴度不再改變,均≥4 lg TCID50/0.1 mL,符合《一般原則》的要求,表明該工藝可有效滅活病毒。
3 討論與結論
在建立去除病毒的工藝中,應考察預過濾膜(型號為Viresolve Prefilter)和除病毒過濾膜(型號為Viresolve Pro)對上樣液中病毒的去除效果、過濾時的壓力、恒壓載量試驗,分析該過濾膜在完全堵塞前所能過濾的最大上樣體積。本試驗初步設定了如下除病毒的工藝參數:預過濾膜型號為Viresolve Prefilter,除病毒過濾膜型號為Viresolve Pro,壓力為220 kPa。試驗結果表明,采用膜過濾工藝去除病毒符合工藝需求,該去除病毒工藝的方法可行。膜過濾去除病毒的效果驗證試驗結果表明,除病毒過濾膜(Viresolve Pro)的孔徑為20 nm,選擇的指示病毒小鼠微小病毒粒徑為20~26 nm,可見小鼠微小病毒對去除病毒效果具有有效的指示作用。用3批注射用壞死因子抗體樣品進行病毒去除工藝驗證,結果表明,至濾出終點時,小鼠微小病毒的滴度下降值均 >4 lg TCID50/0.1 mL, 符合《一般原則》的要求,證明膜過濾工藝可有效去除小鼠微小病毒,此外,注射用壞死因子抗體最大上樣液過濾體積可以達到270 mL,能夠滿足實際生產需要。
本試驗結果還表明,用低pH值(3.8)處理親和層析收集樣品生產工藝對產品的蛋白質含量及分子排阻色譜純度均不會產生影響。將3批親和層析收集的樣品用于滅活病毒的工藝驗證,結果顯示,在pH值為3.8、室溫為18 ℃的條件下處理0.5 h,指示病毒小鼠白血病病毒、偽狂犬病毒滴度下降值均>4 lg TCID50/0.1 mL,符合《一般原則》的要求,表明該pH值法在生產過程中可有效滅活病毒。
在單克隆抗體的生產工藝中,可依據蛋白質產物與病毒顆粒大小的不同,利用膜過濾工藝有效去除病毒,在生產中使用一次性除病毒膜包,每次使用后進行完整性測試。該方法已經在國內外多種生物制品的生產中得到了廣泛運用[9]。只有病毒的有效直徑大于濾膜的孔徑,膜過濾法才能有效截留病毒,達到去除病毒的目的,這種方法須要與前文所述方法[1]聯合使用才能起到有效去除/滅活病毒的作用。低pH值孵放法是破壞病毒包膜的完整性、阻斷病毒與宿主受體結合的途徑,使病毒無法感染宿主細胞[10-11],起到滅活病毒的作用。低pH值孵放法具有方法簡單、經濟實惠、容易操作等特點,已被用于偽狂犬病毒[10]、豬細小病毒[12]、流感病毒[13]等病毒的滅活。
去除/滅活病毒的理想方法有2個特性:可以部分去除病毒或者破壞病毒的活性和結構,維持生物制品的生物活性、理化性質。病毒去除/滅活工藝的驗證研究是為了取得充分的試驗數據,確認去除/滅活病毒的工藝步驟是否有效。驗證的單克隆抗體應至少包含1個有效的病毒去除/滅活工藝步驟,并能有效去除和/或滅活非脂包膜病毒。對本試驗樣品進行病毒去除/滅活工藝驗證結果表明,經過膜過濾,蛋白質回收率符合規定,分子排阻色譜純度沒有明顯變化;用低pH值處理后,蛋白質含量、分子排阻色譜純度無明顯變化。在去除/滅活病毒的驗證工藝中,選用的小鼠白血病病毒、小鼠微小病毒、呼腸孤病毒、偽狂犬病毒這4個病毒的理化性質(病毒的大小、核酸類型、有無包膜)有代表性,本試驗結果顯示,經去除或滅活后,小鼠白血病病毒、小鼠微小病毒、呼腸孤病毒、偽狂犬病毒這4種病毒的滴度下降值均達到了規定的標準(>4 lg TCID50/0.1 mL),證明本試驗建立的注射用壞死因子抗體病毒去除/滅活工藝所用方法是有效的。
參考文獻:
[1]王軍志. 生物技術藥物研究開發和質量控制[M]. 2版. 北京:科學出版社,2007:237-258.
[2]Roush D J. Integrated viral clearance strategies-reflecting on the present,projecting to the future[J]. Current Opinion in Biotechnology,2018,53:137-143.
[3]Singh N,Arunkumar A,Peck M,et al. Development of adsorptive hybrid filters to enable two-step purification of biologics[J]. Mabs-Austin,2017,9(2):350-363.
[4]Chiang M J,Pagkaliwangan M,Lute S,et al. Validation and optimization of viral clearance in a downstream continuous chromatography setting[J]. Biotechnology and Bioengineering,2019,116(9):2292-2302.
[5]Angelo J,Chollangi S,Müller-Spth T,et al. Virus clearance validation across continuous capture chromatography[J]. Biotechnology and Bioengineering,2019,116(9):2275-2284.
[6]David L,Bayer M P,Lobedann M,et al. Simulation of continuous low pH viral inactivation inside a coiled flow inverter[J]. Biotechnology and Bioengineering,2020,117(4):1048-1062.
[7]國家食品藥品監督管理局藥品審評中心. 生物組織提取制品和真核細胞表達制品的病毒安全性評價技術審評一般原則[S]. 2005
[8]韋 薇,徐隆昌,白 玉,等. 重組表達生物制品病毒安全性研究與評價的考慮[J]. 中國新藥雜志,2019,28(16):1964-1968.
[9]鄭豐平,王 炳,鄭 琪,等. DV50納米過濾去除靜注人免疫球蛋白中的病毒時流速的影響因素[J]. 中國生物制品學雜志,2012,25(12):1712-1713,1718.
[10]Johnston A,Uren E,Johnston D,et al. Low pH,caprylate incubation as a second viral inactivation step in the manufacture of albumin parametric and validation studies[J]. Biologicals,2003,31(3):213-221.
[11]Buchacher A,Iberer G. Purification of intravenous immunoglobulin G from human plasma-aspects of yield and virus safety[J]. Biotechnology Journal,2006,1(2):148-163.
[12]Lebing W,Remington K M,Schreiner C,et al. Properties of a new intravenous immuneoglobulin (IGIV-C,10%) produced by virus inactivation with caprylate and column chromatography[J]. Vox Sanguinis,2003,84(3):193-201.
[13]Jeong E K,Sung H M,Kim I S. Inactivation and removal of influenza A virus H1N1 during the manufacture of plasma derivatives[J]. Biologicals,2010,38(6):652-657.

