降解展青霉素的乳酸菌的篩選鑒定及其降解特性研究
鄭香峰,陳夕飛,孫 琰,魏皖寧,楊振泉
(揚州大學食品科學與工程學院,江蘇揚州 225127)
展青霉素又稱棒曲霉素,是由曲霉屬、青霉屬、絲衣霉屬等屬內多種真菌代謝產生的次級代謝產物[1-2]。最初,文獻報道展青霉素是一種潛在的廣譜抗生素[3],能抑制超過75種不同的細菌。但之后的研究發現,展青霉素不僅抑制細菌,其對真菌、高等植物、動物等也均表現出一定的毒性。展青霉素是一種對人體具有嚴重危害的真菌毒素,可引起機體的多種毒性,包括急性毒性、慢性毒性和細胞毒性[4-5]。
鑒于展青霉素的毒性,許多國家和地區對食品中展青霉素含量施行了限量標準。根據我國相關標準規定,蘋果、山楂及其制成的飲料、酒類產品中展青霉素最大限量為50 μg/kg[6]。但是,展青霉素易溶于水并在酸性條件下穩定,且易從水果腐爛組織轉移到健康組織中,而去掉腐爛組織的水果又常被用作生產果汁、果醬等產品[7-8],從而造成展青霉素在上述產品中的殘留和污染[8-9]。因此,展青霉素在食品中的污染較為嚴重,其防治至關重要。
展青霉素的防治主要有物理方法、化學方法和生物方法。物理方法是指通過物理手段減少水果在貯藏期間感染致病霉菌的風險或降低展青霉素的含量,其主要手段有人工采選、沖洗、冷藏等[9-10]。但是,物理方法需要大量的人力物力,且容易導致展青霉素進入環境。化學方法主要使用咪鮮胺、抑霉唑、噻菌靈、克菌丹、臭氧等化學殺菌劑來處理。但是化學試劑處理會造成藥劑殘留、食品品質的破壞,且有些化學試劑的安全性尚不明確[9]。生物方法是指使用微生物的拮抗作用抑制毒素的產生或者通過自身的降解作用將已經產生的展青霉素進行脫毒的方法。Zheng等[11]研究了Pichiacaribbica酵母對培養基中的展青霉素的降解作用。在7 d之內,Pichiacaribbica將濃度為60 μg/mL的展青霉素被完全降解。進一步研究發現,酵母的胞內酶和胞外酶是降解展青霉素的主要物質[11-12]。另外一些研究發現酵母細胞壁上的多糖和蛋白質在降解展青霉素的過程中也發揮了重要作用[13-14]。目前,已有許多酵母生物降解展青霉素的報道[15-16]。有研究表明乳酸菌對展青霉素具有一定的去除能力。Hatab等[17]發現了一株鼠李糖乳桿菌,該乳桿菌的活菌和死菌對展青霉素的去除率分別達到了51.1%和52%,推斷鼠李糖乳桿菌主要通過菌體表面的吸附作用去除展青霉素。2013年,Hawar等[18]發現乳酸菌可以將展青霉素降解為hydroascladiol,但具體作用機制不明。乳酸菌降解展青霉素的研究相對較少,已發現的能夠去清除展青霉素的乳酸菌種類或菌株數量有限,亟需篩選一批對展青霉素降解能力強的乳酸菌并研究其降解機理。乳酸菌對人體健康具有多種益生功效,篩選可高效降解展青霉素的乳酸菌并研究其降解展青霉素的機理對食品中展青霉素的防治有重要實用價值。
本研究將從傳統發酵食品青海泡菜中分離得到的2株乳酸菌中篩選能夠高效降解展青霉素的菌株,并對其進行形態學和分子生物學鑒定,分別研究其活菌、胞內物質、胞外代謝物及細胞壁對展青霉素的降解作用,探究該菌株對展青霉素的降解特性。
1 材料與方法
1.1 材料與儀器
乳酸菌菌株 2株,分離自青海泡菜;葡萄糖、蛋白胨、無水乙酸鈉、檸檬酸三銨、磷酸氫二鉀、硫酸鎂、硫酸錳、吐溫-80、牛肉膏、酵母膏、瓊脂、磷酸二氫鈉、磷酸氫二鈉、氯化鈉 國藥集團化學試劑有限公司;甲醇(色譜純,Tedia)、乙腈(色譜純,Tedia) 揚州華明儀器設備有限公司;展青霉素標準品(純度≥99%,CAS:149-29-1,產品編號:MSS1021) 青島普瑞邦生物工程有限公司。
HC-2066離心機 安徽中科中佳科學儀器有限公司;ZEALWAY高壓滅菌鍋 致微(廈門)儀器有限公司;BSA223S-CW天平 賽多利斯科學儀器(北京)有限公司;GNP-9270BS-Ⅲ隔水式恒溫培養箱 上海新苗醫療器械制造有限公司;SW-CJ-1F無菌工作臺 蘇州凈化設備有限公司;(ZORBAX SB-C18,4.6×50 mm,5 um)色譜柱、1260安捷倫高效液相色譜儀 安捷倫科技有限公司;VCX150PB超聲破碎儀 美國索尼克斯公司。
1.2 實驗方法
1.2.1 菌株的培養與篩選 菌株活化:將實驗室中冷凍保存的兩株乳酸菌接種至MRS固體培養基。在37 ℃培養箱中培養24~48 h,待長出單菌落,挑取單菌落至新鮮MRS液體培養基,37 ℃培養箱中培養24~48 h,至對數期。清除展青霉素能力的測定:將2株活化好的乳酸菌按2%接種量分別接入新鮮MRS培養基,并添加10.9 μg/mL的展青霉素,放置于37 ℃培養箱,每隔24 h取樣,測定樣品中剩余的展青霉素含量,篩選對展青霉素具有較強降解作用的菌株。
1.2.2 展青霉素的含量測定 將10 mg展青霉素標準品完全溶解于10 mL甲醇中,使用0.22 μm微孔濾膜過濾后,貯存在-20 ℃,得到濃度為10 mg/mL的展青霉素貯存液,根據后續工作需要配制相應濃度的展青霉素工作液。采用高效液相色譜(High Performance Liquid Chromatography,HPLC)測定展青霉素的含量。展青霉素的檢測參考Zheng等[11]的方法,檢測條件為:流動相10%乙腈,流速1 mL/min,進樣量為20 μL,檢測波長為276 nm。所有樣品檢測前均經過0.22 μm膜過濾。配制濃度為0、0.2、0.4、0.6、0.8、1、5、10、15 μg/mL的展青霉素標準品。利用HPLC對其進行檢測,展青霉素標準品峰保留時間在6.4 min。以不同濃度展青霉素標準品的保留峰面積與濃度梯度的對應關系建立標準曲線,得到標準曲線方程為y=77.282x-10.217(R2=0.9997)(y為峰面積,x為展青霉素濃度)。
1.2.3 降解展青霉素的乳酸菌的鑒定
1.2.3.1 降解展青霉素的乳酸菌的16S rDNA測序 乳酸菌活化后,送至上海生工生物公司對乳酸菌的16S rDNA進行測序,所用測序引物為通用引物27F/1492R。
1.2.3.2 乳酸菌分類鑒定 將測序得到的乳酸菌16S rDNA序列,在NCBI數據庫利用Blast在線比對軟件進行相似性比對,得到與其同源的菌株及它們的16S rDNA序列。利用MEAG7.0構建乳酸菌的16S rDNA的進化樹,從而確定乳酸菌的進化分類地位。
1.2.4 乳酸菌活菌清除展青霉素能力的測定 將活化好的YZU02菌株以2%接種量接種至新鮮MRS液體培養基中,其中添加終濃度為10.9 μg/mL的展青霉素標準品。只添加終濃度為10.9 μg/mL展青霉素的MRS液體培養基作為對照,標記為CK。上述2組樣品放入37 ℃培養箱中培養。在0、9、18、27、36、45、54、63 h時取樣,樣品經0.22 μm濾膜過濾后,利用高效液相色譜法測定展青霉素含量。每個處理設置3個重復,實驗重復2次。
1.2.5 乳酸菌胞內物質清除展青霉素能力的測定 參考Zheng等[19]的方法,研究乳酸菌胞內物質對展青霉素的降解作用。將活化好的L.plantarumYZU02以2%接種量分別接種至新鮮5 mL MRS液體培養基,以及含有終濃度為10.9 μg/mL的展青霉素的5 mL MRS液體培養基,分別記為L.plantarumYZU02、L.plantarumYZU02+Patulin。上述樣品置于37 ℃培養箱中培養36 h后,將培養物收集至10 mL離心管,在10000 r/min轉速下離心5 min,棄上清,取沉淀,加入5 mL磷酸鹽緩沖液(PBS),懸浮清洗菌體。然后10000 r/min離心2 min,棄去上清。再往菌體中添加5 mL PBS,進行超聲破碎(300 W,間隔2 s,工作4 s,300次)。超聲結束后10000 r/min離心5 min,收集上清,得到胞內物質溶液。添加展青霉素至上述胞內物溶液使其終濃度為10.9 μg/mL,只添加終濃度為10.9 μg/mL展青霉素的PBS緩沖液作為對照,標記為CK。置于37 ℃培養箱培養,每隔9 h取樣,經高效液相色譜測定展青霉素含量。每個處理設置3個重復,實驗重復2次。
1.2.6 乳酸菌胞外代謝物清除展青霉素能力的測定 參考Zheng等[19]的方法,研究乳酸菌胞外代謝物對展青霉素的清除能力。取活化好的菌液按2%接種量接種到含有5 mL MRS培養基的離心管,同時添加展青霉素至終濃度為10.9 μg/mL,轉移至37 ℃培養箱中,培養9 h后,取樣留作檢測展青霉素含量,剩余樣品繼續培養至12 h。12 h時取出樣品并收集到已滅菌的10 mL離心管,經10000 r/min離心5 min,棄菌體,取培養液。培養液經0.22 μm濾膜過濾除菌后,重新放置到37 ℃培養箱中繼續培養。每隔9 h取樣,檢測展青霉素含量。以只含有10.9 μg/mL展青霉素的MRS培養液作為對照,標記為CK。每個處理設置3個重復,實驗重復2次。
1.2.7 細胞壁清除展青霉素能力的測定 參考Zheng等[19]的方法,研究乳酸菌細胞壁對展青霉素的吸附作用。取活化好的菌液按2%接種量接種到含有5 mL MRS培養基的離心管,置于37 ℃培養箱中恒溫培養48 h。收集菌液至已滅菌的10 mL離心管,經10000 r/min離心5 min,棄上清留菌體。菌體用4 mL PBS懸浮,并通過100 ℃高溫加熱10 min致死處理。致死后的樣品中用PBS定容至5 mL,同時添加終濃度為10.9 μg/mL的展青霉素,置于37 ℃培養箱中培養,每隔9 h取樣,利用高效液相色譜測定展青霉素含量。只添加終濃度為10.9 μg/mL展青霉素的PBS緩沖液作為對照,標記為CK。每個處理設置3個重復,實驗重復2次。
1.3 數據處理
所有數據均平行測定3次,數據進行t檢驗取平均值±標準差表示,所有數據用SPSS 20.0軟件進行分析,顯著性采用ANOVA進行鄧肯氏多重差異分析,P<0.05表示差異顯著。
2 結果與分析
2.1 清除展青霉素的乳酸菌的篩選
將YZU01、YZU02兩株乳酸菌分別接種至含有10.9 μg/mL展青霉素的MRS培養基中,每24 h檢測其中展青霉素的含量。結果如圖1所示,YZU01菌株在24 h內沒有明顯降低展青霉素含量,在48 h時將展青霉素含量由10.9 μg/mL降至6.26 μg/mL。而YZU02菌株在24 h時就將展青霉素含量降至4.5 μg/mL,對展青霉素的清除率達到58.72%。在48 h時將展青霉素的含量降低至3.1 μg/mL,對展青霉素的清除率達到71.6%。可以看出菌株YZU02對展青霉素的降解作用較強,YZU01的降解作用較弱。因此根據以上檢測結果,選擇YZU02菌株進行后續的研究。目前,利用乳酸菌清除展青霉素的研究正處于起步階段,報道的能夠清除展青霉素的乳酸菌數量較少。Topcu等[20]篩選到一株屎腸球菌,將其與濃度為1 μg/mL的展青霉素作用48 h后,展青霉素的去除率只有45.3%。Hatab等[17]篩選到一株鼠李糖乳桿菌,在24 h內只能將濃度為1 μg/mL的展青霉素含量降低51.1%。龔雪篩選到一株對展青霉素具有高效降解作用的菌株LB-11,其在24 h內對濃度為1 μg/mL的展青霉素的降解率可達到90%[21]。而本研究所使用的展青霉素濃度高達10.9 μg/mL,是上述研究中所用展青霉素濃度的10倍以上,表明YZU02對展青霉素具有高效的清除作用。
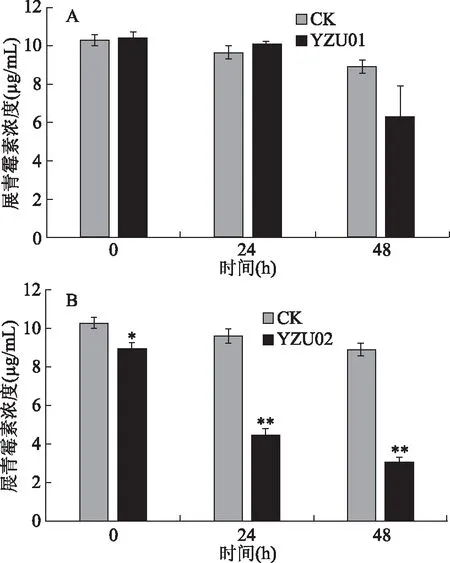
圖1 兩株乳酸菌對展青霉素的降解作用Fig.1 Patulin degradation effect of two LAB strains注:A、B:分別代表菌株YZU01、YZU02對展青霉素的降解結果;*代表與相同時間點的對照組(CK)相比差異顯著(P<0.05),**代表與相同時間點的對照組CK相比差異極其顯著(P<0.01)。
2.2 YZU02菌株的鑒定
取出-20 ℃保存的YZU02菌株,在MRS固體培養基平板上劃線,在37 ℃條件下培養48 h,菌株的生長狀況良好。如圖2A所示,YZU02菌株的菌落大小均勻,表面凸起,顏色為白色,表面濕潤,邊緣整齊,菌落呈圓形,符合乳桿菌屬菌落形態特征。利用革蘭氏染色觀察YZU02菌株,結果如圖2B所示,YZU02菌株為革蘭氏陽性菌,它的細菌形態為為桿狀,無鞭毛。對菌株YZU02的16S rDNA基因進行測序,將YZU02的16S rDNA基因序列在NCBI數據庫進行Blast比對,結果表明YZU02菌株的16S rDNA與植物乳桿菌(Lactobacillusplantarum)16S rDNA相似度高達99%。對YZU02菌株的16S rDNA的進化關系進行了分析,構建了其進化樹,結果如圖3C所示。進化樹結果表明YZU02與植物乳桿菌高度同源,處于同一進化分支。從以上可以確定,YZU02為植物乳酸桿菌,將其命名為L.plantarumYZU02。
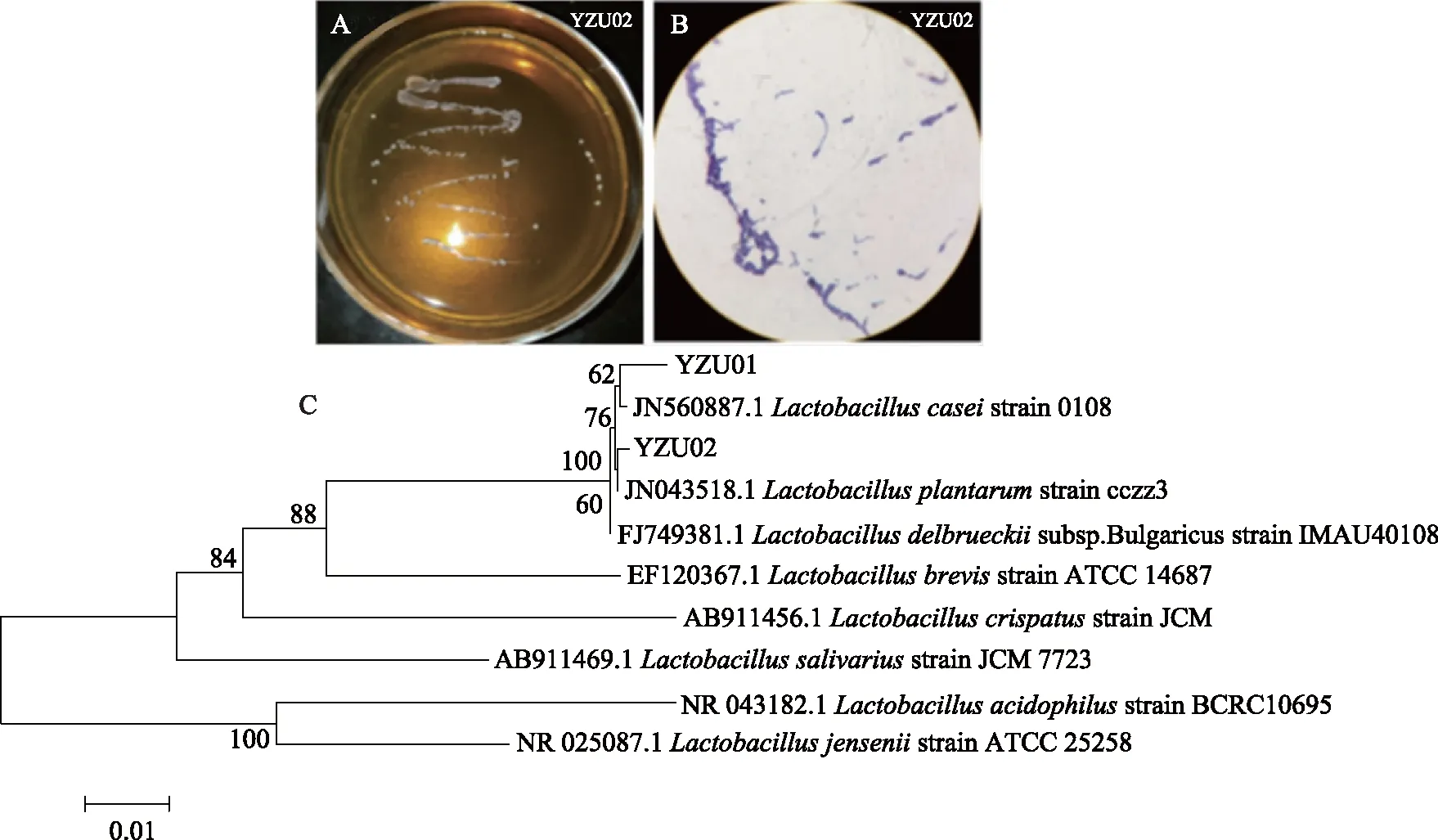
圖2 YZU02菌株的鑒定Fig.2 Identification of YZU02
2.3 L. plantarum YZU02清除展青霉素的特性研究
篩選得到的L.plantarumYZU02菌株對展青霉素有高效清除作用,但其清除特性仍不明確。目前微生物清除毒素主要有2種途徑:一種為微生物表面的吸附作用,另一種為微生物的生物降解作用[22]。確定L.plantarumYZU02菌株對展青霉素的清除作用是來自于細胞壁的吸附作用還是生物降解作用,對其后續實際應用具有重要指導意義。
2.3.1 活菌對展青霉素的清除作用 首先對L.plantarumYZU02在63 h內清除展青霉素的情況進行了跟蹤研究,結果如圖3所示。在9 h之前L.plantarumYZU02菌株處于生長遲滯期,對展青霉素的清除效果不明顯。9~18 h,乳酸菌進入對數期,隨著乳酸菌數量的增多展青霉素的含量急劇下降。到36 h時,展青霉素含量由10.87 μg/mL降至2.94 μg/mL,展青霉素清除率為72.95%。36 h后展青霉素含量變化不大,處于穩定狀態。Fuchs等[23]篩選到一株動物雙歧桿菌VM 12,培養4 h后,對濃度為1 μg/mL的展青霉素的清除率達到78%,且該動物雙歧桿菌VM 12對展青霉素的去除效率依賴于有活性的完整菌體。以上結果表明,L.plantarumYZU02活菌對展青霉素清除作用顯著。但是,展青霉素含量在18 h后降低幅度有限,處于穩定狀態。這可能與YZU02清除展青霉素的特性相關,因此后續需要對L.plantarumYZU02清除展青霉素的特性進行進一步研究。
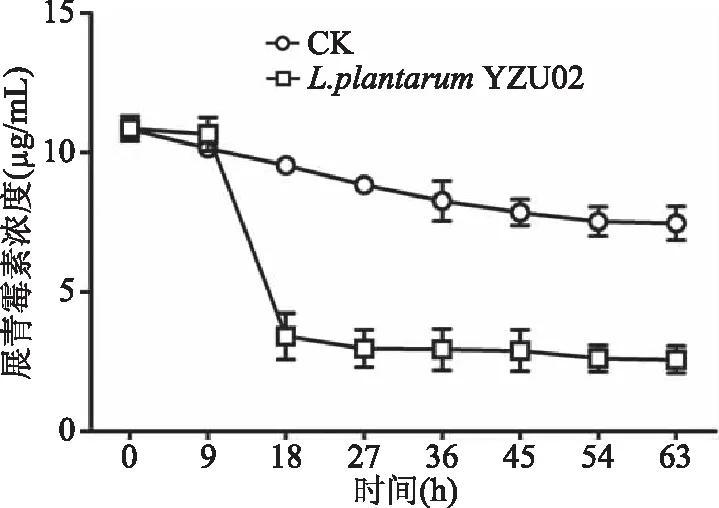
圖3 L. plantarum YZU02對展青霉素的清除作用Fig.3 Degradation of patulin by L. plantarum YZU02注:CK:對照組(只含展青霉素);L. plantarum YZU02:L. plantarum YZU02活菌+展青霉素。
2.3.2 胞內酶對展青霉素的降解作用 對L.plantarumYZU02胞內酶對展青霉素的降解作用進行了研究,分析了L.plantarumYZU02胞內酶,以及經展青霉素刺激后的胞內酶對展青霉素的降解作用。結果如圖4所示,展青霉素在不同處理、不同時間點(0、9、18、27 h)的含量均保持穩定,維持在10.9 μg/mL左右。結果說明L.plantarumYZU02的胞內酶對展青霉素幾乎沒有降解作用,且經展青霉素刺激后的L.plantarumYZU02的胞內酶同樣對展青霉素沒有降解作用。酵母菌胞內酶降解展青霉素的研究較多,比如鄭香峰等[4]研究發現卡利比克畢赤酵母對展青霉素的降解作用是在可誘導的胞內酶的作用下進行的。乳桿菌胞內酶降解真菌毒素的報道少見,Megalla等[24]篩選到一株乳酸乳球菌ATCC-11454,可以生物降解黃曲霉毒素B1,但并沒有說明是胞內酶降解。龔雪等[25]研究發現,乳桿菌LB-11可以生物降解展青霉素,但具體是什么物質負責降解展青霉素并未指明。此研究結果也表明L.plantarumYZU02對展青霉素的降解作用并非是胞內酶的降解作用。
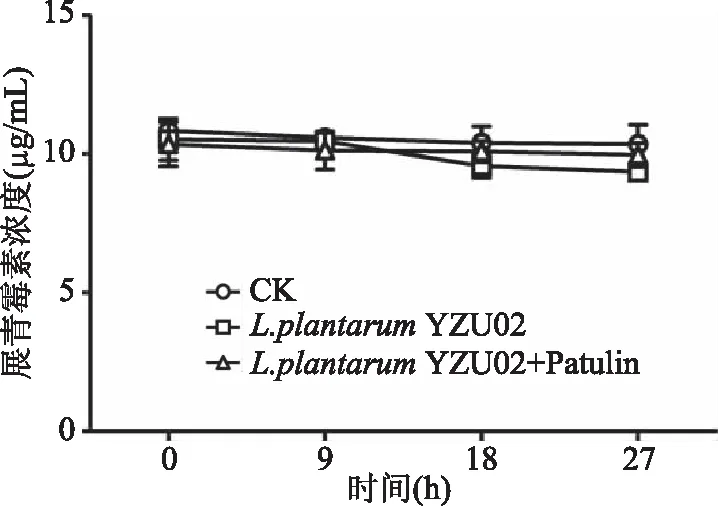
圖4 L. plantarum YZU02胞內酶對展青霉素的降解作用Fig.4 Degradation of patulin by intracellular enzymes of L. plantarum YZU02注:L. plantarum YZU02:L. plantarum YZU02的胞內酶;L. plantarum YZU02+Patulin:經展青霉素刺激后的胞內酶。
2.3.3 胞外代謝物對展青霉素的清除作用 對L.plantarumYZU02胞外代謝物對展青霉素的清除作用進行了研究。結果如圖5所示,L.plantarumYZU02的胞外代謝產物對展青霉素清除作用非常有限,在36 h后展青霉素含量仍高達7.8 μg/mL。但是,胞外代謝物處理后,展青霉素的濃度有所下降,這可能是L.plantarumYZU02胞外代謝物種存在某些成分能夠與展青霉素發生相互作用,導致展青霉素含量的下降[4]。結果可以表明L.plantarumYZU02的胞外代謝物并不能清除展青霉素。
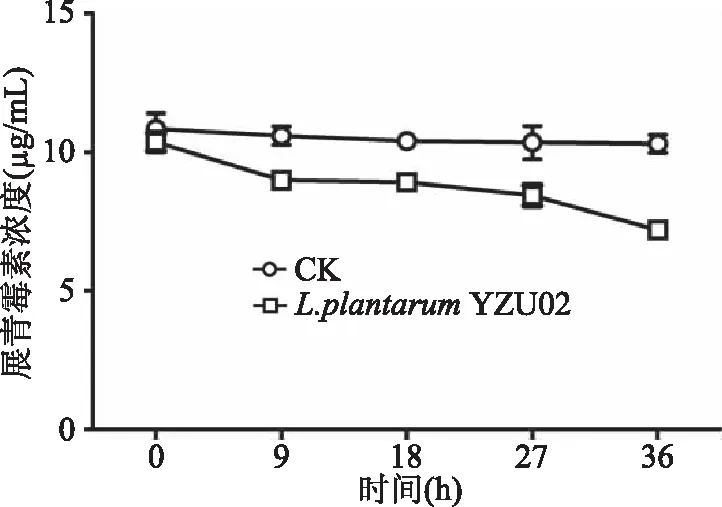
圖5 L. plantarum YZU02胞外代謝物對展青霉素的清除作用Fig.5 Degradation of patulin by extracellular metabolites of L. plantarum YZU02
2.3.4 細胞壁對展青霉素的吸附作用 有研究表明,有些乳酸菌對展青霉素的清除來自于細胞壁的吸附作用[26],因此對L.plantarumYZU02細胞壁對展青霉素的吸附作用進行了研究。結果如圖6所示,在0 h剛加入展青霉素后,展青霉素含量逐漸下降,說明L.plantarumYZU02細胞壁對展青霉素有一定的吸附作用。到18 h時,展青霉素含量降低至5.32 μg/mL,63 h后降低至的5.10 μg/mL。Shaimaa Hatab研究發現,滅活的鼠李糖乳桿菌和屎腸球菌均能通過細胞壁的吸附作用將蘋果汁中濃度為0.1 μg/mL的展青霉素在24內分別降低80.4%和64.5%。進一步研究發現乳酸菌細胞壁表面的多糖和蛋白質與細胞壁對展青霉素的吸附作用相關[27]。而這些蛋白質或多糖在細胞壁中的數量是固定的,當其吸附達到飽和時,游離展青霉素濃度便維持在穩定狀態。本研究結果也發現,展青霉素含量在18~63 h之間基本維持穩定。由以上分析可以看出L.plantarumYZU02細胞壁對展青霉素的吸附作用,是其清除展青霉素的主要途徑。
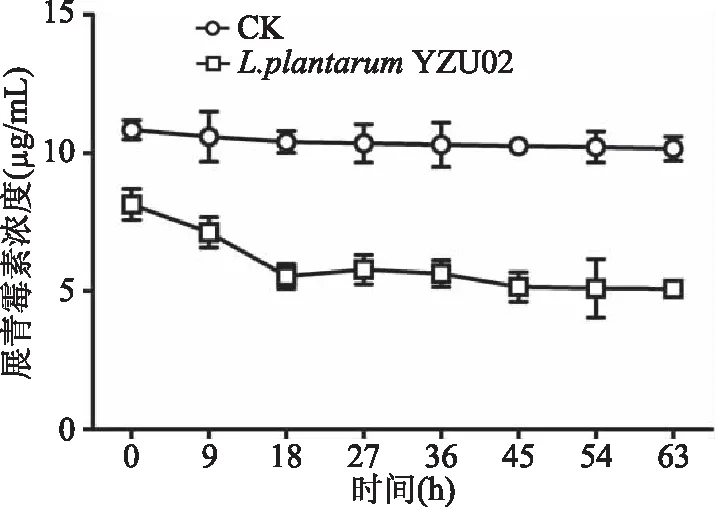
圖6 L. plantarum YZU02細胞壁對展青霉素的吸附作用Fig.6 Adsorption of patulin by cell wall of L. plantarum YZU02
3 結論與展望
綜合研究結果,得到以下結論:首先篩選出1株對展青霉素具有高效降解作用的乳酸菌,經鑒定為L.plantarumYZU02;L.plantarumYZU02的胞內酶、胞外代謝物對展青霉素沒有降解作用;L.plantarumYZU02主要通過細胞壁的吸附作用去除展青霉素。細胞壁對毒素的吸附作用是由乳酸菌的生物量決定的。因此通過增加菌的生物量可以增強其對展青霉素的去除效果。此外,可以通過與具有生物降解作用的乳桿菌制成混合菌劑達到去除食品中展青霉素污染的作用。

