重組酵母菌N6076的差異表達基因功能及甲羥戊酸代謝分析
王璇,歐科,馮光文,陳福欣,王婷,買買提熱夏提·買買提,錢衛東,毛培宏*
1(新疆大學 物理科學與技術學院 放射生態與離子束生物技術中心,新疆 烏魯木齊,830046)2(西安科技大學 化學與化工學院,陜西 西安,710054)3(陜西科技大學 食品與生物工程學院,陜西 西安,710032)
甲羥戊酸(mevalonate,MVA) 為甲羥戊酸途徑(mevalonate pathway,MVP)的中間產物,是酵母細胞代謝過程中一種重要的有機酸和合成具有高附加值的次生代謝產物的前體化合物[1-2]。甲羥戊酸激酶(mevalonate kinase,MVK)是MVA代謝中關鍵催化酶和控制整個代謝途徑的限速酶之一,也是萜類和醌類物質生物合成過程中的重要調控位點[3-5]。
在前期研究中利用低能離子注入介導藥用植物烏拉爾甘草(Glycyrrhizauralensis)基因組DNA 隨機轉化釀酒酵母菌,獲得了遺傳穩定的產萜類和醌類化合物的重組酵母菌N6076[6-7]。本文以重組菌株N6076及其原始菌株Kh08 為研究對象,通過轉錄組測序和MVA的液相色譜-串聯質譜法(liquid chromatograph-mass spectrometer/mass spectrometer,LC-MS/MS)定量測定,以期獲得2株酵母菌的差異表達基因的功能,并對MVK的表達與MVA的代謝進行關聯分析,為進一步理解酵母菌MVA的代謝及調控提供依據,為后續的外源基因在酵母菌基因組中的整合研究奠定基礎。
1 材料與方法
1.1 實驗菌株
釀酒酵母(Saccharomycescerevisiae)N6076來源于低能氮離子注入介導外源DNA隨機轉化S.cerevisiaeKh08獲得遺傳穩定的重組酵母菌,由本中心保存。
1.2 實驗方法
酵母菌株的培養基與培養方法參考文獻[8]。
用于轉錄組測序(RNA-seq)的樣本制備及其RNA-seq方法、差異表達基因的表達量及其GO功能和KEGG代謝通路分析方法均參考文獻[9-10]的方法。
酵母菌胞內MVA測定樣本的制備方法與MVA的LC-MS/MS測定方法參考文獻[8]。
2 結果與分析
2.1 差異表達基因
2株酵母菌各發酵時間點及相同發酵時間點的差異表達基因的上調和下調分析結果如圖1所示。與 0 h相比,重組菌株 N6076發酵至48和 96 h時的上調基因數量分別為 1186 和 1069個,而下調基因的數量分別為 1681和 1377個;與48 h相比,發酵至96 h時上調與下調基因數量分別為 499和291個,而原始菌株 Kh08分別為523 和588個,說明重組菌株N6076在96 h/48 h時的基因表達的總體活躍程度低于原始菌株Kh08。
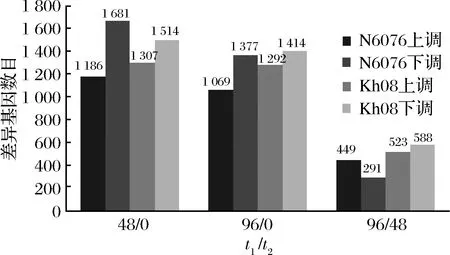
t1-處理組;t2-對照組圖1 重組酵母菌N6076 與其原始菌株Kh08不同發酵時間點的差異表達基因Fig.1 Differentially expressed genes between different time points of fermentation of recombinant yeast strain N6076 and original strain Kh08
2.2 差異表達基因的 GO 功能分析
使用GOSeq方法對2株酵母菌的差異表達基因進行GO功能分析結果表明,與原始菌株Kh08相比,重組菌株N6076差異表達基因的GO 功能中的生物學過程(biological process,BP)新增14個,缺失1個;細胞組分(cellular component,CC)新增2個,缺失1個;分子功能(molecular function,MF)新增2個,缺失1個(圖2)。重組菌株N6076新增加的14個BP功能涉及213個差異表達基因(表1),缺失的1個BP功能為NADH再生(GO:0006735),涉及9 個差異表達基因;在CC功能方面,重組菌株N6076新增了染色質沉默復合物(GO:0005677)和U6 snpRNP(GO:0005688)功能,分別涉及357和372 個差異表達基因;缺失的CC功能為Cul7環泛素連接酶復合物(GO:0031467),涉及6個差異表達基因;在MF功能方面,重組菌株N6076新增了肌動蛋白絲結合(GO:0051015)和蛋白酶活性(GO:0004291)功能,分別涉及22和176個差異表達基因,缺失了1個ATP酶活性功能(GO:0016887),涉及10個差異表達基因。

表1 重組菌株N6076新增的BP功能Table 1 New added BP functions of recombinant yeast strain N6076
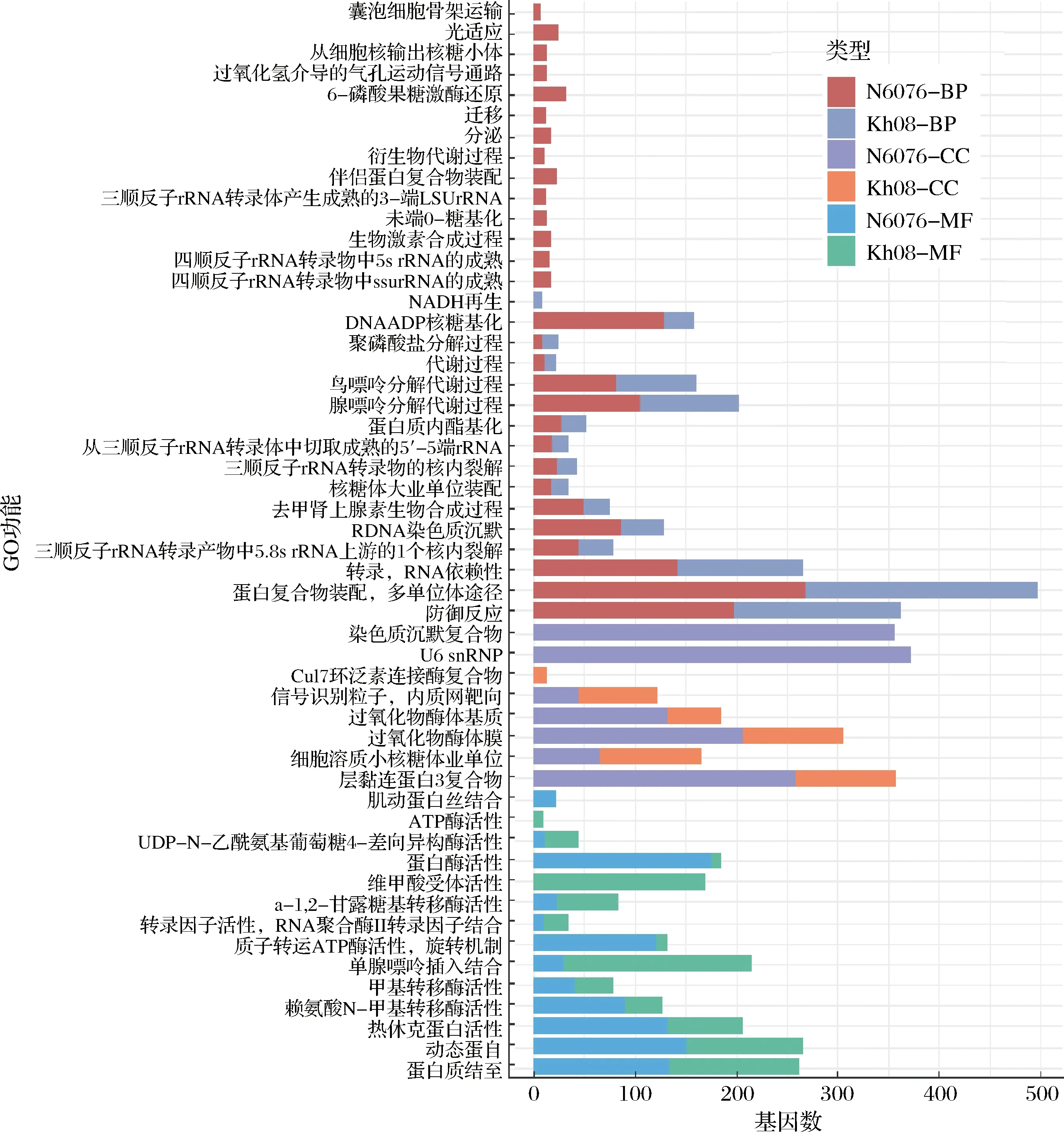
圖2 重組菌株N6076與其原始菌株 Kh08差異表達基因的GO功能Fig.2 The most enriched GO Terms of differential expressed genes of recombinant yeast strain N6076 and original strain Kh08
對相同發酵時間點2株菌株的差異表達基因功能進行分析,結果表明,發酵至48 h,2株酵母菌均包含8種上調表達基因功能,但在下調表達基因功能中,重組菌株N6076與其原始菌株Kh08分別有36和23種;發酵至96 h,2株酵母菌均包含1種上調表達基因功能(DNA ADP核糖基化),但重組菌株N6076 未富集到下調表達差異基因,而原始菌株Kh08 的下調表達基因為 NADH再生功能。
上述差異表達基因GO功能分析結果表明,重組菌株N6076在BP、CC和MF功能方面均比原始菌株Kh08豐富,這有利于重組菌株次生代謝產物的合成。
2.3 差異表達基因的KEGG代謝通路分析
KEGG代謝通路分析結果表明,2株酵母菌的KEGG注釋信息主要包括代謝、遺傳信息過程、細胞過程和有機體系等功能,其中,重組菌株 N6076差異表達基因涉及111條KEGG代謝途徑,比原始菌株Kh08新增了13 條代謝途徑(表2),涉及77個差異表達基因。
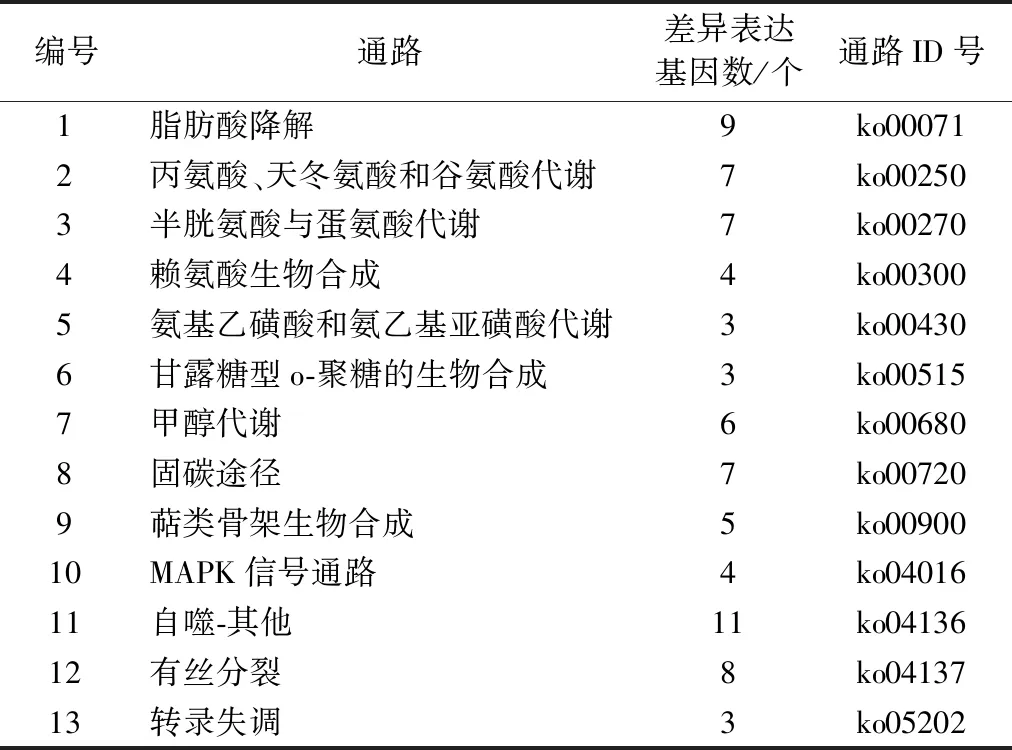
表2 重組菌株N6076新增KEGG代謝途徑Table 2 New added KEGG metabolic pathway of recombinant yeast strain N6076
萜類骨架生物合成(KEGG ID:ko00900)是重組菌株 N6076新增的一條重要的代謝途徑,為其萜類和醌類等次生代謝產物的生物合成提供了基本的C骨架[11]。在自然界生物體內,萜類物質是生物次生代謝產物的一大類別,并且對于大多數真核細胞、少數原核細胞和高等植物而言,其MVP是合成萜類物質的主要途徑。1958年CONRAD和 FEODOR在動物和酵母中發現MVP,且此途徑主要存在于細胞質中,又稱為細胞質途徑[12]。2分子乙酰輔酶 A 在乙酰乙酰輔酶 A 硫解酶的作用下形成乙酰乙酰輔酶 A,然后在 3-羥基-3-甲基戊二酰輔酶 A 合成酶(HMGS)的作用下形成 HMG-CoA[13-14],進而在 3-羥基-3-甲基戊二酰輔酶 A 還原酶 (HMGR)的催化下形成不可逆的MVA[14-16],NADPH 為該反應的供氫體;MVA在MVK、磷酸甲羥戊酸激酶(MPK)作用下磷酸化,形成甲羥戊酸5-焦磷酸(MVAP)和甲羥戊酸焦磷酸脫羧酶(MVAPP);最后,MVAPP在 5-焦磷酸甲羥戊酸脫羧酶(MDC)作用下脫羧形成異戊二烯焦磷酸(IPP),從而進入次生代謝途徑,合成相關的萜類、醌類及甾體類物質,與表2中的萜類骨架生物合成代謝途徑相符合。
乙酰輔酶A是MVP的前體物質,對于萜類和醌類等次生代謝物質的生物合成起到總量控制的作用,改變乙酰輔酶A的濃度會直接影響次生代謝物質的產量。近年來有研究證實,通過調控乙酰輔酶A的基因表達可以增加MVP中生成乙酰輔酶A的含量,進而提高次生代謝物質在目標載體中的產量[17]。
原始菌株Kh08中調控乙酰輔酶A基因的表達量在0~48 h逐漸增加,48~96 h 降低。而重組菌株N6076中調控乙酰輔酶A基因的表達量在整個發酵過程中呈上升態勢,其表達量在 0 h 最低,之后逐漸增加,這為其新增的萜類骨架生物合成提供了前體物質,有利于次生代謝產物的合成。
由于MVA的生成是一個不可逆過程,因此,HMGR (EC∶1.1.1.34)被認為是 MVP中的第1個限速酶[18]。HMGR這個酶的基因的差異表達分析結果表明,重組菌株N6076的HMGR這個酶的基因在48~96 h的KEGG表達中呈下調趨勢,涉及差異表達基因5個;而在原始菌株Kh08的KEGG代謝途徑中未富集到相關酶基因。這進一步表明,重組菌株N6076中MVA的代謝能力有所增強。
2.4 MVA代謝分析
MVK是MVP中的限速酶之一[19-20],通過對2株酵母菌MVK基因的表達分析,獲得了MVK基因隨發酵時間的差異表達趨勢(圖3-a)。同時利用LC-MS/MS對2株酵母菌不同發酵時間的胞內MVA進行了定量測定,結果如圖3-b所示。
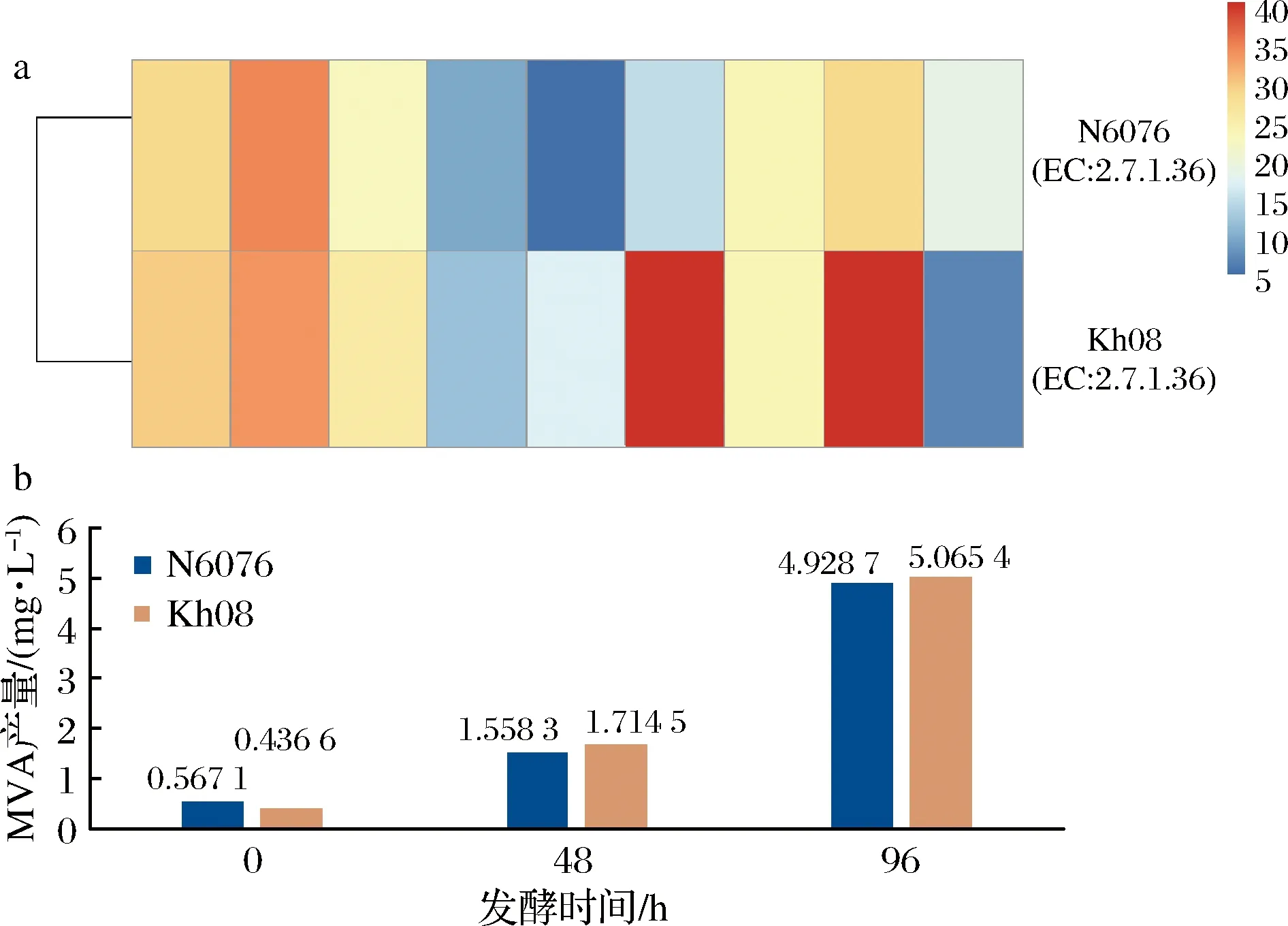
圖3 重組菌株N6076與其原始菌株Kh08各發酵時間點MK基因表達矩陣與MVA產量Fig.3 MK gene expression matrix and MVA yield of recombinant yeast strain N6076 and original strain Kh08 at different fermentation time points
MVK將ATP-γ位上的一個磷酸基團轉移到MVA第5位的羥基上形成MVAP,并釋放ADP[21-22],其酶活性對次生代謝產物的合成速率具有重要的影響作用,并對次生代謝產物的產量有重要影響[23]。重組菌株 N6076 的MVK基因表達量在整個發酵過程中呈起伏上升趨勢,0~48 h降低,48~96 h逐漸增加,MVA產量則逐漸積累,至96 h達到峰值。原始菌株Kh08的MVK基因表達量在48~96 h達到峰值,MVA產量在96 h達到峰值。2株酵母菌的MVK基因表達量與MVA產量的變化趨勢一致。
重組菌株N6076新增1條萜類骨架生物合成途徑(表2),勢必要消耗更多的MVA,因此,發酵48和96 h時,MVA的積累量均低于原始菌株Kh08(圖3-b),說明MVA的代謝速度略快于原始菌株Kh08。
3 結論
差異表達基因的分析結果表明,重組酵母菌N6076發酵至48和96 h時的上調基因數量均低于下調基因的數量;但96 h/48 h時,上調基因數量>下調基因數量。
GO功能分析結果表明,重組酵母菌N6076新增了14項BP功能、2項CC功能和2項MF功能,涉及1 140個差異表達基因。
KEGG代謝通路分析結果表明,重組酵母菌N6076新增了13條代謝通路,涉及77個差異表達基因,其中新增的萜類骨架生物合成途徑涉及5個差異表達基因,為其萜類和醌類等次生代謝產物的生物合成提供了基本的C骨架。
MVK基因表達與MVA測定結果表明,在整個發酵過程中MVK基因表達量與MVA產量的變化趨勢一致。本研究為進一步認識重組酵母菌N6076的基因表達與MVA代謝調控提供了依據。

