果樹器官脫落的研究進展
郝紫微 吳瀟 劉哲 謝智華 張紹鈴 王鵬

摘要:器官脫落是植物通過可控方式將某一器官與母體分離的過程,在植物界普遍發生,也是果樹重要的農藝性狀。器官脫落發生的位置稱為離區,離區的發育是多種基因參與的精細而復雜的調控過程。本文通過總結近年來對果樹器官脫落的研究報道,在生理生化和分子機制方面闡述了果樹器官脫落最新研究進展,以期提高對器官脫落的理解,為進一步深入研究果樹脫落機理提供思路與參考。
關鍵詞:果樹;器官脫落;調控機制;研究進展;工作假說
中圖分類號:S660.1
文獻標志碼:A
文章編號:1002-1302(2020)16-0058-09
器官脫落是植物界普遍存在的生理現象。果樹中常見花、果、葉和枝的脫落。這些器官的非正常脫落最終均會影響果品的質量和產量,甚至導致嚴重的經濟損失。張全軍等研究發現,砂梨的返花返青現象與梨樹早期落葉密切相關[1-2],嚴重影響翌年果實的產量和品質。所以在果樹生產中,實時控制好花果的脫落不僅能減少疏花疏果的人工費用支出,還能提高果實品質,增加收入。
在脫落的起始階段,脫落器官的基部分化出離區,離區會進一步分化產生離層和保護層[3]。離層是器官脫落母體的位置,植物器官的離層因物種和器官存在差異,一般由5~50層細胞組成[4]。而果樹中的離層細胞一般有5~17層[5-6],其中酸櫻桃的果實與果柄的離層細胞有5~8層,柑橘的果實和果柄,葉柄、葉片分別有10~17、15層,日本柿花萼與花梗的脫落層由7層細胞組成。
本文從影響果樹器官脫落的內外因素及相關基因進行闡述,并對器官脫落提出工作假說及展望,希望為進一步深入研究脫落機理,改良果樹農藝性狀提供理論依據。
1 影響器官脫落的內外因素
果樹器官脫落是一個由多種因素協調控制的復雜的生理過程,可分為衰老或成熟引起的正常脫落、植物自身生理活動引起的生理脫落和逆境條件引起的脅迫脫落3種類型[7]。逆境條件、植物內源激素及相關的酶均可以影響果樹器官脫落。其中,逆境條件產生的脫落最容易發生且危害嚴重,也是引起果樹器官非正常脫落的主要原因,包括水分脅迫、溫度脅迫、光照不足、礦物質與碳水化合物的缺失以及病蟲害等(表1)。這些不利的外界條件通過影響果樹體內的生理機能,尤其是影響果樹體內的激素平衡和糖代謝2個過程,從而引起果樹器官的脫落。在水澇條件下,根系進行無氧呼吸產生乙烯運輸到果柄離層處造成落果;光照不足、營養物質的缺失以及病蟲害的發生影響樹體的養分供應,造成樹勢衰弱;反常的氣候條件會使果樹生長受損,發生早期落葉;在溫度脅迫下,蘋果[8]、櫻桃[9]、李子[10]、甜櫻桃[11]等還表現出胚胎敗育等現象。這些非正常脫落對果樹生長和生產造成不利影響,導致果實產量和品質的下降。
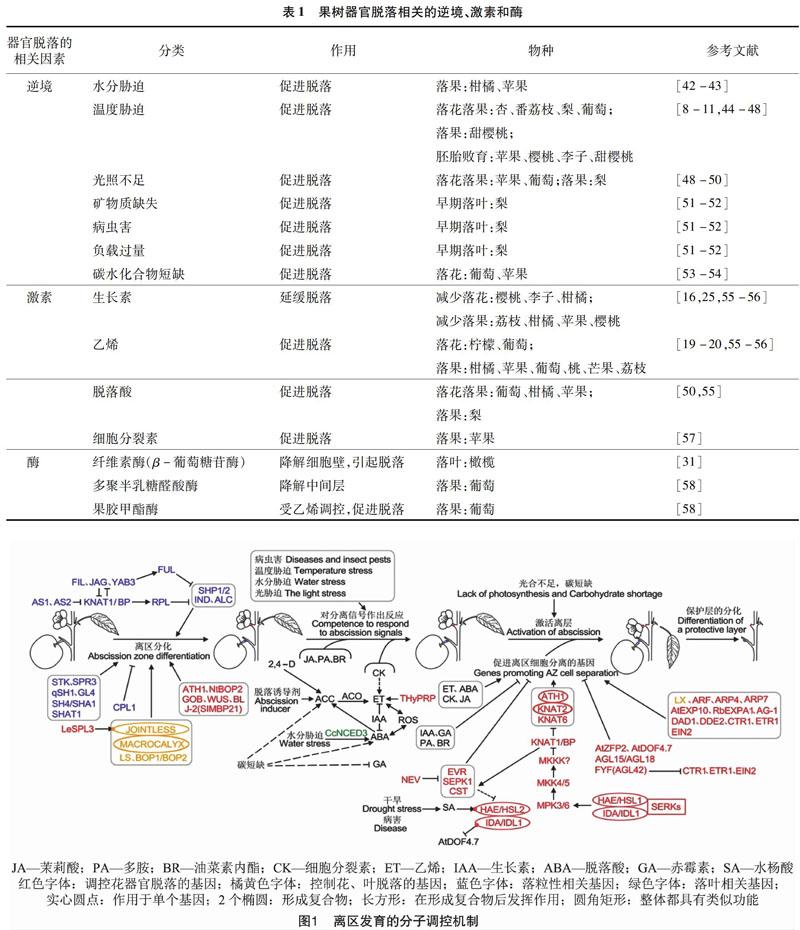
大量研究表明,激素也是調節果樹器官脫落的重要因素之一。脫落進程的啟動,需要離區感受脫落信號,而植物激素可以作為信號調節劑影響植物器官脫落[12-15]。生長素(IAA)與離層形成直接相關,具有延緩脫落的作用[16],其對器官脫落的影響程度與濃度、時間、部位相關。“生長素梯度”學說指出決定脫落的是生長素相對濃度[17]。生長素相對濃度高時,即遠軸端生長素含量高于近軸端時,離層對乙烯的敏感性小,器官不脫落;相對濃度低時,離層細胞對乙烯的敏感性增加,啟動脫落進程,加速離層形成,引起器官脫落[7]。Xie等發現,IAA以濃度依賴的方式抑制柑橘果實脫落,而花柄離區中的IAA則可以直接抑制乙烯的生物合成和信號傳導,從而抑制脫落[18]。另外,有研究報道表明,生長素刺激了乙烯的合成,參與衰老過程。例如,外源施用IAA加速了乙烯產生和康乃馨花的萎蔫[19],2,4-二氯苯氧乙酸(2,4-D)引起花柱、子房和花瓣中ACC(乙烯前體)合成酶基因的表達[20]。此外,生長素抑制或刺激乙烯生物合成依賴于多種因素,包括植物物種、器官和發育階段等,并且顯示出不同的調節機制和生物學功能[21]。目前在柑橘、葡萄等果樹中較多研究表明,在葉片和花果自然脫落、幼胚敗育、發生病蟲害時,體內會產生大量乙烯,促進了果樹器官的脫落[22](表1)。另外,乙烯可以反作用于生長素,可以通過上調番茄外向轉運體基因SlPIN1(Solanum lycopersicum Pin-Formed1)降低離區生長素。芒果果實離區感知乙烯后,花柄中的極性生長素運輸能力減弱,隨后乙烯受體上調,蔗糖含量降低導致果實脫落[23-24]。此外,乙烯還可以通過調節一系列主要細胞過程促進荔枝果實脫落,包括乙烯生物合成和信號傳導、生長素轉運和信號傳導、轉錄調節、蛋白質泛素化、活性氧反應,鈣信號傳導和細胞壁修飾等過程[25]。脫落酸(ABA)是植物在不同發育階段非生物脅迫抵抗機制的激活劑和調節因子,可以加速植物器官脫落進程[26]。但這一作用會受到乙烯和生長素等其他植物激素的影響。柑橘果實經IAA處理后,編碼脫落酸(ABA)生物合成酶基因Cs2g03270和ABA降解酶基因Cs8g18780在脫落過程中分別被顯著地下調和上調,表明了生長素與ABA存在拮抗關系(圖1)。目前,有大量研究表明,脫落酸可以促進葡萄、柑橘、蘋果等果樹落花落果(表1)。其他激素中,赤霉素(GA)和茉莉酸(JA)可以加速脫落,細胞分裂素(CK)、油菜素內脂(BR)為脫落的抑制劑。在柑橘中,與合成JA相關的3個基因(Cs7g12890、Cs5g28310、Cs2g21000)和與BR信號相關的5個基因(Cs9g18950、Cs9g15900、Cs6g20340、Cs5g08340、Cs4g02270)都受到IAA的影響[18]。除了一些激素外,植物生長發育調節物質多胺(PA)也為脫落的抑制劑。并且多胺含量與梨樹二次開花過程中花芽萌芽率之間存在顯著相關關系。在發生環境脅迫時,其含量增加可以使乙烯含量減少,延緩植物的衰老[27],但它們的具體作用機制尚不清楚。
此外,器官脫落還受到一些酶的調控。有研究指出,果樹中纖維素酶和果膠酶等水解酶活性增強,導致細胞壁松動,促進器官脫落(表1)。這些水解酶參與脫落區的細胞壁和中間層的降解,并且乙烯可以促進水解酶的生成,最終導致器官脫落[28]。這也說明激素可以促進一些水解酶合成,進而調控器官脫落。其中纖維素酶中的β-葡萄糖苷酶(BG)與器官脫落相關性較大,桃和柑橘果實離區中乙烯的增加能夠誘導該酶含量升高,從而降解細胞壁,引起果實脫落。Qi等發現,將梨萼片脫落基因PsJOINTLESS過表達在轉基因番茄中,編碼纖維素酶基因CEL2上調且纖維素酶活性顯著增加,引起了花柄脫落[29]。Yang等研究表明,使用H2O2清除劑可以抑制纖維素酶活性的增加,減少龍眼果實的脫落[30]。另外,Goldental等利用乙烯利處理橄欖葉、果實、花梗,發現僅在葉離區中纖維素酶基因上調[31],說明纖維素酶在脫落過程中具有組織表達特異性。果膠酶具有分解細胞壁間果膠質的功能,主要包括多聚半乳糖醛酸酶(PG)和果膠甲酯酶(PME)2種酶。PG是參與中間層降解的關鍵酶,多位于細胞發生分離的區域,乙烯能夠誘導PG的生成,其活性的升高與離區脫落進程中強度相一致。
Chersicola等用1-甲基環丙烯(1-MCP)(乙烯抑制劑)處理番茄,發現1-MCP可以通過抑制PG的表達阻止細胞的分離[32]。Srivignesh等報道表明,番茄的3個PG基因(TAPG1、TAPG2和TAPG4)參與離區的形成[33]。PME基因的表達同樣受乙烯的調控,但其在器官脫落方面的具體作用存在爭議。較多研究結果表明,果膠甲酯酶對植物器官的脫落有促進作用[12,34],但也有不同觀點,如該酶在柑橘葉柄和龍眼果實中并沒發現具有調控脫落功能[35-36]。過氧化物酶(peroxidase,POD)是植物呼吸過程中呼吸末端氧化酶之一,對植物器官脫落有一定的促進作用。其調控機制主要有2點,一是POD參與生長素的氧化進程,降低離區生長素的水平,間接促進脫落;二是POD促進離區傷痕的木質化,進而促進脫落。其他對器官脫落起作用的幾丁質酶(chitinase)和苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)等酶類,對于果樹器官脫落后傷口的保護和脫落斷面的木質化有重要作用[12,37]。
有研究指出,離區細胞的細胞質溶液堿性隨著脫落過程的進行變強,且乙烯抑制劑的應用可以阻止胞質堿化。因此,pH值的改變可能為細胞壁降解酶提供了更好的細胞環境,影響其活性,從而影響脫落[38]。
此外,細胞凋亡(programmed cell death,PCD)過程是離層形成的重要調控機制。Bar-Dror等的研究結果表明,核糖核酸酶基因是影響器官脫落的主要基因,該基因參與了PCD過程[39]。在番茄花和葉脫落后期的離層細胞中觀察到PCD的一些典型特征,包括細胞活力喪失,核形態改變,DNA片段化,活性氧和酶活性水平升高,以及PCD相關基因的表達量升高,這表明PCD與脫落密切相關。但二者之間潛在的調節機制還存在爭議,需進一步研究。活性氧(reactive oxygen species,ROS)是植物PCD的關鍵影響因子,與發育過程和環境應激反應有關[40],相比于正常細胞,NADPH氧化酶基因RBOH1在離層細胞表達顯著升高,ROS含量顯著提高[41]。較低劑量的ROS可以提高植物的抗逆性,而較高濃度則可能導致細胞程序性死亡。研究表明,ROS可以介導碳水化合物脅迫誘導的龍眼果實的脫落[30]。不同的脅迫因子在逆境脅迫條件下通過其他信號和激素的作用,直接或間接促進ROS的產生和PCD的開始,在極端情況下甚至導致組織壞死。并且ROS含量的變化會影響PCD進程,從而影響離區發育。
2 果樹器官脫落相關基因的研究
進行果樹器官脫落的分子機制研究,可為進一步了解器官脫落發生過程和對脫落進行調控提供更可靠的理論依據。目前,在模式植物擬南芥中已報道的引起脫落的基因中,在桃、柑橘、蘋果等11種果樹中研究了其中14類,包括7類與花器官脫落相關和7類與果實脫落相關(表2)。
目前J(Jointless)是離區發育相關的研究較多的基因之一[33,59-61],J和J-2(Jointless-2)是非等位的2個MADS-box基因,且J是J-2的上位基因[62]。J的突變可以抑制花序分生組織中合軸的發育和離區的產生,維持花序分生組織的正常生長,并且對于胚珠和種子發育、果實形狀也有重要作用[59,63]。番茄jointless突變體不能形成離區,因此不發生果實或花的脫落[59]。將梨的J基因轉入到番茄植株中,發現該基因促進花柄脫落,花柄變細,離層細胞數目增加、細胞變小、破裂、排列無序,花柄離區纖維酶的活性升高,細胞壁水解酶的基因和誘導編碼脫落相關的轉錄因子表達量上升[64]。IDA(Inflorescence Deficient In Abscission)是模式植物擬南芥中促進花器官脫落的主要基因。最新的研究表明,在IDA與受體激酶HAE/HSL2(Haesa/Haesa-Like2)結合后,SERKs(Somatic Embryognesis Receptor-Like Kinase)能夠與HAE/HSL2形成復合物,從而調節花器官脫落[65](圖1)。目前,IDA基因在梨、柑橘和荔枝中均有報道研究。PsIDA可以促進梨萼片脫落[64]。在擬南芥過表達荔枝或柑橘的IDA基因引起擬南芥的早期落花[66]。柑橘中的CitIDA3還可以明顯抑制擬南芥突變體ida-2花的脫落[57],說明該基因功能比較保守。此外,St等在楊樹(雙子葉樹)和棕櫚(單子葉樹)研究了IDA-HAE/HSL2脫落信號通路,發現IDA-HSL在多個物種的不同離區中均有表達,為該通路的功能保守性提供進一步的證據[67]。這些結果表明IDA-HAE/HSL2脫落信號通路在不同植物類群的高等植物中均起著重要作用。其他幾類基因如:KNAT1/BP(Knotted-Like From Arabidopsis thaliana/Bervipedicellus)、STK(Seedstick)等基因[68-70]如何參與影響果樹生長發育過程,如何影響器官脫落還需進一步研究。FUL(Fruitfull)基因不僅可以抑制蘋果和桃離區發育,還具有促進果實成熟和提高花器官數量的功能[71]。此外,與激素相關的部分基因也調節了果樹器官的脫落。杜藝在研究荔枝生理落果問題時,發現了13個IAA和12個ABA相關基因分別參與荔枝幼果和成熟果脫落過程[72]。Li等進行了荔枝果實全基因組數字轉錄豐度分析挖掘了控制脫落2 730個候選基因,其中195個基因與激素相關[25]。干旱脅迫誘導柑橘ABA生物合成基因CcNCED3(9-Cis-Epoxycarotenoid Dioxygenase)的表達,促進根中ABA合成,進而使葉片產生乙烯,導致葉片脫落。
3 器官脫落的工作假說
植物器官脫落大致分為4個階段(圖1)。第1階段為離區的分化,第2階段為離區根據外界刺激或發育信號作出反應同時啟動脫落進程,第3階段和第4階段部分重疊,為離層細胞的激活,開始器官的脫落和保護層的形成。目前對模式植物擬南芥和番茄的器官脫落研究較多,已形成簡單的基因調控網絡。
第1階段中,SHP1(Shatterproof1)、SHP2(Shatterproof2)、IND(Indehiscent)和ALC(Alcatraz)在擬南芥角果開裂的離區發育過程中起著重要功能[90]。AP1(Apetala1)的同源基因FUL(Fruitfull),以及RPL(Replumless)也參與角果開裂發育。FIL(Filamentous)、JAG(Jagged)、YAB3(Yabby3)、AS1/AS2(Asymmetric Leaves)和KNAT1/BP等部分基因形成一個復雜的調控網絡共同控制角果離層的發育。根據已報道的FUL基因在草莓、木瓜、蘋果、桃和RPL基因在龍眼中的功能,推測這2個基因可能通過抑制IND、SHP和ALC等下游基因的表達,進而抑制果實離區發育。在荔枝和桃中報道了基因FIL、YAB3及KNAT1/BP參與離區發育。這些基因功能較為保守,很可能在其他果樹中也存在相似的基因調控網絡參與離區發育。
落粒性是糧食作物的栽培育種的一個重要農藝性狀。在脫落發生的第1階段,促進離區分化的SH4/SHA1(Shattering1)、qSH1(Seed Shattering in Chromosome 1)、SHAT1(Shattering Abortion 1)基因,抑制離區形成的OsCPL1(C-Terminal Domain Phosphatase-Like 1)基因在作物落粒性的研究中取得了一定的進展。水稻qSH1基因與擬南芥RPL和FUL序列相似性較高,與長角果的離區的分化相關。SHAT1是擬南芥AP2蛋白的水稻直系同源物,參與花發育的調控[57]。這些結果表明,控制擬南芥角果發育的基因在其他物種中也可能具有同樣的功能。MACROCALYX、LeSPL3(Squamosa Promoter Binding Protein-Like)可以促進花柄離區的分化。但二者調控途徑不一樣,MACROCALYX與J形成復合物[58]發揮功能,而LeSPL3在J的上游發揮作用[91]。此外,研究表明LS(Lateral Suppressor)、CEL2促進脫落,而BL(Blind)、TAPG2(Tomato Abscission-Related Polygalac-Turonases 2)、TAPG4可以抑制脫落[91-92]。Roldan等研究發現,LS、BL、LeWUS(Wushel)和GOB(Goblet)與離區形成相關[62]。因此,對于果樹離區分化階段,可參照其他作物中脫落相關基因進行研究。
根據發育進程與環境的刺激,離區發育進入第2階段。病蟲害、溫度脅迫、水分脅迫等逆境環境以及激素的刺激會引發植物開始脫落。乙烯、脫落酸、細胞分裂素、茉莉酸促進脫落,生長素、赤霉素、油菜素內酯、多胺抑制脫落發生。調控各激素的基因在此階段變得活躍,發揮重要作用,直接或間接地引起乙烯的變化而影響脫落。如水分脅迫引起柑橘ABA生物合成基因CcNCED3表達,促進乙烯產生,導致葉片脫落。而沉默THyPRP(Tomato Hybrid Proline-rich Protein)可以減少乙烯的生物合成[93]。使用2,4-D和脫落誘導劑可以促進乙烯前體ACC的產生,進而促進器官脫落。
第3和第4階段表明發生的脫落現象,已經明確的花器官脫落信號傳導途徑是BOPl/BOP2(Blade On Petiole)→IDA→HAE/HSL2→MPK3/6→MKK4/MKK5→KNAT→花器官脫落,AtDOF4.7在IDA上游發揮作用。IDA基因在梨、柑橘和荔枝果樹中均可以促進花器官脫落,該基因參與的花器官脫落信號傳導途徑在多個物種均有報道,在果樹中很可能存在著相似的調控網絡。另外,干旱或病害的發生會促進水楊酸的產生,誘導HAE/HSL2的表達。與生長素相關的ARF和SlPIN1等基因可以調控番茄脫落。ARF基因參與番茄離區發育和完成脫落進程[75],抑制SlPIN1的表達,加速番茄花瓣的脫落[23]。ARF基因在葡萄和蘋果中參與離區發育已經被報道,但在果樹中未發現SlPIN1及其同源物。因此SlPIN1基因在果樹中可能不參與離區過程。此外,乙烯相關基因在擬南芥和番茄的脫落調控中存在差異,如ETR1、ETR2和ETR3的突變延遲了擬南芥角果的脫落,但在番茄中只有ETR1的同源基因neverripe突變延遲果實脫落[94-95]。根據該結果推測在果樹器官脫落的研究中,乙烯相關基因的作用會依據物種的不同存在差異。
4 展望
植物器官脫落在植物基礎理論研究和農業生產方面都具有重要意義。擬南芥、番茄等模式植物遺傳背景清楚,繁殖快,容易轉化,為器官脫落研究提供了很多便利條件。果樹遺傳轉化體系比較困難,通過克隆果樹相關基因轉入到模式植物中,進行異源轉化對果樹器官脫落研究有重要的參考意義。果樹植物中僅梨、柑橘、蘋果、桃和荔枝等主要果樹中的單個脫落相關基因功能研究較多,但是還缺乏完整的分子調控網絡,需要進一步擴大果樹種類,深入挖掘離區發育遺傳機制。
在果樹生產實踐過程中,葉片脫落是一個重要問題。育種家和分子生物學家應共同努力,了解每個果樹物種的發展規律,使用分子手段結合傳統育種,以及形態學和生理學研究,提高對果樹不同時期不同器官脫落的理解,應用更恰當的管理技術,提高果品的質量和產量,防止不必要的脫落。例如開發保葉劑、乙烯抑制劑、生長素合成劑以及人工控制下的適度脫落。目前在生產中疏花疏果劑已應用較多,但仍然需進一步細化其激素濃度配比以及噴施時間。在大多情況下,早期芽或果實的適度脫落會改善根的發育,使植物更有活力,中期適當疏花疏果能夠防止“大小年”現象,獲得更高品質的果品。國內外學者雖已在植物脫落機制方面進行了大量的研究,但仍有許多科學問題需要進一步解決。例如在植物激素對脫落的調控中,只有乙烯調控機制研究得較為深入,生長素、脫落酸等其他植物激素的作用部位和分子調控機制還不清楚[96]。另外,研究者雖然對脫落過程中細胞壁水解酶進行了大量的研究,但其他酶類包括過氧化物酶、幾丁質酶、苯丙氨酸解氨酶等在脫落過程中的具體作用方式并不明確,不同果樹對脫落起主要作用的酶也并不一致。今后對每個果樹激素的調控作用、激素之間的調控網絡以及酶在不同植物中的具體作用機制和它們之間的協同作用需要做進一步深入研究。
另外有關離區發育和器官脫落的分子機制應當在果樹中進行更加廣泛、深入的研究。例如目前柑橘落花落果機制尚不清楚,梨早期落葉的分子機制還未完全解析[51,97]。PsJ增強了脫落相關基因的表達,但這些基因之間的相互作用并不清晰,具體的基因調控網絡需進一步確定。
在柑橘[98]、梨[99]、蘋果[100]、草莓等[101]部分果樹中基因編輯和遺傳轉化技術的日益完善以及基因組學與蛋白質組學的發展,為研究果樹器官脫落的分子機制提供了強有力的工具,可以進一步闡明果樹器官的脫落機理,解析果樹器官脫落的特異性機制。這不僅對基礎研究具有重要意義,在新品種培育和產業技術研發方面也將有重要的推動作用。
參考文獻:
[1]張全軍,李文貴,鐘必鳳,等. 南方砂梨返花返青發生特性及其與早期落葉的關系[J]. 西南農業學報,2013,26(3):1160-1163.
[2]張全軍. 砂梨二次花發生的生理特征及基因表達譜分析[D]. 南京:南京農業大學,2015:2-14.
[3]韓 靜,王幼群,王曉理. 植物器官脫落的機制及其研究進展[J]. 植物學通報,1999,16(4):405-410.
[4]劉 春. 月季花瓣脫落轉錄組分析及RhIAA16基因響應脫落的功能分析[D]. 北京:中國農業大學,2016:1-5.
[5]郭凱斌,李 升,喬 光. 大櫻桃生理落花落果特性及調控機制研究進展[J]. 種子,2018,37(10):50-56.
[6]Li X,Kitajima A,Kataoka K,et al. Anatomical observations of the citrus fruit abscission zone and morphological changes of the cells during secondary physiological fruit drop[J]. The Horticulture Journal,2017,86(4):447-455.
[7]蔡慶生. 植物生理學[M]. 北京:中國農業大學出版社,2011:275-277.
[8]Simons R K. Tissue response of young developing apple fruits to freeze injury[J]. Journal of the American Society for Horticultural Science,1969,94:376-382.
[9]Stsser R,Anvari S. On the senescence of ovules in cherries[J]. Scientia Horticulturae,1982,16(1):29-38.
[10]Cerovic R,Ruzic D,Micic N. Viability of plum ovules at different temperatures[J]. Annals of Applied Biology,2000,137(1):53-59.
[11]Hedhly A,Hormaza J I,Herrero M. Warm temperatures at bloom reduce fruit set in sweet cherry[J]. Journal of Applied Botany and Food Quality,2007,81(2),158-164.
[12]高欣欣,劉少春,張躍彬,等. 植物器官脫落相關激素和酶的研究進展[J]. 中國農學通報,2013,29(33):17-21.
[13]Taesakul P,Siriphanich J,van Doorn W G. Two abscission zones proximal to Lansium domesticum fruit:one more sensitive to exogenous ethylene than the other[J]. Frontiers in Plant Science,2015,6(3):264.
[14]Jin X. The role of auxin in abscission of organs and tissues[D]. Sweden:Acta Universitatis Agriculturae Sueciae,2015:11-20.
[15]Domingos S,Scafidi P,Cardoso V,et al. Flower abscission in Vitis vinifera L. triggered by gibberellic acid and shade discloses differences in the underlying metabolic pathways[J]. Frontiers in Plant Science,2015,6:457.
[16]Gao Y R,Liu C,Li X D,et al. Transcriptome profiling of petal abscission zone and functional analysis of an Aux/IAA family gene RhIAA16 involved in petal shedding in rose[J]. Frontiers in Plant Science,2016,7(R106):1375.
[17]王高奇. 乙烯依賴和非乙烯依賴的花器官脫落途徑調控AtDOF4.7的研究[D]. 北京:中國農業大學,2015:4-6.
[18]Xie R J,Ge T,Zhang J,et al. The molecular events of IAA inhibiting citrus fruitlet abscission revealed by digital gene expression profiling[J]. Plant Physiology and Biochemistry,2018,130:192-204.
[19]Liu J P,Zhang Z Q,Li H M,et al. Alleviation of effects of exogenous ethylene on cut ‘Master carnation flowers with nano silver and silver thiosulfate[J]. Postharvest Biology and Technology,2018,143:86-91.
[20]Jones M L,Woodson W R. Differential expression of three members of the 1-aminocyclopropane-1-carboxylate synthase gene family in carnation[J]. Plant Physiology,1999,119(2):755-764.
[21]Wang H,Chang X X,Lin J,et al. Transcriptome profiling reveals regulatory mechanisms underlying corolla senescence in petunia[J]. Horticulture Research,2018,5(1):16.
[22]王艷玲. MicroRNA1917調控番茄花柄脫落的分子機制研究[D]. 沈陽:沈陽農業大學,2017:7-10.
[23]Shi Z H,Jiang Y,Han X Q,et al. SlPIN1 regulates auxin efflux to affect flower abscission process[J]. Scientific Reports,2017,7:14919.
[24]Hagemann M H,Winterhagen P,Hegele M,et al. Ethephon induced abscission in mango:physiological fruitlet responses[J]. Frontiers in Plant Science,2015,6:706.
[25]Li C Q,Wang Y,Ying P Y,et al. Genome wide digital transcript analysis of putative fruitlet abscission related genes regulated by ethephon in litchi[J]. Frontiers in Plant Science,2015,6(12):502.
[26]Hauser F,Li Z,Waadt R,et al. Snapshot:abscisic acid signaling[J]. Cell,2017,171(7):1708-1708.
[27]張全軍,鐘必鳳,李文貴,等. ‘豐水梨二次開花過程中枝芽多胺含量的變化[J]. 西南農業學報,2016,29(9):2221-2224.
[28]Roberts J A,Elliott K A,Gonzalezcarranza Z H. Abscission,dehiscence,and other cell separation processes[J]. Annual Review of Plant Biology,2002,53(1):131-158.
[29]Qi X X,Hu S,Zhou H S,et al. A MADS box transcription factor of ‘Kuerlexiangli(Pyrus sinkiangensis Yu) PsJOINTLESS gene functions in floral organ abscission[J]. Gene,2018,642:163-171.
[30]Yang Z Q,Zhong X M,Fan Y,et al. Burst of reactive oxygen species in pedicel mediated fruit abscission after carbohydrate supply was cut off in longan (Dimocarpus longan)[J]. Frontiers in Plant Science,2015,6:360.
[31]Goldental C S,Burstein C,Biton I,et al. Ethephon induced oxidative stress in the olive leaf abscission zone enables development of a selective abscission compound[J]. BMC Plant Biology,2017,17(1):87.
[32]Chersicola M,Kladnik A,Tusek Z M,et al. 1-aminocyclopropane-1-carboxylate oxidase induction in tomato flower pedicel phloem and abscission related processes are differentially sensitive to ethylene[J]. Frontiers in Plant Science,2017,8:464.
[33]Srivignesh S,Sonia P H,Joseph R,et al. De novo transcriptome sequencing and development of abscission zone-specific microarray as a new molecular tool for analysis of tomato organ abscission[J]. Frontiers in Plant Science,2016,6:1258.
[34]Tabuchi T,Arai N. Changes in esterase activity in the abscission zone of jointless tomato fruits[J]. Journal of the Japanese Society for Horticultural Science,1999,68(6):1152-1154.
[35]Ratner A,Goren R,Monselise S P. Activity of pectin esterase and cellulase in the abscission zone of citrus leaf explants[J]. Plant Physiology,1969,44(12):1717-1723.
[36]楊子琴. 饑餓脅迫誘導龍眼果實脫落的信號發生與調控機理研究[D]. 廣州:華南農業大學,2011:1-18.
[37]齊明芳,李天來,許 濤,等. 園藝作物器官脫落相關酶的研究進展[J]. 北方園藝,2007(6):62-65.
[38]Patharkar O R,Walker J C. Advances in abscission signaling[J]. Journal of Experimental Botany,2017,69(4):733-740.
[39]Bar-Dror,Dermastia M,Kladnik A,et al. Programmed cell deathoccurs asymmetrically during abscission in tomato[J]. Plant Cell,2011,23(11):4146-4163.
[40]Ma N,Ma C,Liu Y,et al. Petal senescence:a hormone view[J]. Journal of Experimental Botany,2018,69(4):719-732.
[41]丁坤峰,譚曉榮. 植物NADPH氧化酶研究進展[J]. 生命科學,2010(8):723-728.
[42]Garciatejero I,Romerovicente R,Jimenezbocanegra J A,et al. Response of citrus trees to deficit irrigation during different phenological periods in relation to yield,fruit quality,and water productivity[J]. Agricultural Water Management,2010,97(5):689-699.
[43]伏健民,束懷瑞. 春季干旱對金冠蘋果不同部位葉片衰老和脫落的影響[J]. 果樹科學,1993(2):65-68.
[44]Rodrigo J,Herrero M. Effects of pre-blossom temperatures on flower development and fruit set in apricot[J]. Scientia Horticulturae,2002,92(2):125-135.
[45]Higuchi H,Utsunomiya N,Sakuratani T. High temperature effects on cherimoya fruit set,growth and development under greenhouse conditions[J]. Scientia Horticulturae,1998,77(1/2):23-31.
[46]Tromp J,Borsboom O. The effect of autumn and spring temperature on fruit set and on the effective pollination period in apple and pear[J]. Scientia Horticulturae,1994,60(1/2):23-30.
[47]Ebadi A,Coombe B G,May P. Fruit-set on small Chardonnay and Shiraz vines grown under varying temperature regimes between budburst and flowering[J]. Australian Journal of Grape and Wine Research,1995,1(1):3-10.
[48]Ferree D C,Mcartney S J,Scurlock D M. Influence of irradiance and period of exposure on fruit set of French-American hybrid grapes[J]. Journal of the American Society for Horticultural Science,2001,126(3):283-290.
[49]Zhu H,Dardick C D,Beers E P,et al. Transcriptomics of shading induced and NAA induced abscission in apple(Malus domestica)reveals a shared pathway involving reduced photosynthesis,alterations in carbohydrate transport and signaling and hormone crosstalk[J]. BMC Plant Biology,2011,11(1):138.
[50]Einhorn T C A M,Shading I. Pear abscission and inhibit photosynthesis but are not additive[J]. Journal of Plant Growth Regulation,2018,37(1):300-308.
[51]劉 坤. “漢水砂梨”早期落葉的誘因調查及初步分析[J]. 中國果樹,2016(2):91-93,103.
[52]李忠才,黃新忠,林洪龍,等. 梨早期落葉原因與對策[J]. 河北果樹,2006(5):44-45.
[53]Duchêne E,Jaegli N,Salber R,et al. Effects of ripening conditions on the following seasons growth and yield components for Pinot noir and Gewurztraminer grapevines(Vitis vinifera L.)in a controlled environment[J]. OENO One,2003,37(1):39-49.
[55]Iwanami H,Moriyat Y,Honda C,et al. Relationships among apple fruit abscission,source strength,and cultivar[J]. Scientia Horticulturae,2012,146,39-44.
[55]Sawicki M,Ait B E,Clement C,et al. Cross talk between environmental stresses and plant metabolism during reproductive organ abscission[J]. Journal of Experimental Botany,2015,66(7):1707-1719.
[56]Zhu H,Yuan R,Greene D W,et al. Effects of 1-methylcyclopropene and naphthaleneacetic acid on fruit set and expression of genes related to ethylene biosynthesis and perception and cell wall degradation in apple[J]. Journal of the American Society for Horticultural Science,2010,135(5):402-409.
[57]Estornell L H,AgustaJ,Merelo P,et al. Elucidating mechanisms underlying organ abscission[J]. Plant Science,2013,199(3):48-60.
[58]Deng Y,Wu Y,Li Y F. Effects of high CO2 and low O2 atmospheres on the berry drop of ‘Kyoho grapes[J]. Food Chemistry,2007,99(2):768-773.
[59]Mao L,Begum D,Chuang H W,et al. JOINTLESS is a MADS box gene controlling tomato flower abscission zone development[J]. Nature,2000,406(6798):910-913.
[60]Guan X,Xu T,Gao S,et al. Temporal and spatial distribution of auxin response factor genes during tomato flower abscission[J]. Journal of Plant Growth Regulation,2014,33(2):317-327.
[61]Ito Y,Nakano T. Development and regulation of pedicel abscission in tomato[J]. Frontiers in Plant Science,2015,6:442.
[62]Roldan M,Perilleux C,Morin H,et al. Natural and induced loss of function mutations in SlMBP21 MADS box gene led to jointless2 phenotype in tomato[J]. Scientific Reports,2017,7(1):4402.
[63]王 翔. 番茄花柄離區發育的分子生物學研究[D]. 北京:中國農業科學院,2008:5-7.
[64]齊笑笑. 梨果實萼片宿存與脫落過程基因表達譜分析及PsIDA、PsJOINTLESS基因功能的初步研究[D]. 南京:南京農業大學,2014:7-18.
[65]Lee Y,Yoon T H,Lee J,et al. A lignin molecular brace controls precision processing of cell walls critical for surface integrity in Arabidopsis[J]. Cell,2018,173(6):1468-1480.
[66]Ying P,Li C,Li X,et al. Identification and molecular characterization of an IDA-like gene from litchi,LcIDL1,whose ectopic expression promotes floral organ abscission in Arabidopsis[J]. Scientific Reports,2016,6:37135.
[67]St I M,Orr R J,Fooyontphanich K,et al. Conservation of the abscission signaling peptide IDA during angiosperm evolution:withstanding genome duplications and gain and loss of the receptors HAE/HSL2[J]. Frontiers in Plant Science,2015,6(634):931.
[68]韓亞萍. 桃體細胞胚發生相關基因SERK2的克隆與表達分析[D]. 鄭州:河南農業大學,2017:4-7.
[69]Testone G,Bruno L,Condello E,et al. Peach[Prunus persica(L.)Batsch]KNOPE1,a class 1 KNOX orthologue to Arabidopsis BREVIPEDICELLUS/KNAT1,is misexpressed during hyperplasia of leaf curl disease[J]. Journal of Experimental Botany,2008,59(2):389-402.
[70]Yu Q,Steiger D,Kramer E M,et al. Floral mads box genes in trioecious papaya:characterization of AG and AP1 subfamily genes revealed a sex type specific gene[J]. Tropical Plant Biology,2008,1(2):97-107.
[71]褚婷婷,謝 華,徐 勇,等. 植物MADS-box基因FRUITFULL(FUL)研究進展[J]. 中國生物工程雜志,2010,30(9):98-104.
[72]杜 藝. 荔枝落果過程中IAA和ABA相關基因表達及其定量檢測初探[D]. 廣州:華南農業大學,2016:1-10.
[73]Aalen R B,Wildhagen M,St I M,et al. Ida:a peptide ligand regulating cell separation processes in Arabidopsis[J]. Journal of Experimental Botany,2013,64(17):5253-5261.
[74]Zhang Q,Zhang H,Sun L,et al. The genetic architecture of floral traits in the woody plant Prunus mume[J]. Nature Communications,2018,9(1):1702.
[75]關曉溪. 番茄花柄脫落相關生長素響應基因ARFs的篩選及其功能的初步鑒定[D]. 沈陽:沈陽農業大學,2015:1-18.
[76]Liu K,Feng S,Jiang Y,et al. Identification and expression analysis of seven MADS box genes from Annona squamosa[J]. Biologia Plantarum,2017,61(1):24-34.
[77]Jibran R,Tahir J,Cooney J,et al. Arabidopsis AGAMOUS regulates sepal senescence by driving jasmonate production[J]. Frontiers in Plant Science,2017,8:2101.
[78]Zhang Y,Zeng Z,Chen C,et al. Genome-wide characterization of the auxin response factor (ARF) gene family of litchi (Litchi chinensis Sonn.):phylogenetic analysis,miRNA regulation and expression changes during fruit abscission[J]. Peer J,2019,7:e6677.
[79]李慧峰,冉 昆,何 平,等. 蘋果生長素響應因子(ARF)基因家族全基因組鑒定及表達分析[J]. 植物生理學報,2015,51(7):1045-1054.
[80]Xie R,Pang S,Ma Y,et al. The ARF,AUX/IAA and GH3 gene families in citrus:genome-wide identification and expression analysis during fruitlet drop from abscission zone A[J]. Molecular Genetics and Genomics,2015,290(6):2089-2105.
[81]常 璟. 棉花離層相關基因GhBOP1的分離及功能鑒定[D]. 蘭州:甘肅農業大學,2015:6-7.
[82]葉孋嬋. 番石榴果實對乙烯敏感性與其受體cDNA選殖表現分析[D]. 臺灣:臺灣大學,2013.
[83]王 翔,陳曉博,李愛麗,等. 植物器官脫落分子生物學研究進展[J]. 作物學報,2009,35(3):381-387.
[84]Wu J Y,Zhang H N,Liu L,et al. Validation of reference genes for RT qPCR studies of gene expression in preharvest and postharvest longan fruits under different experimental conditions[J]. Frontiers in Plant Science,2016,7(439):780.
[85]Burko Y,Shleizer B S,Yanai O,et al. A role for APETALA1/FRUITFULL transcription factors in tomato leaf development[J]. Plant Cell,2013,25(6):2070-2083.
[86]Mouhu K,Hytnen T,Folta K,et al. Identification of flowering genes in strawberry,a perennial SD plant[J]. BMC Plant Biology,2009,9(1):122.
[87]Wang J,Zhang X M,Yan G H,et al. Over expression of the PaAP1,gene from sweet cherry(Prunus avium L.)causes early flowering in Arabidopsis thaliana[J]. Journal of Plant Physiology,2013,170(3):315-320.
[88]Chi Y J,Wang T T,Xu G L,et al. GmAGL1,a MADS box gene from soybean,is involved in floral organ identity and fruit dehiscence[J]. Frontiers in Plant Science,2017,8(242):175.
[89]Pathak A K,Singh S P,Gupta Y,et al. Transcriptional changes during ovule development in two genotypes of litchi (Litchi chinensis Sonn.) with contrast in seed size[J]. Scientific Reports,2016,6:36304.
[90]廖文彬,楊義伶,李雅韻,等. 植物離區發育及調控信號的多樣性研究進展[J]. 熱帶農業科學,2014,34(12):42-48.
[91]陳曉博. 參與番茄花柄離區發育的轉錄因子SPL3的基因功能研究[D]. 北京:中國農業科學院,2010:1-13.
[92]Schumacher K,Schmitt T,Rossberg M,et al. The Lateral suppressor(Ls) gene of tomato encodes a new member of the VHIID protein family[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(1):290-295.
[93]Sundaresan S,Philosoph H S,Ma C,et al. The tomato hybrid proline rich protein regulates the abscission zone competence to respond to ethylene signals[J]. Horticulture Research,2018,5(1):28.
[94]Lanahan M B,Yen H C,Giovannoni J J,et al. The never ripe mutation blocks ethylene perception in tomato[J]. Plant Cell,1994,6(4):521-530.
[95]Klee H J. Control of ethylene mediated processes in tomato at the level of receptors[J]. Journal of Experimental Botany,2002,53(377):2057-2063.
[96]王 鵬,王丹丹. 乙烯利、脫落酸對采收前艷紅桃成熟期的調控[J]. 江蘇農業科學,2018,46(23):110-114.
[97]王男麒. 柑橘花果脫落規律及其礦質養分損耗[D]. 重慶:西南大學,2014:20-45.
[98]Zhu C,Zheng X,Huang Y,et al. Genome sequencing and CRISPR/Cas9 gene editing of an early flowering mini citrus(Fortunella hindsii)[J]. Plant Biotechnology Journal,2019,17(11):2199-2210.
[99]Charrier A,Vergne E,Dousset N,et al. Efficient targeted mutagenesis in apple and first time edition of pear using the CRISPR-Cas9 system[J]. Frontiers in Plant Science,2019,10:40.
[100]Osakabe Y,Liang Z,Ren C,et al. CRISPR-Cas9-mediated genome editing in apple and grapevine[J]. Nature Protocols,2018,13(12):2844-2863.
[101]Zhou J H,Li D D,Wang G M,et al. Application and future perspective of CRISPR/Cas9 genome editing in fruit crops[J]. Journal of Integrative Plant Biology,2019,62(3):269-286.

