接受體外膜肺氧合治療患者預后的影響因素研究
周亮,邵敏,王昌會,劉念,余超,黃銳,崔良文
體外膜肺氧合(ECMO)是對常規治療難以治愈的嚴重循環衰竭或呼吸衰竭患者的一種生命支持療法[1],其可以通過增加氧輸送和組織灌注來穩定生命體征,為患者心肺功能恢復爭取時間[2]。近年來ECMO的應用挽救了大量患者的生命,有研究選取2009-10-01至2017-03-31將ECMO作為心肺支持治療的692例成年患者,其住院期間死亡率為40.0%,1、2、5年死亡率分別為45.1%、49.0%、57.4%[3]。較高的死亡率提示具有某些特征的患者未能從ECMO中獲益,而尋找出這些特征非常必要,但目前絕大多數研究未涉及此領域。本研究旨在分析接受ECMO治療患者預后的影響因素,以期為ECMO的臨床應用提供依據。
本研究創新點:
雖然近年來體外膜肺氧合(ECMO)治療越來越廣泛,每年接受ECMO治療的患者例數也越來越多,然而許多研究主要關注ECMO治療后的并發癥或者不同的置管途徑,而對接受ECMO治療患者的急性生理學指標關注較少。在使用ECMO治療心肺功能衰竭患者之前,通過不同生理指標的分析,找出并更有效地利用ECMO去治療能夠明顯獲益的患者,這不僅能夠獲得較好的社會效應,而且會減輕社會經濟負擔,而這也是本文所關注和研究的重點。
1 對象與方法
1.1 研究對象 回顧性選擇2018-01-01至2020-02-01安徽醫科大學第一附屬醫院績溪路病區和高新病區重癥醫學科患者35例為研究對象。收治途徑包括自外院直接轉入重癥醫學科,自本院普通病房轉入重癥醫學科,從急診搶救室直接收入重癥醫學科。納入標準:符合ECMO治療的適應證,包括:(1)各種原因引起的其他治療無效的嚴重心源性休克[4],如急性暴發性心肌炎[5]、急性心肌梗死、膿毒癥心肌抑制、應激性心肌病、兒茶酚胺性心肌病、心臟手術后、心臟移植術后。(2)各種原因引起的嚴重急性呼吸衰竭[6],如重度急性呼吸窘迫綜合征(ARDS)[7]、危及生命的哮喘[8]、肺移植前肺臟替代治療、肺移植后原發性移植物功能衰竭、彌漫性肺泡出血、肺動脈高壓危象、肺栓塞、嚴重支氣管胸膜瘺等。(3)各種原因引起的嚴重循環衰竭,如膿毒癥休克、凍傷、大面積重度燒傷、藥物中毒、一氧化碳(CO)中毒、溺水、嚴重創傷等。排除標準:(1)開始ECMO治療后24 h內死亡或者自動出院的患者;(2)由于急性氣道梗阻或者為避免急性氣道梗阻預防性進行ECMO治療的患者;(3)在等待器官移植期間,作為供體方使用ECMO維持生命的腦死亡患者;(4)患有不可逆的心、肺病變且無心臟移植術和使用心室輔助裝置的可能[9];(5)患有不可逆的中樞神經系統損傷[9];(6)心搏驟停超過60 min[10];(7)終末期多器官功能衰竭患者。本研究患者均簽署了ECMO治療知情同意書。
1.2 治療方法 所有患者內科治療失敗后選擇ECMO治療。采用Maquet CARDIOHELP-i或者Medtronic公司的Extracorproreal Blood Pumping Console兩款裝置進行ECMO治療。治療方式分為兩種,即靜脈-靜脈體外膜肺氧合(veno-venous extracorporeal membrane oxygenation,VV-ECMO)和靜脈-動脈體外膜肺氧合(veno-arterial extracorporeal membrane oxygenation,VA-ECMO)。首先兩名護士進行套包預充,兩名醫生開始在器械護士的協助下進行經皮穿刺置管。靜脈導管多選擇21 Fr、19 Fr,動脈導管多選擇17 Fr、15 Fr(一般不超過動脈直徑的75%)。穿刺部位:VV-ECMO選擇頸內靜脈-股靜脈插管,VA-ECMO選擇股靜脈-股動脈插管。置管位置:頸內靜脈插管尖端位于頸內靜脈,股靜脈插管尖端位置在下腔靜脈和右心房的交界處。采用胸部X線檢查結合經胸超聲(必要時經食管超聲)定位靜脈插管的尖端位置,股動脈插管尖端一般置于髂動脈處。VA-ECMO常規從股動脈插管處置入8 F遠端灌注管,提供遠端肢體的灌注,置管成功后妥善固定,連接機器,開始進行ECMO治療。VV-ECMO置管成功后調整呼吸機參數為:(1)吸入氧濃度:21%~30%;(2)潮氣量:4~6 ml/kg;(3)驅動壓 <15 cm H2O(1 cm H2O=0.098 kPa);(4)呼吸末正壓:8~12 cm H2O;(5)呼吸頻率:5~10次/min。股靜脈置入導管前3~5 min泵入肝素(30~50 U/kg)(嚴重的凝血功能障礙或血小板減少患者除外),然后采用微量泵維持泵入肝素,肝素泵入期間保持活化部分凝血活酶時間為55~65 s。根據不同的支持力度,ECMO血流量維持在3.5~5.0 L/min。符合以下條件可進行主動撤機:(1)VV-ECMO:原發病已控制;肺部CT明顯改善;吸入氧濃度<40%;氣道峰壓<25 cm H2O;呼吸頻率<30次/min,暫停ECMO治療(關閉氣源),觀察至少1 h,復查血氣分析指標正常。(2)VA-ECMO:血流量降至1 L/min,小劑量血管活性藥物可以維持血液循環,評估結束恢復至原血流量。撤機拔管方式:所有靜脈導管在床邊拔除并縫合切口,然后按壓穿刺部位30 min,再加壓包扎24 h。動脈插管的處理需要前往手術室,在心臟大血管外科醫生手術切開直視下拔除動脈導管,并進行縫合切口,加壓包扎24 h。
1.3 觀察指標 收集患者一般資料,包括性別、年齡、合并癥(包括高血壓、糖尿病)和治療當天急性生理學與慢性健康狀況評分系統Ⅱ(APACHEⅡ)評分、實驗室檢查指標〔包括總膽紅素、肌酐(Cr)、尿素氮、天冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、降鈣素原(PCT)、C反應蛋白、白細胞計數(WBC)、淋巴細胞計數、中性粒細胞計數、球蛋白(GLO)、白蛋白〕及治療方式(VA-ECMO、VV-ECMO)、住院時間、治療時間。統計患者最終結局,包括存活、死亡。部分患者治療后病情仍然不可逆地惡化,家屬在救治無望的情況下放棄治療,其最終結局按照死亡判定。
1.4 統計學方法 采用SPSS 22.0統計學軟件進行數據分析。符合正態分布的計量資料以(±s)表示,兩組間比較采用獨立樣本t檢驗;不符合正態分布的計量資料以M(P25,P75)表示,兩組間比較采用Mann-Whitney U檢驗;計數資料以相對數表示,因總體樣本量<40例,故組間比較采用Fisher's確切概率法;患者住院期間死亡的影響因素分析采用單因素、多因素Cox回歸分析。以P<0.05為差異有統計學意義。
2 結果
2.1 一般情況 35例患者中,男25例(71.4%),女10例(28.6%);平均年齡(56.3±13.9)歲;合并癥:高血壓10例(28.6%),糖尿病5例(14.3%);APACHEⅡ評分(27.7±6.5)分;治療方式:VAECMO 14例(40.0%),VV-ECMO 21例(60.0%);治療時間2~33 d,平均治療時間7(4,11)d;住院時間2~120 d,平均住院時間22(10,34)d;最終結局:存活15例(42.9%),死亡20例(57.1%)。男性患者死亡率為68.0%(17/25),女性患者死亡率為3/10;男性患者死亡率與女性患者死亡率比較,差異無統計學意義(P=0.062)。采用VA-ECMO治療的患者死亡率為6/14,采用VV-ECMO治療的患者死亡率為66.7%(14/21);采用VA-ECMO治療的患者死亡率與采用VV-ECMO治療的患者死亡率比較,差異無統計學意義(P=0.187)。
2.2 存活患者與死亡患者一般資料比較 存活患者與死亡患者男性占比、年齡、高血壓發生率、糖尿病發生率、總膽紅素、Cr、尿素氮、AST、ALT、PCT、C反應蛋白、WBC、中性粒細胞計數、GLO、白蛋白、治療方式、治療時間比較,差異無統計學意義(P>0.05);死亡患者APACHEⅡ評分高于存活患者,淋巴細胞計數低于存活患者,住院時間短于存活患者,差異有統計學意義(P<0.05,見表1)。
2.3 患者住院期間死亡影響因素分析
2.3.1 總體患者住院期間死亡影響因素分析 以患者住院期間最終結局為因變量,分別以Cr、AST、PCT、WBC、GLO為自變量(賦值見表2),進行單因素Cox回歸分析,結果顯示,PCT、WBC、GLO是患者住院期間死亡的影響因素(P<0.05,見表3)。
以患者住院期間最終結局為因變量,Cr、AST、PCT、WBC、GLO為自變量,年齡(賦值:實測值)、性別(賦值:女=0,男=1)、高血壓發生情況(賦值:無=0,有=1)為協變量,進行多因素Cox回歸分析,結果顯示,PCT、WBC是患者住院期間死亡的獨立影響因素(P<0.05,見表3)。

表1 存活患者與死亡患者一般資料比較Table 1 Comparison of general data between surviving patients and dead patients
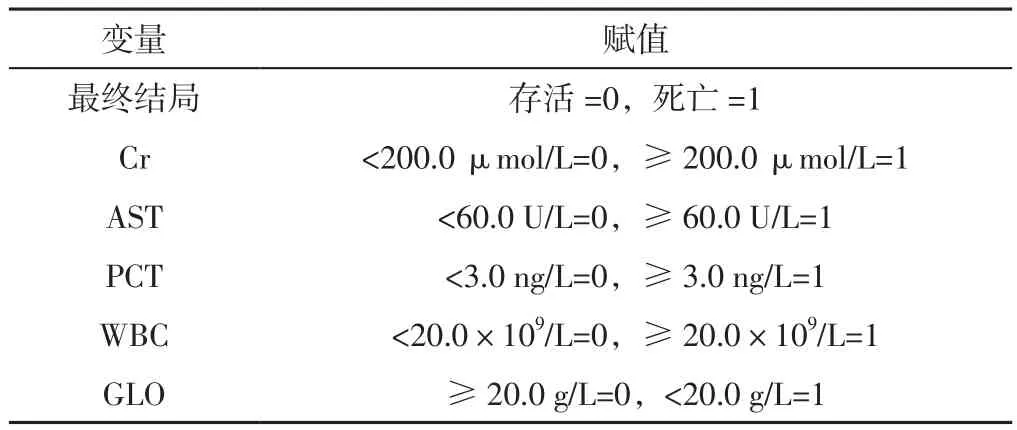
表2 患者住院期間死亡影響因素的Cox回歸分析賦值Table 2 Cox regression analysis assignment for influencing factors of patients' death during hospitalization
2.3.2 不同性別患者住院期間死亡影響因素分析 以男性患者住院期間最終結局為因變量,分別以Cr、AST、PCT、WBC、GLO為自變量(賦值同表2),進行單因素Cox回歸分析,結果顯示,Cr、AST、PCT、WBC是男性患者住院期間死亡的影響因素(P<0.05,見表4)。以男性患者住院期間最終結局為因變量,Cr、AST、PCT、WBC、GLO為自變量,年齡(賦值:實測值)、高血壓發生情況(賦值:無=0,有=1)為協變量,進行多因素Cox回歸分析,結果顯示,Cr、AST、PCT、WBC是男性患者住院期間死亡的獨立影響因素(P<0.05,見表 4)。
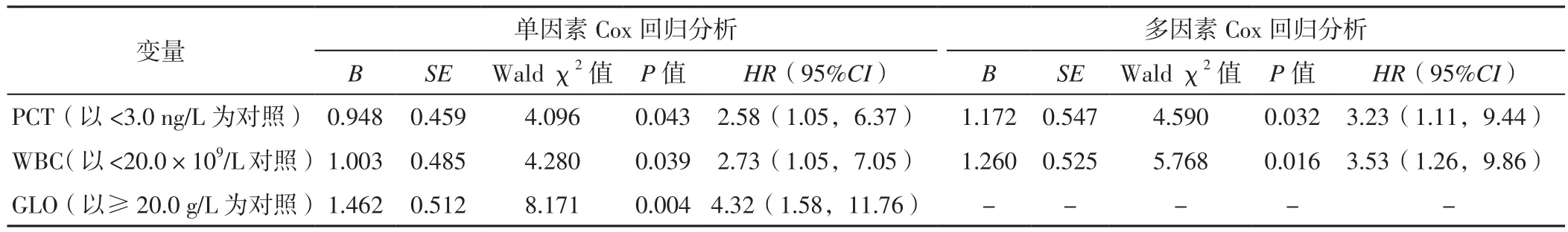
表3 患者住院期間死亡影響因素的Cox回歸分析Table 3 Cox regression analysis of influencing factors of patients' death during hospitalization
以女性患者住院期間最終結局為因變量,分別以Cr、AST、PCT、WBC、GLO為自變量(賦值同表2),進行單因素Cox回歸分析,結果顯示,以上指標均不是女性患者住院期間死亡的影響因素(P>0.05)。以女性患者住院期間最終結局為因變量,Cr、AST、PCT、WBC、GLO為自變量,年齡(賦值:實測值)、高血壓發生情況(賦值:無=0,有=1)為協變量,進行多因素Cox回歸分析,結果顯示,以上指標均不是女性患者住院期間死亡的獨立影響因素(P>0.05)。
3 討論
ECMO治療常用于急性心肌梗死、重癥肺炎等需要心肺支持的患者,盡管近年來其應用還存在爭議,但其已逐漸應用于膿毒癥休克、膿毒癥心肌抑制等患者,用以提高患者的住院生存率[2]。患者預后是ECMO研究的一個方向,2017年來自體外生命支持組織(ELSO)注冊中心的一項研究顯示,ECMO治療4 d或更短時間內的患者死亡率更高[11]。如果通過某些指標在ECMO治療前就能預測患者預后,無疑有利于制定有針對性的治療方案,進而改善患者預后。因此本研究分析了接受ECMO治療患者預后的影響因素,以期為臨床ECMO治療提供依據。
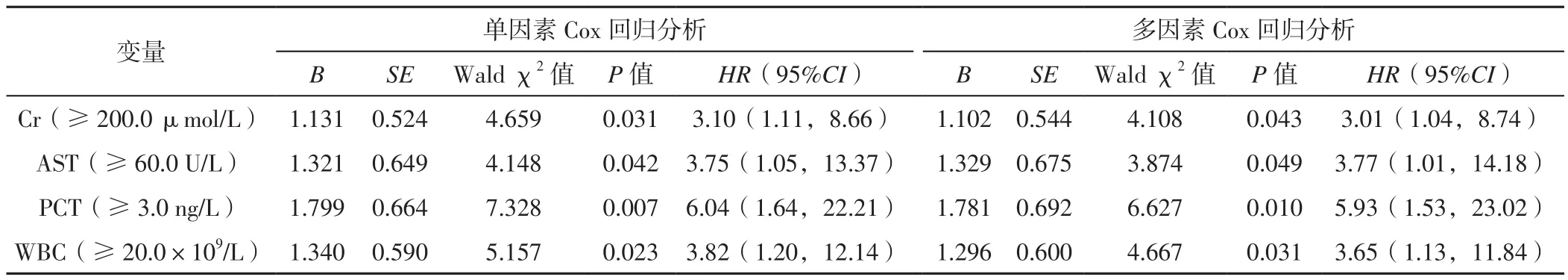
表4 男性患者住院期間死亡影響因素的Cox回歸分析Table 4 Cox regression analysis of influencing factors of death in male patients during hospitalization
APACHEⅡ評分作為ICU死亡率的一項預測指標,具有良好的預測能力[12]。本研究結果顯示,死亡患者APACHEⅡ評分高于存活患者,提示急性生理學與慢性健康狀況可能會影響接受ECMO治療患者的預后。死亡患者住院時間短于存活患者,究其原因主要為ECMO常用于常規治療無效的患者,這類患者病情危重,如能存活其病情恢復耗時長,住院時間也會延長;相反,死亡患者因治療無效很快死亡,因此住院時間短。值得注意的是,與上文提到的2017年來自ELSO注冊中心的研究[11]結果不同,本研究中存活患者和死亡患者治療時間比較無差異,其原因可能與納入研究對象不同有關,如本研究未納入心搏驟停后進行心肺復蘇的同時使用ECMO進行補救治療的患者,此類患者搶救成功率極低,常在治療<24 h甚至數小時內因死亡而終止ECMO治療。
淋巴細胞減少常提示機體處于免疫抑制狀態,有研究顯示,持續性淋巴細胞減少甚至可預測膿毒癥早期和晚期死亡率[13]。ECMO管道植入機體后,其非生理性表面與血液接觸會出現炎性反應,同時ECMO治療時產生的再灌注性損傷也會加重全身炎性反應[14]。因此如果ECMO治療前患者淋巴細胞計數低下,機體將難以應對炎性反應,這也解釋了本研究中死亡患者淋巴細胞計數低于存活患者的原因。本研究結果提示,淋巴細胞計數減少的患者可能難以從ECMO治療中獲益,此時臨床醫師在選擇ECMO治療時需更加謹慎。
臨床中,WBC升高提示機體出現全身或者局部炎性反應。PCT是反映細菌感染和全身炎性反應的生物標志物,與細菌性感染嚴重程度相關[15],其有助于監測膿毒癥患者對治療的反應[16]以及預測膿毒癥患者的預后[17]。本研究結果顯示,PCT、WBC是患者住院期間死亡的獨立影響因素;PCT<3.0 μg/L患者存活率大于PCT≥3.0 μg/L患者,WBC<20.0×109/L患者存活率大于WBC≥20.0×109/L患者。由此可見,一旦出現細菌感染,接受ECMO治療患者的住院死亡風險將會明顯增加,提示ECMO治療前將炎性指標作為判斷依據,有助于評估患者的死亡風險。GLO代表血漿中免疫球蛋白水平,具有激活補體、參與初步免疫應答和再次免疫應答以及參與機體局部黏膜的防御感染等作用[18]。本研究結果顯示,GLO是患者住院期間死亡的影響因素,且GLO<20.0 g/L患者存活率小于GLO≥20.0 g/L患者,但多因素Cox回歸分析并未發現GLO是患者住院期間死亡的獨立影響因素,可能與治療過程中外源性補充GLO提高了血清GLO水平有關。后續可進一步研究GLO水平動態變化對ECMO患者預后的影響。
本研究經過性別分層分析后發現,Cr、AST、PCT、WBC是男性患者住院期間死亡的獨立影響因素,Cr<200.0 μmol/L男性患者存活率大于Cr≥200.0 μmol/L男性患者,AST<60.0 U/L男性患者存活率大于AST≥60.0 U/L男性患者,PCT<3.0 μg/L男性患者存活率大于PCT≥3.0 μg/L男性患者,WBC<20.0×109/L男性患者存活率大于WBC≥20.0×109/L男性患者。其中AST和Cr代表肝功能和腎功能,提示肝腎功能異常可能會對男性患者住院死亡風險產生影響。Cr、AST、PCT、WBC、GLO均不是女性患者住院期間死亡的獨立影響因素,應該與本研究中女性患者數量太少有關。后續研究需要收集更多的樣本量進一步分析。
綜上所述,ECMO治療當天PCT、WBC是患者住院期間死亡的獨立影響因素,ECMO治療當天Cr、AST、PCT、WBC是男性患者住院期間死亡的獨立影響因素。
作者貢獻:周亮負責文章的構思設計、可行性分析,文獻資料和數據的收集、整理,統計學處理和結果的分析、解釋,撰寫論文;周亮、邵敏負責論文、英文的修訂,對文章整體負責、監督管理;邵敏、王昌會負責文章的質量控制和審校;劉念、余超、黃銳、崔良文協助文獻資料的收集。
本文無利益沖突。
本研究局限性:
(1)納入研究的患者例數較少,后續可增加患者例數進一步分析。(2)體外膜肺氧合(ECMO)基礎治療方式分為兩種:靜脈-靜脈體外膜肺氧合(VVECMO)和靜脈-動脈體外膜肺氧合(VA-ECMO),今后研究可根據疾病分類或者ECMO治療方式的不同來討論不同生理指標對ECMO患者預后的影響。

