剪切波彈性參數與乳腺癌免疫組化表達的相關性
曹春莉 李軍 童瑾 曹玉文 董建 杜婷婷
1石河子大學醫(yī)學院第一附屬醫(yī)院超聲科(新疆石河子832008);2石河子大學醫(yī)學院病理教研室(新疆石河子830000)
乳腺癌為絕大多數(83%)國家最常被診斷的癌癥,其發(fā)病率遠高于其他癌癥[1-2]。隨著乳腺癌分子生物學的發(fā)展及個體精準化治療要求的不斷提高,以乳腺癌基因特征為基礎的免疫組化及分子分型越來越受到學者的關注,研究者們試圖通過評估影像學的表現預測乳腺癌免疫組化表達及分子分型的作用[3-4]。聲觸診組織量化成像(virtual touch tissue imaging quantification,VTIQ)技術作為較新的剪切波彈性成像技術,可瞬時獲取感興趣區(qū)域的剪切波速度值(shear wave velocity,SWV),通過剪切波速度大小反應組織的硬度[5]。大量國內外研究證實[6-7],在獲得的眾多剪切波彈性參數中,剪切波速度最大值(SWVmax)可重復性及診斷效能最高。本研究通過采用剪切波彈性成像技術,探討剪切波彈性參數SWVmax 與免疫組織化學指標表達及分子分型之間的相關性,以期尋找術前無創(chuàng)性反映乳腺癌生物學特征的影像學指標,為乳腺癌治療策略的選擇及預后的判斷提供一定的參考價值。
1 資料與方法
1.1 一般資料收集2017年6月至2019年6月在我院行乳腺癌手術且術后病理證實為乳腺癌并行免疫組織化學檢查的患者110例(共114個乳腺腫塊),患者年齡27~81歲;所有患者術前均接受常規(guī)超聲及VTIQ技術檢查;超聲檢查時間與手術時間的間隔不超過兩周。排除標準:腫塊最大直徑>40 mm或<5 mm;VTIQ 剪切波彈性成像技術成像中質量模式顯示為中或低的腫塊;檢查前接受過穿刺活檢的腫塊;檢查前接受過治療的腫塊(放化療、內分泌治療);經病理證實的惡性腫塊未進行免疫組織化學指標的檢測。
1.2 剪切波彈性成像技術檢查選用德國Siemens ACUSON S3000 彩色多普勒超聲診斷儀,L9-4 線陣探頭。患者取仰臥位,充分暴露雙乳及腋窩區(qū)域,采用放射狀連續(xù)性掃查法行常規(guī)超聲檢查,觀察腫塊的大小、形態(tài)、縱橫比、鈣化及血流情況等,然后啟動VTIQ 模式,檢測深度為4 cm,有效取樣范圍4.0 cm×2.5 cm,取樣框兩側界包括病灶周邊至少5 mm的范圍,首先在“質量模式”下觀察剪切波質量,病灶為均勻綠色進入“速度模式”,以病灶周圍背景組織呈現均勻淺藍色或淡綠色,病灶內部呈現紅色或黃色為標準,獲得最終的VTIQ 剪切波彈性成像速度模式圖像。根據顏色不同,將ROI 取樣框(1 mm×1 mm)分別置于病灶SWV 最高區(qū)域、最低區(qū)域、腫塊邊緣、中間區(qū)域和周圍腺體。記錄剪切波速度最大值(SWVmax),單位為m/s。所有測量均重復5次,最后取平均值。測量時保持探頭與掃查部位垂直,注意避開鈣化或液化壞死區(qū)域。
1.3 免疫組化、分子分型標準雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)以腫瘤細胞核出現棕黃色顆粒,著色陽性細胞數≥1%為陽性[8]。人類表皮生長因子2(human epidermal growth factor receptor-2,HER-2)以細胞膜中出現棕黃色或黃色顆粒為陽性細胞,分為四個等級:0、1+、2+、3+。3+判斷為HER-2陽性,0和1+判斷為HER-2陰性,2+者需進一步應用原位熒光雜交方法進行HER-2 基因擴增狀態(tài)檢測,基因擴增者為陽性,未擴增者為陰性[9]。Ki-67以腫瘤細胞核出現棕黃色顆粒,著色陽性細胞數<14%為低表達,≥14%為高表達[10]。
分子分型分類根據2017年St.Gallen 乳腺癌共識[11],分為以下四種亞型:(1)Luminal A型:ER(+)和(或)PR(+)、HER-2(-)、Ki-67表達<14%;(2)Luminal B型:HER-2陰性型:ER(+)和/或PR(+)、HER-2(-)、Ki-67表達≥14%;HER-2陽性型:ER(+)和(或)PR(+)、HER-2(+)、Ki-67 任何水平;(3)HER-2過表達型:ER(-)和PR(-)、HER-2(+);(4)三陰型(Triple negative breast cancer,TNBC):ER(-)、PR(-)、HER-2(-)。
1.4 統(tǒng)計學方法采用SPSS 22.0統(tǒng)計分析。計數資料以例(%)表示,采用χ2檢驗,對于滿足正態(tài)分布的計量資料以均數±標準差表示,兩組計量資料比較采用獨立樣本t檢驗;滿足正態(tài)性、方差齊性的多組計量資料比較采用單因素方差分析,多重比較采用LSD-t檢驗。不符合正態(tài)分布的數據采用中位數(四分位數)表示。腫瘤大小、年齡與SWVmax值的相關性分析采用Pearson 相關,將所有相關及差異顯著的自變量納入多元線性回歸分析,采用“逐步回歸分析”的方法,確定最后進入方程的自變量,評估對SWVmax值影響的因素。以P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 臨床資料選取女性乳腺癌患者110例(共114個腫塊),癌灶大小0.6~3.9 cm,平均大小(1.91±0.98)cm。114個乳腺癌腫塊中,80個為浸潤性導管癌,10個為導管原位癌,9個為導管內乳頭狀癌,7個為浸潤性小葉癌,5個為粘液癌,3個為髓樣癌。免疫組織化學標志物表達情況:ER表達陽性68個,ER表達陰性46個;PR表達陽性50個,PR表達陰性64個;HER-2表達陽性41個,HER-2表達陰性73個;Ki-67 低表達45個,Ki-67 高表達69個;分子亞型情況:Luminal A型35個,Luminal B型52個(HER-2陰性型27個,HER-2陽性型25個),HER-2過表達型16個,TNBC型11個。
2.2 乳腺癌SWVmax值與腫瘤大小、患者年齡的相關性分析114個乳腺癌腫塊的SWVmax值為1.73~10.0 m/s,平均(5.74±1.87)m/s。Pearson 相關分析結果顯示,SWVmax值與癌灶大小呈正相關(圖1,r=0.636,P<0.05);SWVmax值與患者年齡不相關(圖1,r=0.008,P>0.05)。SWVmax值與癌灶大小之間的直線方程為:y=3.443+1.203x,(R=0.636,P<0.05)。
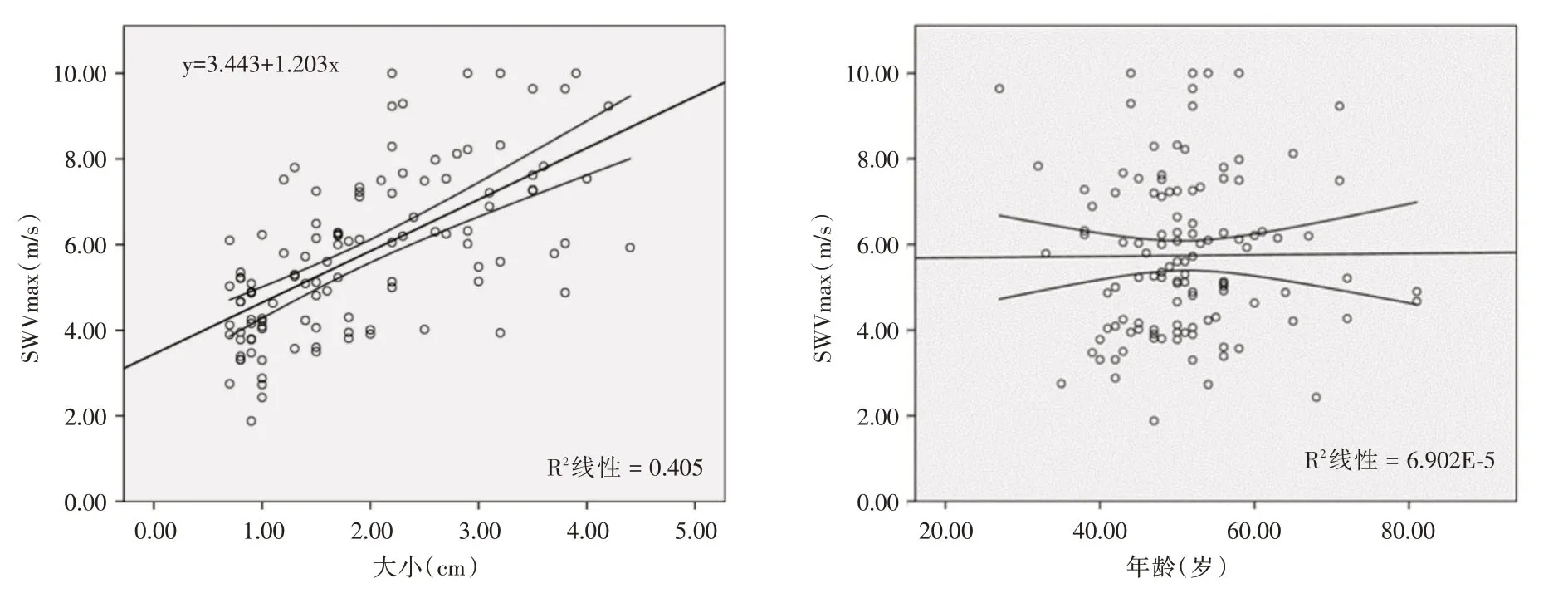
圖1 SWVmax值與癌灶大小、患者年齡的相關性散點圖Fig.1 Scatter diagram of correlation between swvmax value and tumor size,patient′s age
2.3 乳腺癌不同免疫組織化學指標表達SWVmax值的比較采用獨立樣本t檢驗對乳腺癌不同免疫組織化學指標的表達SWVmax值進行比較,結果發(fā)現:HER-2陽性表達組SWVmax值高于陰性表達組,Ki-67 高表達組SWVmax值高于低表達組,且差異均有統(tǒng)計學意義(均P<0.05)。SWVmax值在ER表達陽性組與陰性組之間、PR 陽性表達組與陰性表達組之間差異無統(tǒng)計學意義(均P>0.05,表1)。
2.4 乳腺癌不同分子分型之間腫塊SWVmax值的比較單因素方差分析結果顯示:乳腺癌不同分子亞型的腫塊間SWVmax值差異有統(tǒng)計學意義(F=10.208,P<0.05),其中Luminal B型中的HER-2陽性型及HER-2過表達型的SWVmax值較高,兩者之間差異無統(tǒng)計學意義(t=1.159,P=0.071),其次是Luminal B型中的HER-2陰性型及TNBC型,Luminal A型SWVmax值最低,即SWVmax值排序為:Luminal B(HER-2陽性型)型、HER-2過表達型>Luminal B(HER-2陰性型)型、TNBC型>Luminal A型(表2、圖2-4)。
2.5 各個相關指標的多元線性回歸分析將上述各項指標作為自變量,以SWVmax值作為因變量,進行多元線性回歸分析,結果顯示SWVmax值與乳腺癌腫塊大小、Ki-67表達、HER-2表達情況存在線性相關,標準化回歸系數分別為:0.496、0.258、0.213(均P<0.05),表明乳腺癌腫塊大小對腫塊彈性硬度值SWVmax 影響最大,Ki-67表達、HER-2表達對腫塊彈性硬度值SWVmax 影響次之(表3)。

表1 乳腺癌不同免疫組織化學指標表達SWVmax值的比較Tab.1 Comparison of SWVmax values expressed by different immunohistochemistry indexes in breast cancer
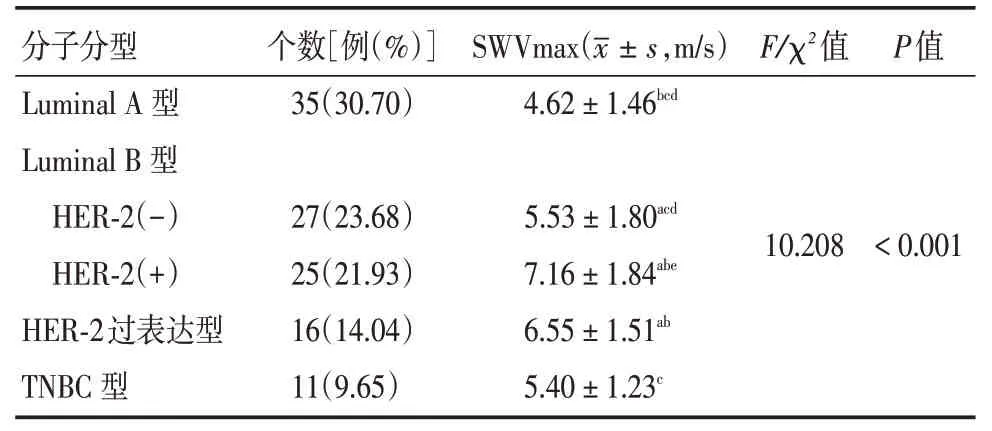
表2 乳腺癌不同分子分型之間腫塊SWVmax值的比較Tab.2 Comparison of SWVmax values of different molecular types of breast cancer
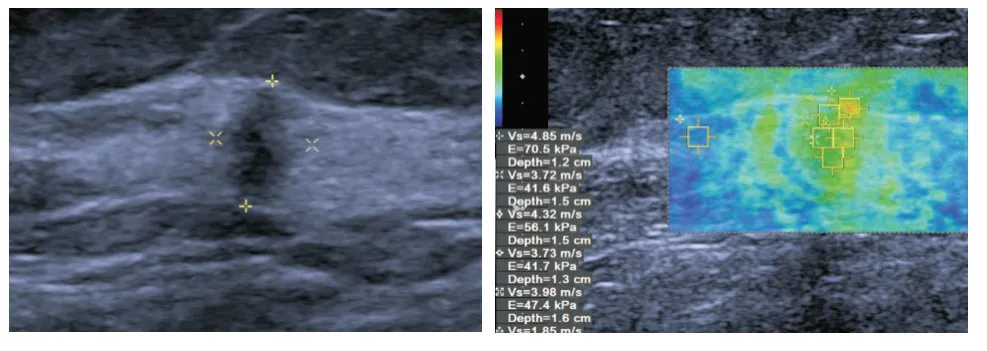
圖2 女,62歲,SWVmax值為4.85 m/s,病理結果為乳腺浸潤性導管癌,ER(+)、PR(-)、HER-2(-)、Ki-67(-),分子分型為Luminal A型Fig.2 Female,62 years old,SWVmax value is 4.85 m/s,pathological result is invasive ductal carcinoma of breast,ER(+),PR(-),HER-2(-),Ki-67(-),molecular type is Luminal A
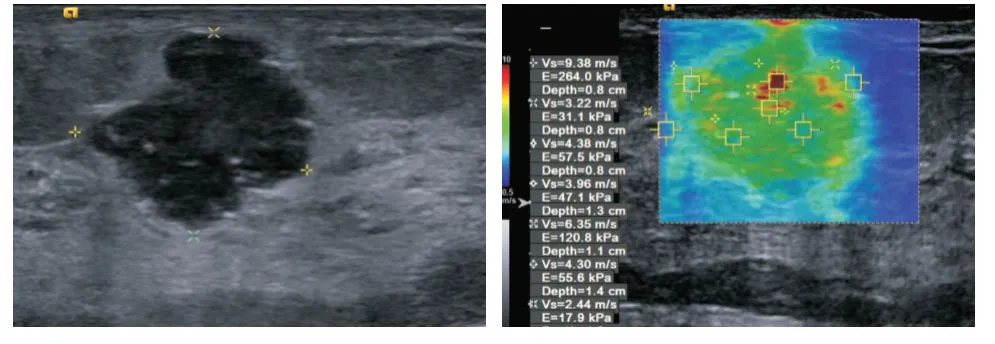
圖3 女,56歲,SWVmax值為9.38 m/s,病理結果為乳腺浸潤性導管癌,ER(-)、PR(-)、HER-2(+)、Ki-67(+),分子分型為HER-2過表達型Fig.3 Female,56 years old,SWVmax value is 9.38 m/s,pathological result is invasive ductal carcinoma of breast,ER(-),PR(-),HER-2(+),Ki-67(+),molecular type is HER-2 overexpression
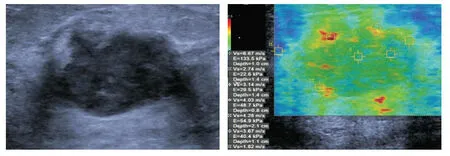
圖4 女,52歲,SWVmax值為6.67 m/s,病理結果為乳腺浸潤性導管癌,ER(-)、PR(-)、HER-2(-)、Ki-67(+),分子分型為TNBC型Fig.4 Female,52 years old,SWVmax value is 6.67 m/s,pathological result is invasive ductal carcinoma of breast,ER(-),PR(-),HER-2(-),Ki-67(+),molecular type is TNBC
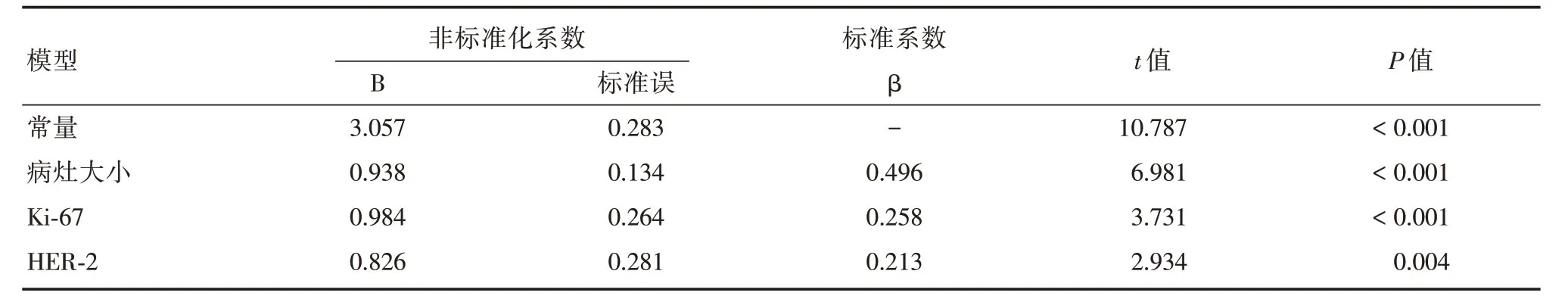
表3 乳腺癌腫塊SWVmax值與各相關因素的多元線性回歸分析Tab.3 Multiple linear regression analysis of SWVmax value and related factors of breast cancer mass
3 討論
乳腺組織力學性質的變化與疾病進展相關,乳腺癌在發(fā)生發(fā)展的過程中,其硬度隨之發(fā)生改變,在這些變化中,細胞外基質在乳腺癌組織中的異常沉積使基質逐漸變硬,對乳腺癌的侵襲生物學有重要的調節(jié)作用[12]。因此,腫瘤硬度的定量評估可以增加有用的信息,類似于異質性乳腺癌的預后特征。大量研究發(fā)現[6-7],在獲得的眾多剪切波彈性參數中,SWVmax值可重復性及診斷效能最高,是評價乳腺良惡性腫塊的最佳定量參數。
研究結果顯示SWVmax值與癌灶大小呈正相關(r=0.636,P<0.05),即隨著腫塊的增大,SWVmax值逐漸增大。本研究得出的多元線性回歸方程中,腫塊大小的標準化回歸系數最大(0.496),表明腫塊大小對SWVmax值的影響程度最大,與賈美紅等[13]研究結果一致。隨著腫瘤的生長,腫瘤細胞不斷增殖,新生血管不斷增加,間質水腫情況更加明顯,腫瘤細胞的不斷生長及浸潤更易引起內部及周圍結締組織增生性反應,這些均導致腫塊硬度增加。CHAMMING 等[14]嘗試用剪切波彈性技術檢測22例人乳腺癌腫瘤移植模型在生長過程的硬度值,并與病理結果進行相關性分析,結果顯示,硬度值與腫瘤生長過程中的大小具有很好的相關性(r=0.94,P<0.000 1)。
本研究的單因素分析和多因素分析均顯示HER-2及Ki-67表達對SWVmax值均有影響。HER-2過表達時,腫瘤細胞增生比較活躍,腫瘤細胞代謝所需要的氧氣及能量供應相對不足,同時會導致內部鈣質的分泌,致使腫瘤內部出現鈣化,因此會導致硬度值的增加[15]。研究[16]證實,HER-2 與血管內皮生長因子具有顯著的相關性,其可以上調血管內皮生長因子的表達,當HER-2過表達時,腫瘤內部的VEGF 活性表達增加,促進腫瘤內部新生血管的生成,促進腫瘤細胞的增殖,因此新生血管生成可能在一定程度上促進腫瘤硬度的增加。另有研究[12]認為,HER-2在細胞外膠原基質硬度與細胞內硬度間的機械力傳導中有重要作用,增加細胞內硬度和對細胞外基質硬度的細胞內機械敏感性。Ki-67的表達程度也對SWVmax值有影響,隨著Ki-67表達程度的增高,SWVmax值逐漸增大,與其他研究[17]結果一致。Ki-67表達增強時,處在細胞周期為活躍期的細胞明顯增多,細胞增長迅速,腫瘤細胞不斷向細胞外基質黏附和侵襲,細胞外基質纖維粘連蛋白結構和功能發(fā)生變化導致腫塊與周圍組織發(fā)生粘連,因此,腫塊彈性降低導致硬度值增加。也有研究[18-19]認為,腫瘤硬度與Ki-67表達程度之間的潛在機制可能是由Ki-67 高表達的腫瘤血管特性導致的,硬度的機械特性與腫瘤細胞和微血管密度相關。在本研究中,ER、PR 陽性表達組與陰性組之間乳腺癌腫塊SWVmax值差異無統(tǒng)計學意義。ER、PR 陽性表達與腫瘤微鈣化形成呈正相關,微鈣化的形成可導致腫塊硬度值增加[20]。有研究[21]認為,乳腺癌ER、PR 陰性表達與HER-2表達呈正相關,上述研究已證實HER-2表達陽性的乳腺癌具有更高的硬度。因此,ER、PR 陽性表達和陰性表達都有可能在一定程度上導致腫塊硬度的增加。
本研究結果顯示,不同分子分型組間SWVmax值存在顯著差異,其中Luminal B型中的HER-2(+)及HER-2過表達型的SWVmax值較高,Luminal A型SWVmax值最低。HER-2過度表達的乳腺癌腫瘤周邊膠原結締組織不斷增生、VEGF 活性表達增加及腫瘤內部出現鈣化,這些均可以導致腫塊的硬度增加。此外,YANAGAWA 等[22]研究認為,Luminal B型(HER-2陽性型)、HER-2過表達型和TNBC型腫瘤比Luminal A型和Luminal B型(HER-2陰性型)型腫瘤具有更大的非整倍體和染色體不穩(wěn)定性,具有這些特征的腫瘤具有更高的增殖活性和更差的預后。本研究多因素分析顯示SWVmax值與不同分子分型間無統(tǒng)計學上的顯著相關性,與GANAU 等[23]研究結果一致,而樊智穎等[17]則認為浸潤性導管癌Emean 在4種分子分型中差異有統(tǒng)計學意義。可能與本研究納入的病例數量相對較少有關,本研究分子分型分類有限,其中TNBC 亞型只有11例,因納入的數量較少,很難對它們的硬度形成明確的結論,因此尚需擴大樣本量進一步去證實兩者之間的關系。
綜上所述,剪切波彈性成像參數SWVmax值與一些乳腺癌預后相關的免疫組化表達具有相關性,剪切波彈性成像參數SWVmax值可以在一定程度上作為無創(chuàng)性反映乳腺癌生物學特征的影像學指標,剪切波彈性成像技術可能為乳腺癌治療策略的選擇及預后的判斷提供一定的參考依據。

