siRNA沉默NOK基因抑制腦膠質瘤U251細胞增殖與侵襲①
吳榮強 孫穎盺 張 平 宗 明
(南京醫科大學附屬常州二院檢驗科,常州 213004)
腦膠質細胞瘤是中樞神經系統最常見的惡性腫瘤,其基因治療的瓶頸之一是無法找到關鍵治療靶點。NOK(novel oncogene with kinase-domain)基因是 2004 年從人扁桃體癌中克隆的全新癌基因,屬于受體型酪氨酸蛋白激酶(receptor protein tyrosine kinases,RPTKs)家族成員,與成纖維細胞生長因子受體(fibroblast growth factor receptor,FGFR)和血小板衍生生長因子受體(platelet-derived growth factor receptor,PDGFR)具有20%~30% 的同源性,與表皮生長因子受體(epidermal growth factor receptor,EGFR)具有共同的下游信號通路[1,2]。既往研究證實NOK基因在人腦膠質細胞中高表達,且其表達與腦膠質細胞瘤的惡性程度呈正相關,提示NOK表達對維持腦膠質瘤的惡性生物學特性具有重要作用[3]。但NOK基因如何通過胞外信號進行激活的機制尚未明確。為此,本研究應用siRNA技術干擾NOK基因表達,探討其對膠質瘤細胞U251生長、侵襲及凋亡的影響,闡明NOK基因在腦膠質細胞瘤中的作用機制。
1 材料與方法
1.1材料 人膠質瘤細胞株U251購自基爾頓生物科技有限公司;DMEM培養基和Opti-MEM培養基購自Gibico公司;胎牛血清購自Hyclon公司;轉染試劑脂質體lipofectamineTM2000和Trizol reagent均購自Invitrogen公司;RNA逆轉錄采用M-MLV Reverse Transcriptase購自Promega公司;CellTiter96 Aqueous One Solution Reagent (MTS試劑)購自Promega公司;SYBR?Premix Ex Taq 試劑盒購自TaKaRa公司;AnnexinV-FITC/7-AAD細胞凋亡檢測試劑盒購自南京凱基生物科技發展有限公司;NOK antibody (ab97451)、Cyclin D1 antibody (ab16663)購自Abcam公司;Phospho-Akt Pathway Antibody Sampler Kit (#9916)購自CST公司;siRNA由上海吉瑪公司合成;定量PCR引物由英駿生物技術有限公司合成。
1.2方法
1.2.1siRNA序列設計 NOK siRNA靶序列根據siRNA設計原則及NOK基因的cDNA序列(NM_018423.3)設計,使用Ambion公司在線設計軟件設計針對NOK基因編碼區的干擾核苷酸鏈2對,序列經BLAST同源序列分析后由公司合成。篩選出2組siRNA進行實驗,分別為:si-578:Oligo1,5′-CCAGGAGAAGCAGUAUGAAGUGAUUTT-3′,Oligo2,5′-AAUCACUUCAUACUGCUUCUCCUGGTT-3′;si-996:Oligo1,5′-CAAGAUUUCUUAGGGCGAAUCC-AAUTT-3′,Oligo2,5′- AUUGGAUUCGCCCUAAGAA-AUCUUGTT-3′。
1.2.2脂質體介導NOK siRNA轉染U251細胞 DEPC水將siRNA溶解為20 μmol/L的母液,轉染前24 h以1×105個/ml 接種于6 孔板,次日轉染時細胞融合度達60%~70%。設置空白對照組和siRNA組,按比例混勻 opti-MEM和LipofectamineTM2000,靜置5 min,另按比例配制opti-MEM和20 pM siRNA,混合后室溫放置20 min,將細胞換成不含抗生素培養液,加入上述混合液搖勻,4~6 h后換成含有10%胎牛血清的DMEM培養液。
1.2.3熒光定量PCR檢測NOK mRNA水平 細胞轉染siRNA 48 h后,提取RNA,逆轉錄為cDNA,根據cDNA序列設計引物。NOK-F:5′-CGTTCTGGACCTCAAGGCAT-3′,NOK-R:5′-ACCACTGCAAATCTGCTCCA-3′,參比基因GAPDH-F:5′-ACCATGGGGAAGGTGAAG-3′,GAPDH-R:5′-AATGAAGG-GGTCATTGATGG-3′。按照SYBR?Premix Ex TaqTM試劑盒說明書配制50 μl反應體系,熒光定量PCR儀擴增。反應條件為:95℃ 10 s,95℃ 5 s,65℃ 34 s二步法擴增40循環,溶解曲線分析采用95℃ 15 s; 60℃ 30 s,95℃ 15 s;解離時間為4 s。NOK相對表達量用2-△△Ct表示,△Ct=CtNOK- CtGAPDH,△△Ct=△Ct樣本-△Ct參考樣本。
1.2.4Western blot檢測NOK、Cyclin D1蛋白表達變化及AKT磷酸化水平 細胞轉染NOK siRNA 48 h后加入細胞裂解液提取蛋白,經蛋白定量后,Western blot檢測各組NOK(1∶300)、Cyclin D1(1∶100)、AKT(1∶1 000)和P-AKT(1∶1 000)蛋白表達。
1.2.5MTS法檢測細胞增殖 調整各組細胞濃度為1×104個/ml,置于96孔板(100 μl/孔),每隔24 h測定1次MTS。測試時,每孔加入20 μl CellTiter96 Aqueous One Solution Reagent孵育4 h后于酶標儀檢測490 nm處吸光度,繪制增殖曲線。
1.2.6平板細胞克隆形成試驗 取對數生長期的各組細胞,200個/孔加入6孔板,每3~4 d換液,10~14 d后結晶紫染色。染色步驟:PBS洗2次,1 ml甲醇固定20 min,1 ml結晶紫染色20 min,細流水沖洗干凈,干燥后拍照。
1.2.7流式細胞術檢測細胞周期 NOK siRNA轉染48 h后,收集細胞1×106個,PBS洗滌2次(1 000 r/min,5 min),棄上清,70%酒精重懸,調整細胞濃度為1×106個/管,離心,棄上清。加入500 μl PBS重懸細胞和1 μl RNase A,1 000 r/min離心10 min棄上清。加入100 μl PI染色液避光染色10 min,流式細胞儀術檢測細胞周期。增殖指數=(S+G2/M)/(G0/G1+S+G2/M)。
1.2.8Annexin V-FITC/7-AAD 雙染法檢測細胞凋亡率 NOK siRNA轉染U251細胞48 h后,收集細胞,根據Annexin V-FITC/7-AAD雙染法說明書處理樣本,避光染色30 min,流式細胞儀檢測細胞凋亡。
1.2.9Transwell體外侵襲實驗 應用12孔Transwell培養板檢測各組細胞侵襲能力,每組設置3個復孔。上室聚碳酸酯膜Matrigel(3.9 μg/μl)于37℃聚合,各組消化、計數1×105個細胞,無血清DMEM培養基制備成單細胞懸液;下室加入600 μl無血清培養48 h的NIH3T3細胞條件培養液作為趨化因子,培養24 h后,用濕棉簽擦去上室附著細胞,蘇木精染色,封片后顯微鏡下觀察穿膜細胞數。每張膜的中央部分、周圍部分各隨機取3個視野,記錄每個視野內穿過微孔的細胞數。
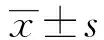
2 結果
2.1NOK mRNA轉錄及蛋白表達的變化 NOK的蛋白表達明顯降低(圖1A)。處理組均出現明顯的基因沉默效應,差異均有統計學意義(P<0.05,圖1B)。

圖1 轉染NOK siRNA對U251細胞中NOK mRNA和蛋白表達的影響Fig.1 Effeet of NOK siRNA on NOK mRNA and protein in U251 cellsNote: Compared with Control and si-NC group,*.P<0.05.
2.2NOK siRNA對U251細胞增殖的抑制作用 MTS法檢測細胞增殖結果顯示,24 h干擾組與對照組細胞生長差異均無統計學意義(P>0.05),48 h后si-578和si-996組顯著抑制U251細胞增殖(P<0.05,圖2A)。平板克隆形成實驗結果顯示,與si-NC組相比,si-578和si-996組細胞克隆數顯著降低(P<0.05,圖2B)。

圖2 NOK siRNA對U251細胞增殖和克隆形成的影響Fig.2 Effect of NOK siRNA on proliferation and colony formation in U251 cellsNote:Compared with Control and si-NC group,*.P<0.05.
2.3NOK siRNA對U251細胞周期的影響 流式細胞術結果顯示,與si-NC組相比,si-578和si-996組中處于S期的細胞明顯減少,G0/G1期細胞明顯增多(P<0.05,圖3A),G2期細胞無明顯變化。Western blot檢測相關周期蛋白表達,結果顯示干擾組AKT磷酸化水平和Cyclin D1蛋白表達均顯著降低(P<0.05,圖3B)。

圖3 NOK siRNA對U251細胞周期和AKT磷酸化的影響Fig.3 Effect of NOK siRNA on U251 cell cycle and AKT phosphorylationNote:Compared with si-NC,*.P<0.05.
2.4NOK siRNA對U251細胞凋亡的影響 流式結果顯示,與對照組相比,si-578和si-996組細胞凋亡率顯著提高(P<0.001,表1);活細胞比率由94.2±8.2降低到79.5±7.6和81.2±6.9(圖4)。

圖4 流式細胞術檢測各組U251細胞凋亡水平Fig.4 Flow cytometry to detect apoptosis level of U251 cells in each group

表1 各組別細胞凋亡指數比較
2.5NOK siRNA對U251細胞侵襲的影響 24 h穿過基質膠并貼于聚碳酸脂膜底面的細胞數分別為si-NC(14.2±4.6)個/HP,si-578(4.1±2.2)個/HP和si-996(6.4±3.7)個/HP,與si-NC組相比,si-578和si-996組細胞侵襲能力顯著降低,差異有統計學意義(P<0.05,圖5)。

圖5 NOK siRNA對U251細胞侵襲能力的影響(×200)Fig.5 Effect of NOK siRNA on cell invasiveness in U251 cellsNote:Compared with si-NC,*.P<0.05.
3 討論
RPTKs在細胞增殖、分化和生長中發揮重要作用,對維持細胞正常功能具有重要意義[4-5]。RPTKs 的表達和活性異常可引起相應信號通路失調從而引發腫瘤。NOK可轉化NIH3T3和BaF3細胞并促進腫瘤形成,誘發腫瘤細胞侵襲并轉移至遠處多個器官[6]。體內和體外實驗顯示NOK能激活MAP激酶和磷脂酰肌醇3-激酶(PI3K)信號通路,促進細胞轉化、腫瘤形成和轉移[7-9]。NOK基因廣泛高表達于多種腫瘤細胞和腫瘤組織,如肺癌、乳腺癌、急性髓系白血病、卵巢癌和前列腺癌等,提示NOK可能蛋白可能對胚胎發育和腫瘤生成具有調控作用[10-13]。臨床研究提示NOK可能在膠質瘤的發生發展中起重要作用。本研究借助siRNA技術初步探索了NOK在人膠質瘤細胞系U251中的部分生物學作用,為進一步了解NOK在膠質瘤細胞的信號傳導通路中的作用提供理論基礎。
腦膠質瘤具有無限增殖和抗細胞凋亡的惡性表型,在其惡性演化過程中,腫瘤細胞密度逐漸增加,核分裂象多見,核異型性明顯[14-15]。其分子遺傳學改變涉及多種癌基因的激活、抑癌基因突變、失活及細胞周期基因和凋亡相關基因改變。研究顯示,NOK可在U251細胞中表達,而siRNA可明顯抑制U251細胞中NOK的轉錄,降低其表達,使U251細胞的生物學特性發生改變。MTS結果顯示si-578和si-996組細胞與si-NC組細胞相比生長明顯變緩(P<0.05);平板克隆形成實驗同樣顯示干擾組與對照組相比克隆形成能力明顯減弱(P<0.05),與目前NOK基因在其他腫瘤方面的研究結果一致[16]。細胞周期分析顯示,si-578和si-996組與si-NC組細胞相比S期細胞數減少,G0/G1期細胞均明顯增多,表明NOK基因調控U251的細胞周期主要是通過G1期的滯留實現的,干擾NOK基因后細胞G0/G1期明顯延長,S期縮短,抑制細胞有絲分裂。干擾NOK基因表達后,AKT的磷酸化水平及Cyclin D1表達均顯著降低。Cyclin D1為G1/S的重要調控蛋白,通過結合并激活G1期特有的周期蛋白依賴性激酶CDK4,G1期周期抑制蛋白(Rb)被磷酸化,磷酸化的 Rb 蛋白從其所結合的 E2F 轉錄因子上解離,從而推動細胞周期由G1期進入S期。既往研究證實NOK基因可引起BaF3細胞中RAS/MAPK和PI3K通路活性上調[7]。RAS/MAPK和PI3K通路是調節細胞有絲分裂的重要途徑,其活性上調可促進細胞增殖。PI3K/AKT為Cyclin D1上游重要的調控信號通路[17]。本研究中干擾組細胞中AKT磷酸化水平和Cyclin D1表達水平均顯著降低,推測NOK基因可能通過激活AKT信號調控Cyclin D1,促進膠質瘤細胞的生長和增殖,課題組將進一步證實。逃避各種因素誘導的凋亡是膠質瘤細胞促進其惡性進展又一特征。本研究顯示干擾組U251凋亡明顯增加,說明NOK基因在膠質瘤細胞的發生發展中起重要作用。體內外腦膠質瘤侵襲模型研究發現,腫瘤周邊的膠質瘤細胞表現出較強的侵襲能力,可脫離腫瘤實體移行較遠距離,是造成腦膠質瘤手術難以徹底切除和術后復發的重要原因。研究顯示,NOK siRNA處理組的細胞侵襲能力明顯下降,側面證實NOK基因在人腦膠質瘤細胞的遷移和侵襲中起重要作用。NOK基因具有與EGFR有共同的下游信號通路,能夠誘發腫瘤,促進其增殖和分化,這些功能可能是通過激活EGFR下游信號通路,如 RAS/MAPK、PI3K/AKT 和 STAT 等信號通路實現的。
綜上所述,干擾NOK基因表達后可在體外顯著抑制腦膠質瘤細胞U251生長、增殖及侵襲,促進細胞凋亡,為明確NOK調控人腦膠質瘤的發生發展機制奠定基礎。

