紫娟茶樹bHLH轉錄因子MYC1基因克隆及表達分析
曲 浩,劉 悅,孫云南,尚衛瓊,田易萍,陳林波
(云南省農業科學院茶葉研究所,云南省茶學重點實驗室,云南勐海666201)
紫娟茶樹(Camellia sinensiscv.Zijuan)具有紫色新梢、紫色嫩葉等特征,其中含有大量花青素,具有很好的保健作用[1]。但是紫娟茶樹在不同區域種植會發生新梢、嫩葉變綠現象,從而影響茶葉的品質[2]。紫娟芽葉色澤呈現紫色和高含量花青素是評價其茶葉品質的重要指標。研究發現[2],紫娟葉片發育成熟后顏色由紫變綠,原因可能是由于花青素等內含物質發生了變化;有研究表明,結構基因決定花青素苷的種類,而調控基因編碼的轉錄因子決定結構基因表達與否及強弱,影響花青素合成的量[3-4]。
目前,已從紫葡萄、紫紅薯、越橘等植物中分離克隆了大量與花青素合成代謝相關的結構基因與調控基因[5-7]。bHLH轉錄因子功能涉及黃酮類生物合成、花器官形成及表皮細胞的形成[8-10]。有研究發現,蘋果中bHLH蛋白MdbHLH3和MdbHLH33是R2R3-MYB類轉錄因子,MdMYB10有效誘導花青素合成蛋白依賴于MdbHLH3和MdbHLH33的共同表達[11];在玉米中,bHLH蛋白與MYB轉錄因子C1、PL1協作參與調控花青素合成信號通路[12]。MYC1基因是bHLH家族中的重要成員,目前的研究表明,MYC1基因在葡萄中參與類黃酮類化合物的調控[8]。此外,MYC1基因參與了花青素的調節與原花青素的生物合成,能夠與不同的MYB轉錄因子協同調控花青素合成信號通路[13]。
本研究基于前期對紫娟茶樹的轉錄組測序,發現了MYC1基因在葉片中的表達差異,對MYC1基因進行克隆得到其完整序列,采用生物信息學軟件對19個MYC1同源基因進行進化樹的構建,并對紫娟MYC1與葡萄vvMYC1氨基酸序列進行比對分析;此外,采用實時熒光定量PCR對不同光質照射下及不同空間生長的紫娟葉片中MYC1基因進行檢測,以明確MYC1基因的生物學功能和表達特性,為進一步研究MYC1基因對花青素合成的調控機制提供參考。
1 材料和方法
1.1 試驗材料
供試材料選用云南省農業科學院茶葉研究所培育的紫娟茶樹葉片。基因克隆試驗材料選取第二葉進行;不同光質照射實時熒光定量PCR分析選取第二葉為材料;基因空間表達實時熒光定量PCR分析選取芽、第二葉、開面葉、成熟葉為材料。采集的樣品于-80℃冰箱保存。
1.2 方法
1.2.1 紫娟茶樹MYC1基因的克隆 根據獲得的MYC1基因片段序列信息,采用DNAstar軟件設計引物;采用RACE方法對MYC1基因片段3′端和5′端進行克隆,拼接驗證后獲得全長cDNA。
1.2.2 生物信息學分析 在NCBI網站(http://www.ncbi.nlm.nih.gov/)上完成核苷酸和蛋白序列比對分析;用Protparam工具進行基因編碼蛋白理化性質分析;采用SignalP預測氨基酸序列信號肽;采用ProtScale進行親水性分析;采用ProtCompv.9.0進行亞細胞定位分析;采用MEGA7軟件進行MYC1相關基因進化樹的構建;利用SWISS-MoDEL預測蛋白質三維結構。
1.2.3 實時熒光定量PCR檢測 用自然光、綠光、藍光、黃光、紫光分別處理紫娟茶樹,并采集芽、第二葉、開面葉、成熟葉,采用植物總RNA抽提純化試劑盒提取RNA,以反轉錄后所得的cDNA為模板,GAPDH作為內參基因,采用SYBR法進行實時熒光定量PCR檢測。GAPDH所用引物序列為GAPDH-F:5′-GATAGTGTTCACGGTCAATGGA-3′和 GAPDH-R:5′-TATCCTTATCAGTGAAGACACC AGT-3′;MYC1所用引物為 MYC1-F1:5′-TCTTTC CCTCCTGGTGTTGG-3′和 MYC1-R1:5′-GCACTCT TGGCGAGAATAGCT-3′。
2 結果與分析
2.1 MYC1基因的克隆
以紫娟茶樹葉片的基因組DNA為模板,克隆獲得紫娟茶樹MYC1基因的全長為2 576 bp,其中,A堿基657個,占25.5%;G堿基677個,占26.28%;C堿基653個,占25.35%;T堿基589個,占22.86%。研究還發現,常見的酶切位點222個,另外,MYC1基因包含一個2 307 bp的完整開放閱讀框(ORF),編碼768個氨基酸,蛋白質理論分子量為85.26 ku,理論等電點為4.63;預測分子式為C3752H5938N1062O1180S23,原子總數為11 955,脂溶系數78,不穩定系數66.44,屬于不穩定蛋白質(圖1)。
2.2 MYC1基因生物信息學分析
2.2.1 進化樹分析 選取15個不同物種MYC1和3個茶樹bHLH家族基因的核苷酸序列與紫娟MYC1的核苷酸序列進行同源比對分析,并利用MEGA7軟件構建進化樹,結果表明,它們都屬于IIIf亞類,紫娟茶樹MYC1與葡萄vvMYC1、茶樹bHLH1、茶樹MYC2以及番茄SIMYC1具有較高的同源性(圖 2)。
2.2.2 蛋白疏水性分析及信號肽預測 將推測的氨基酸序列導入ProtScale工具進行蛋白一級結構的親/疏水性預測,結果表明,最高正值2.911出現在第713位氨基酸,疏水性最強;最小負值-3.5出現在第305—313位氨基酸,親水性最強(圖3-A);其平均疏水性系數為-0.519,MYC1屬于不穩定親水蛋白質(負值為親水、正值為疏水)。信號肽預測結果顯示(圖3-B),信號肽預測值為0.010 3,其他預測值為0.989 7,因此,MYC1蛋白不含有信號肽,沒有信號識別功能,為非分泌蛋白。
2.2.3 蛋白亞細胞定位預測 蛋白亞細胞預測分析結果顯示,蛋白定位的整體預測中細胞核得分為9.97,說明該蛋白大概率定位在細胞核(表1)。
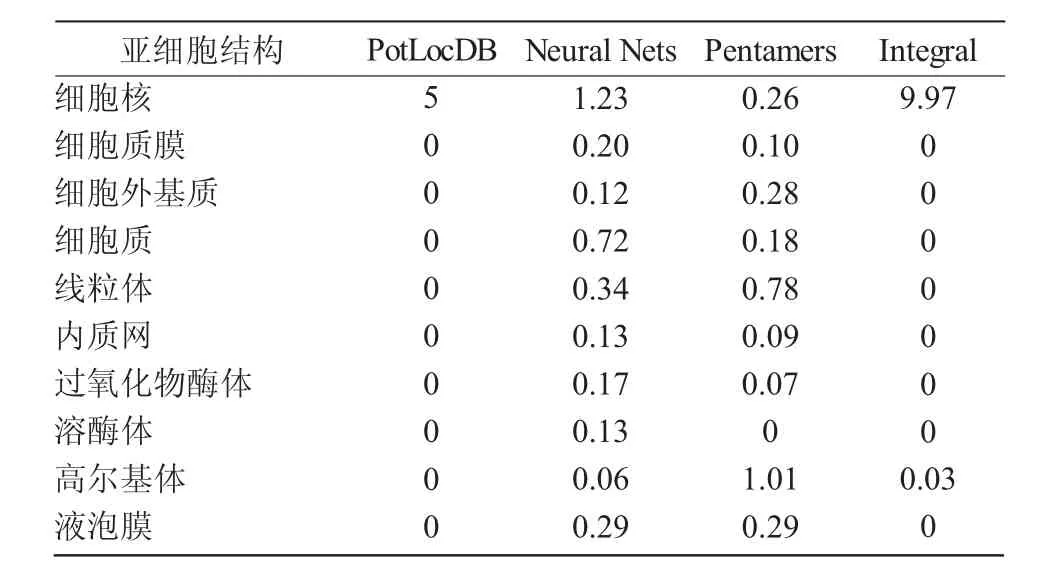
表1 MYC1蛋白亞細胞定位預測
2.2.4 氨基酸序列比對 將推導出的茶樹MYC1的氨基酸序列與葡萄vvMYC1、茶樹bHLH1的氨基酸序列進行比對,結果顯示,它們的序列具有一定的相似性,MYC1、vvMYC1和bHLH1的氨基酸序列在N端都含有一個保守的MYB互作區域。此外,在MYC1和vvMYC1氨基酸序列MYB互作區域的N端發現了一個富含酸性氨基酸的序列,該序列包含29個酸性氨基酸(圖4)。這個MYB互作區域通常被認為是反激活域,它形成了一個蛋白結合表面,與RNA聚合酶Ⅱ啟動轉錄[14]。
2.2.5 蛋白的三維結構預測 利用SWISS-MODEL構建紫娟茶樹MYC1蛋白的三維結構模型(圖5-A),MYC1蛋白三維結構與模板結構相似度為32.78%;圖5-B中,深色為完全允許區域,散點大多集中在深色區域,表明MYC1蛋白三維結構預測結果較為可靠。
2.3 MYC1基因表達分析
2.3.1MYC1基因在紫娟茶樹葉片中的時空表達分析 采集紫娟茶樹芽、第二葉、開面葉、成熟葉分別進行實時熒光定量PCR檢測MYC1基因的表達情況,結果表明,第二葉中MYC1基因表達量最高,是芽中MYC1基因表達量的2.2倍;開面葉中MYC1基因的表達量低于第二葉,是芽中的1.8倍;成熟葉中MYC1基因表達量最低,為芽中的0.56倍(圖 6)。
2.3.2MYC1基因在不同光質下的表達 將紫娟茶樹分別放置在室溫下,在自然光、紫光、綠光、藍光、黃光照射下培養,使用實時熒光定量PCR技術檢測MYC1基因的表達情況,結果表明,在不同光質照射下,自然光下MYC1基因表達量最高,黃光下MYC1基因表達量最低,其他光質下MYC1基因表達量大小順序為紫光>綠光>藍光(圖7)。
3 結論與討論
本研究獲取了紫娟茶樹MYC1的全長,選取了15個物種MYC1和3個茶樹bHLH家族基因構建進化樹[14],結果發現,它們都屬于IIIf亞類,并且與葡萄vvMYC1、番茄SIMYC1具有較高的同源性。前人研究表明,MYC1參與了類黃酮生物合成的調控。在葡萄中,類黃酮通路基因的調控依賴于MYB轉錄因子與其相互作用[15]。本研究發現,紫娟MYC1與葡萄vvMYC1氨基酸序列在N端都含有一個保守的MYB互作區域,表明紫娟MYC1基因可能同樣參與類黃酮生物合成的調控,并且發揮著與葡萄vvMYC1基因相同的作用。
花青素是一類廣泛存在于植物中的類黃酮化合物,對調節葉片顏色起著重要的作用[16]。已有研究表明,紫娟茶樹葉片花青素含量由高到低分別為第二葉、開面葉、芽、成熟葉[2]。本研究發現,MYC1基因在紫娟葉片中的表達量由高到低同樣為第二葉、開面葉、芽、成熟葉。說明在紫娟茶樹中,MYC1基因可能參與調節花青素的生物合成。此外,前人研究還表明[17-18],不同光質的照射能夠對茶樹花青素含量造成影響。在蘋果中,光誘導MYB基因表達調控紅蘋果花青素的生物合成[19]。本試驗表明,在黃、綠、藍、紫這4種光質照射下,紫光中MYC1表達量最高,說明不同光質對MYC1基因表達造成了一定影響。推測光質通過對MYC1基因的應答來調控花青素的含量,從而調節葉片顏色,但其作用機制還有待進一步研究。基于上述分析,初步推測MYC1基因參與了紫娟茶樹花青素的生物合成,并且紫娟MYC1基因的表達與光質有關。

