玫瑰樹堿促進NK細胞識別與殺傷非小細胞肺癌細胞的研究
閻學偉,龔陳媛,祝曉雯,胥孜杭,2,姚超,3,王莉新,3,朱詩國,3
(上海中醫(yī)藥大學 1.基礎醫(yī)學院、2.經(jīng)方理論應用研究中心、3.免疫學與病原生物學教研室,上海 201203)
非小細胞肺癌(non-small cell lung cancer,NSCLC)在肺癌的組織學類型中占比最高,在所有腫瘤中,NSCLC致死率最高[1]。酪氨酸激酶抑制劑(tyrosine kinase inhibitor,TKI)、間變性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)抑制劑等分子靶向藥物先后進入臨床應用,使各期NSCLC患者的生存期得到了很大提高[2]。但是,NSCLC的療效依舊存在很大的上升空間,中晚期NSCLC治療獲益相對于早期依然非常有限[3]。尋求更加有效、作用更加持久的NSCLC療法為當前研究熱點。
隨著對固有免疫系統(tǒng)的研究不斷深入,固有免疫系統(tǒng)在腫瘤發(fā)生、發(fā)展中的重要地位被漸漸確立,與自然殺傷(natural killer,NK)細胞相關聯(lián)的腫瘤免疫療法也受到了關注。目前,針對NK細胞相關的抗腫瘤療法,包括NK細胞、嵌合抗原受體-NK細胞(chimeric antigen receptor-NK cells,CAR-NK)、促NK細胞因子的回輸?shù)龋硗猓琋K細胞抑制性受體抑制劑的應用也對NK細胞的抗腫瘤活性產(chǎn)生了積極作用[4]。
目前,通過使用天然化合物增強NK細胞抗腫瘤作用的報道尚不多見,玫瑰樹堿(ellipticine,EPT)是一種來源于傳統(tǒng)植物玫瑰樹的吲哚并異喹啉類生物堿,對白血病、結腸癌、乳腺癌等腫瘤細胞都有抑制作用[5]。本研究旨在探討EPT促進NK細胞識別和殺傷NSCLC細胞的作用,以期促進擴充基于藥物治療的NSCLC免疫療法。
1 材料與方法
1.1 材料
1.1.1藥物與試劑 EPT(陶素化學公司,批號T4614);DMSO(Amresco公司,批號0231);胰酶、胎牛血清(Gibco公司);DMEM高糖培養(yǎng)液、RPMI 1640培養(yǎng)液、青霉素/鏈霉素雙抗、PBS緩沖液(Hyclone公司);人重組白介素-2(PeproTech公司,批號200-02);噻唑蘭(Sigma Aldrich公司,批號M2128);CCK8試劑盒(翊圣生物公司,批號ES60);PE標記MICA/B抗體、APC標記HLA-ABC抗體(Biolegend公司,批號320906、311410,);FITC標記CD56抗體、PE/Cy5 標記CD107α抗體、PE-Cy5同型對照抗體(BD公司,批號318304、555802、551497);潮霉素B(Roche公司,批號 31282);D-luciferin底物(PerkinElmer公司,批號 2591);ATP檢測Celltiter Glo?試劑盒(Promega公司,批號G7571);γ-H2AX抗體(Abcam公司,批號26350);DAPI(碧云天公司,批號C1002)。
1.1.2細胞株 人NSCLC H1299、A549細胞,由中國科學院上海生命科學研究院細胞庫提供。A549-luciferase(A549-luc)和H1299-luciferase(H1299-luc)細胞,由上海中醫(yī)藥大學基礎醫(yī)學院免疫學與病原生物學教研室建立細胞株并提供。
1.1.3儀器 二氧化碳細胞培養(yǎng)箱(Thermo Scientific公司, 1300series A2);激光共聚焦顯微鏡(ZESS公司, LSM 800 with Airyscan);酶標儀(Bio Tek 公司, Synergy);流式細胞儀(BD公司, Accuri C6);倒置顯微鏡(OLYMPUS公司,CKX41)。
1.2 方法
1.2.1NK細胞擴增 從上海血液中心獲人的外周血,經(jīng)分離得到人的外周血單個核細胞(PBMCs)。使用新鮮或者冷凍的PBMCs通過與經(jīng)輻照的基因工程細胞mbIL-21-CD137L-K562,在含有1×105U·L-1的IL-2的RPMI 1640培養(yǎng)基中共培養(yǎng),在5%CO2,37 ℃下擴增2周,NK細胞標志為CD3-CD56+。
1.2.2MTT法檢測EPT對肺癌細胞增殖的影響 A549和H1299細胞,胰酶消化后,制備成單細胞懸液,鋪于96孔板,細胞濃度為3 000個細胞每孔,在37 ℃、5%CO2培養(yǎng)箱內(nèi)過夜后,加入不同濃度的EPT(0.125、0.25、0.5、1、2、4、8 μmol·L-1),設立DMSO溶劑對照組和空白組,每組設3復孔。培養(yǎng)24、48、和72 h后,每孔加入20 μL MTT溶液(5 g·L-1),在培養(yǎng)箱中反應4 h后,棄上清,每孔加入150 μL DMSO溶液,酶標儀檢測490 nm吸光度。計算細胞活力/%:(實驗組OD值-空白組OD值/對照組OD值-空白組OD值)×100%
1.2.3免疫熒光檢測EPT對肺癌細胞DNA的影響 A549、H1299細胞消化,調(diào)整細胞密度為1×108個·L-1,鋪免疫熒光成像專用皿,每皿加入1 mL細胞懸液,置于37 ℃、5%CO2培養(yǎng)箱內(nèi)培養(yǎng)過夜。每皿加入1 mL終濃度為0、1、2 μmol·L-1的EPT培養(yǎng)24 h后,PBS洗1遍,每皿加入1 mL 4%多聚甲醛室溫固定10 min。PBS清洗1遍,加入1 mL破膜劑(0.2%Triton X-100+0.5%BSA PBS)20 min進行破膜。PBS洗1遍,加1 mL 3%馬血清室溫封閉1 h。PBS洗1遍,每皿加80 μL一抗(1 ∶200,mouse anti human γ-H2AX)4 ℃過夜后PBS洗3遍,加入100 μL二抗(1 ∶350,goat anti mouse Alexa Fluro 488)室溫避光孵育1 h。PBS洗3遍,加入120 μL DAPI(1 ∶2 000)室溫避光染色10 min。PBS洗3遍,每皿加入1mL PBS后使用激光共聚焦25倍鏡進行拍攝(Alexa Fluro 488及DAPI熒光)。
1.2.4CCK8法檢測EPT對NK細胞增殖的影響 取NK細胞,調(diào)整細胞濃度為5×108個·L-1。將NK細胞懸液加入96孔板,100 μL每孔。加入終濃度分別為0.125、0.25、0.5、1、2、4、8 μmol·L-1的EPT,設DMSO對照組和空白組,每組3復孔。于培養(yǎng)箱內(nèi)培養(yǎng)24 h、48 h后每孔加入20 μL CCK8溶液,4 h后,酶標儀上檢測450 nm處吸光度。計算細胞活力/%:(實驗組OD值-空白組OD值/對照組OD值-空白組OD值)×100%
1.2.5化學發(fā)光法(ATP法)檢測EPT對NK細胞殺傷功能的影響 A549和H1299細胞,經(jīng)胰酶消化制備成單細胞懸液,調(diào)整細胞濃度1×108個·L-1, 將NK細胞取出調(diào)整濃度,以NK細胞與腫瘤細胞的效靶比為1 ∶1或2 ∶1進行和藥物于白底96孔板共孵育。分為單腫瘤細胞組,單NK細胞組和腫瘤細胞+NK細胞組,每組3復孔。EPT(終濃度0、0.25、0.5、1、2 μmol·L-1),每孔細胞懸液加藥物總體積100 μL,在37 ℃、5%CO2培養(yǎng)箱內(nèi)培養(yǎng)24 h后。每孔加入底物100 μL,反應10 min。使用酶標儀測定。 計算殺傷效力/%:1-[(NK細胞+腫瘤細胞組)-(單獨NK細胞組)]/單獨腫瘤細胞組×100%
1.2.6 化學發(fā)光法(Luciferase法)檢測EPT對NK細胞殺傷肺癌細胞作用的影響使用潮霉素B進行抗性篩選處理培養(yǎng)A549-luciferase(A549-luc)和H1299-luciferase(H1299-luc)細胞,調(diào)整細胞濃度1×108個·L-1。同時將NK細胞取出調(diào)整濃度,以NK細胞與腫瘤細胞的效靶比分別為1 ∶1和2 ∶1進行和藥物于白底96孔板共孵育。設定3個組,Spontaneous(單腫瘤細胞組),腫瘤細胞+NK細胞組和Maximum組。即DMSO組和1 μmol·L-1、2 μmol·L-1的EPT組,Spontaneous組是加培養(yǎng)基,Maximum組是2%TritonX-100,每孔終體積200 μL,培養(yǎng)24 h后,每孔加入2 μL luciferase熒光底物,用酶標儀檢測。計算殺傷效力/%:1-[(NK細胞+腫瘤細胞組)-Maximum組)/(Spontaneous組-Maximum組)]×100%
1.2.7 流式細胞術檢測EPT對NK細胞脫顆粒作用的影響A549和H1299細胞,胰酶消化后,制備成單細胞懸液加入6孔板,細胞濃度3×108個·L-1。每孔需2 mL細胞培養(yǎng)液。培養(yǎng)箱內(nèi)過夜,加入濃度分別為0、1、2 μmol·L-1的EPT。加藥24 h后取出6孔板,將細胞消化并計數(shù)。與NK細胞效靶比為1 ∶1共孵育,以細胞數(shù)為2×105個,加入到48孔板中。向單NK細胞組和NK細胞+腫瘤細胞組,加入CD107α抗體和同型對照抗體孵育4 h。收集細胞于1.5 mL EP管中,用wash buffer洗兩遍。每個EP管再加入CD56抗體的,置于4 ℃冰箱孵育30 min。用wash buffer溶液洗兩遍,每孔加入200 μL的PBS,用流式細胞儀檢測。
1.2.8 流式細胞術檢測EPT對肺癌細胞MICA/B與HLA-ABC表達的影響取A549和H1299細胞,胰酶消化后,制備單細胞懸液,以細胞密度為3×108個·L-1加入6孔板。每孔需2 mL細胞培養(yǎng)液。在37 ℃、5%CO2培養(yǎng)箱內(nèi)培養(yǎng)過夜,d2加入濃度分別為0、1、2 μmol·L-1的EPT,37 ℃、5%CO2培養(yǎng)24 h后。將細胞消化并計數(shù)。每管1×105個/50 μL細胞加入1.5 mL的EP管中。每管加入PE-MICA/B和APC-HLA-ABC抗體,同時設同型對照,于4 ℃冰箱染色30 min。用wash buffer洗一遍,再加入200 μL wash buffer溶液,用流式細胞儀檢測。

2 結果
2.1 EPT對NSCLC細胞和NK細胞的增殖的影響MTT結果顯示EPT可以明顯抑制NSCLC A549和H1299細胞的增殖(P<0.05),并且有濃度和時間依賴性,如Fig 1 A、B所示。 A549細胞在24、48、72 h的IC50分別是12.06、3.76、1.65 μmol·L-1。H1299細胞在24、48、72 h的IC50分別是12.9、8.56、4.80 μmol·L-1。CCK-8的實驗結果顯示,EPT對NK細胞的增殖抑制作用較弱,如Fig 1 C所示。其在24,48 h的IC50是112.71、72.03 μmol·L-1。
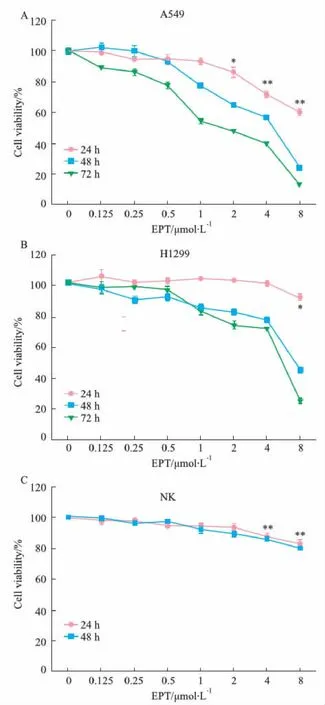
Fig 1 Effect of EPT on proliferation of non-small cell lung cancer cells and NK cells n=3)A-B: A549 and H1299 cells were treated with different concentrations of EPT for 24 h, 48 h and 72 h, and cell viability was measured by MTT assay. C: NK cells were treated with different concentrations of EPT shown in the figure for 24 h, 48 h, the activity of NK cells was detected by CCK8; *P<0.05,**P<0.01 vs vehicle group.
2.2 EPT對肺癌細胞DNA的影響Fig 2顯示,EPT能夠誘導NSCLC A549和H1299細胞產(chǎn)生DNA損傷。EPT處理A549、H1299細胞24 h后,免疫熒光檢測細胞中DNA損傷的標志物γ-H2AX的表達增加(P<0.01)。
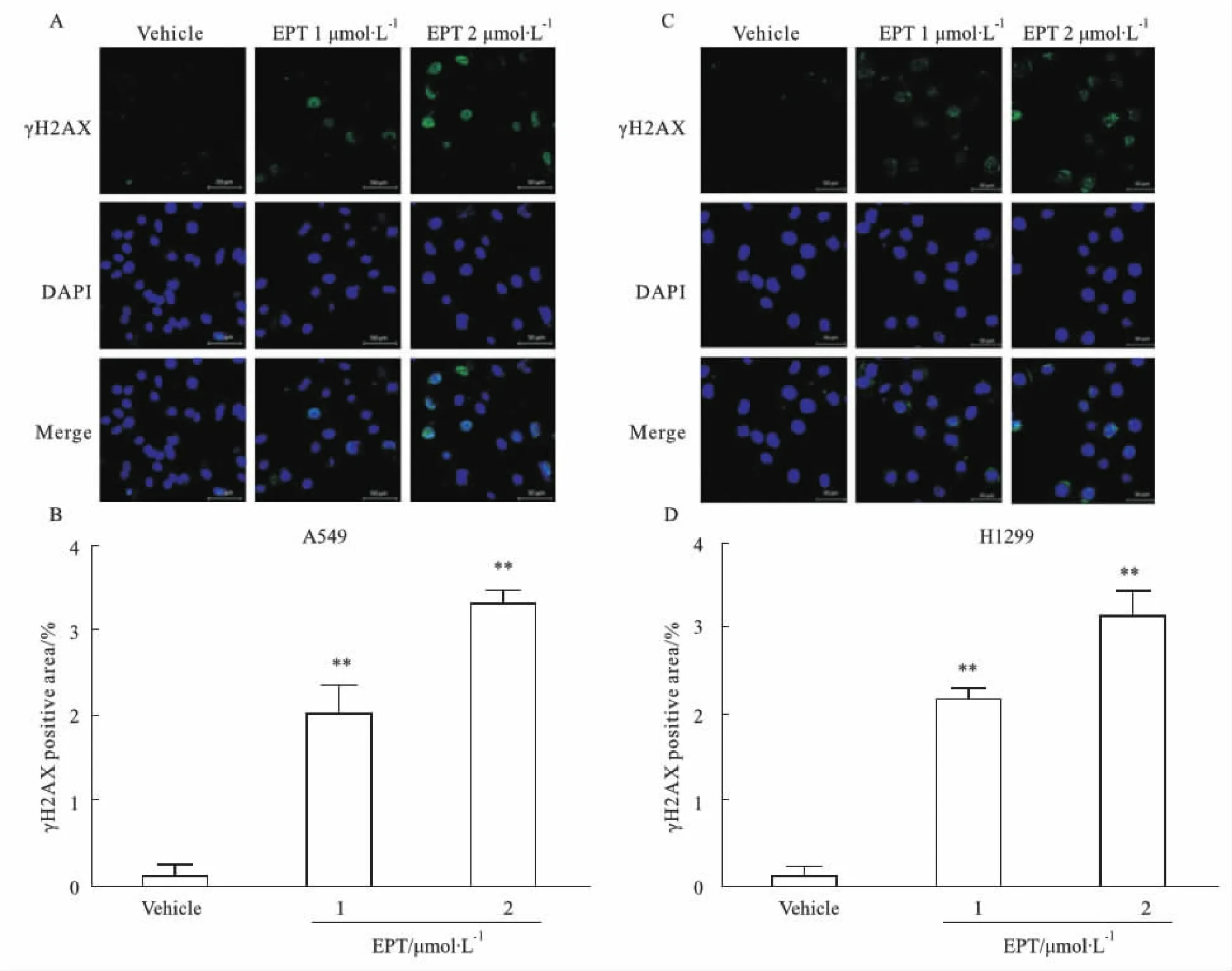
Fig 2 EPT induces DNA damage in A549 and H1299 cellsA: Immunofluorescence detection of γ-H2AX expression in A549 cells treated with EPT (culture time: 24 h). B: Percentage of γ-H2AX positive area in A549 n=3); **P<0.01 vs vehicle group.
2.3 EPT對NK細胞殺傷NSCLC細胞的作用的影響如Fig 3A所示,ATP法實驗結果表明EPT可以增強NK細胞的殺傷活性。EPT不同濃度作用A549、H1299細胞24 h,效靶比1 ∶1,結果顯示隨著藥物濃度的升高,NK細胞的殺傷作用增加(P<0.05)。如Fig 3B-C所示,以1 ∶1、2 ∶1不同效靶比,可以看出在相同濃度下,效靶比增加,NK細胞殺傷活性增加(P<0.05)。Luciferase法檢測結果如Fig 3D-E所示,EPT可以增強NK的殺傷活性。選用0,1和2 μmol·L-1EPT處理A549-luc和H1299-luc細胞(效靶比為1 ∶1、2 ∶1),同一效靶比下,殺傷能力隨藥物濃度遞增(P<0.01);相同的濃度下,效靶比越大,殺傷效應越強(P<0.01),顯示出在這兩個細胞中,EPT可以明顯增強NK細胞的殺傷活性。
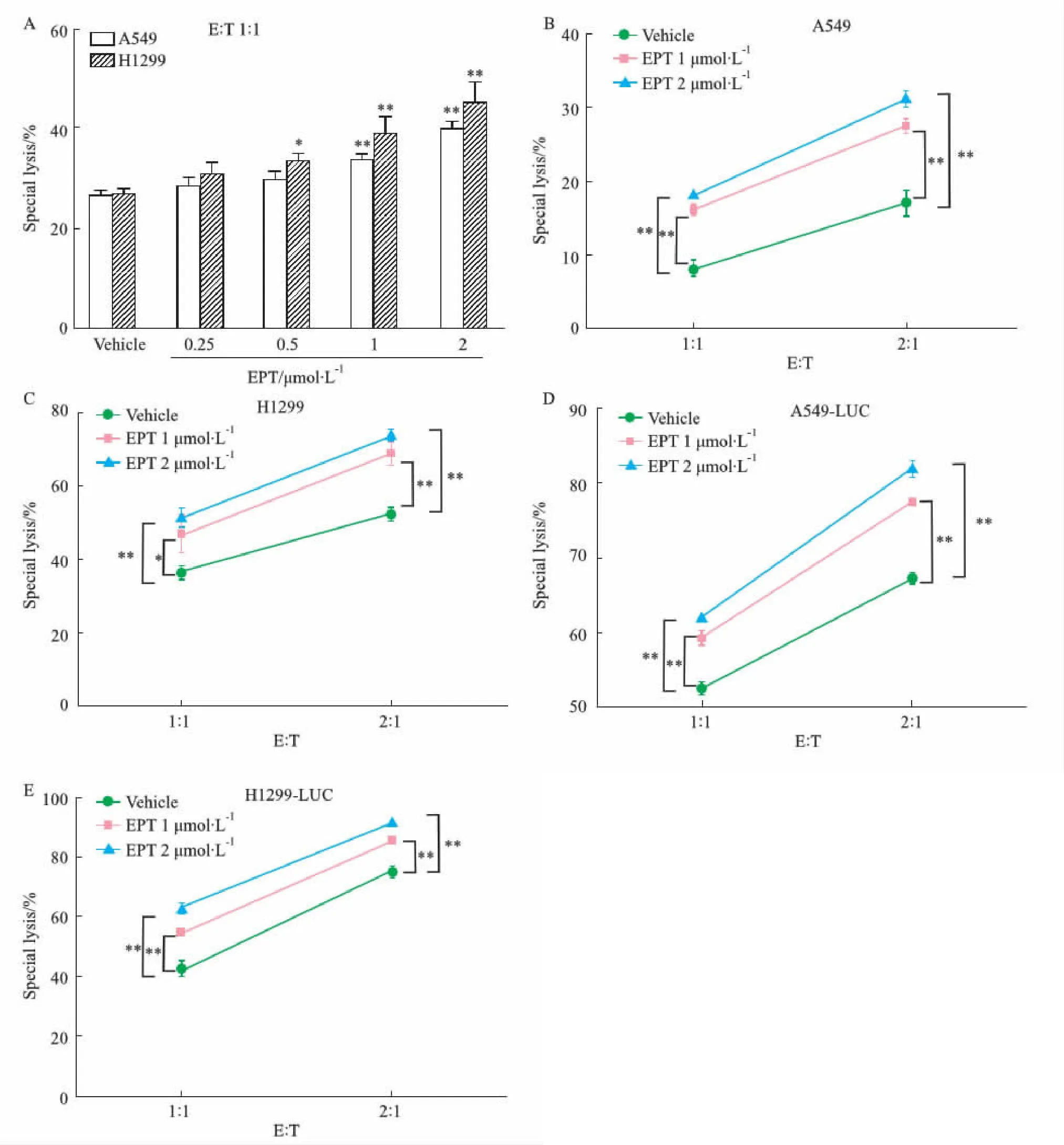
Fig 3 Effect of EPT on killing of A549 and H1299 cells by NK cellsA: The special lysis percentage of A549/H1299 cells was incubated with NK cells for 4 h at an effector-to-target ratio of 1 ∶1 after treatment with different EPT concentrations for 24 h n=3);*P<0.05, **P<0.01vs vehicle group.
2.4 EPT對NK細胞脫顆粒的影響流式細胞術檢測EPT處理后與A549和H1299細胞共培養(yǎng)的NK細胞的CD107α表達水平,結果如Fig 4所示,使用EPT 0、1和2 μmol·L-1處理腫瘤細胞24 h后,與NK細胞效靶比1 ∶1共孵育4 h,發(fā)現(xiàn)在A549、H1299細胞中,隨著藥物濃度增加,NK細胞脫顆粒水平增加。
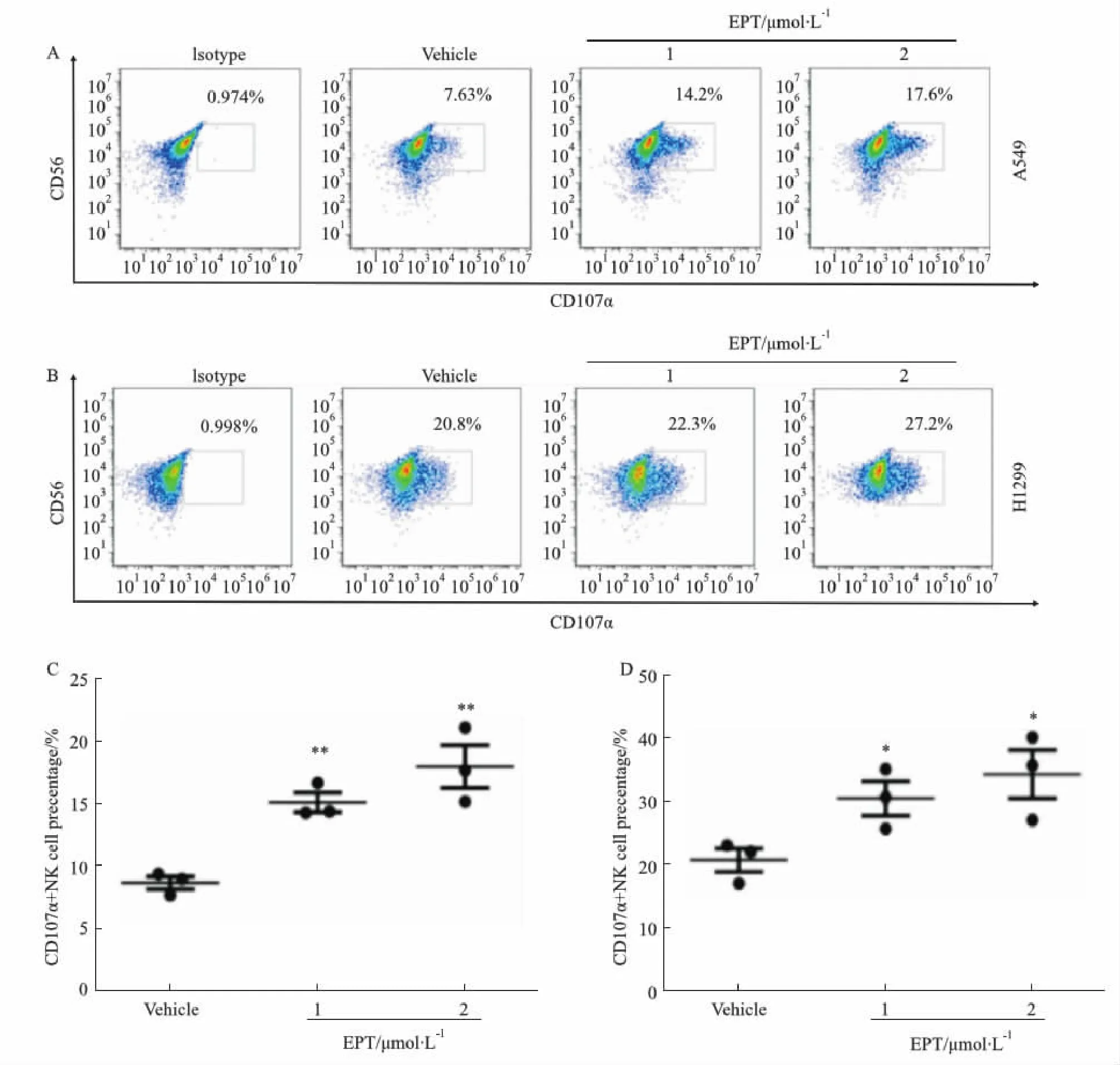
Fig 4 Effect of EPT on CD107α degranulation of NK cells A: Detection of CD107α expression in NK cells co-cultured with A549 cells after EPT treatment by flow cytometry (culture time: 24 h). B: Detection of CD107α expression in NK cells co-cultured with H1299 cells after EPT treatment by flow cytometry (culture time: 24 h). C: CD107α+ NK cell percentage in A549 cells n=3); * P<0.05, **P<0.01 vs vehicle group.
2.5 EPT對NSCLC細胞MICA/B表達的影響為考察EPT的免疫增強效應是否與NK細胞對靶細胞的識別有關,流式細胞術檢測了EPT對A549、H1299腫瘤細胞表面的NK細胞識別配體MICA/B、HLA-ABC表達的影響,結果如Fig 5所示。實驗發(fā)現(xiàn)EPT(濃度為1和2 μmol·L-1)可以上調(diào)A549和H1299細胞表面MICA/B表達,但沒有上調(diào)抑制性配體 HLA-ABC表達。EPT可以增強NK細胞對A549、H1299腫瘤細胞的識別。
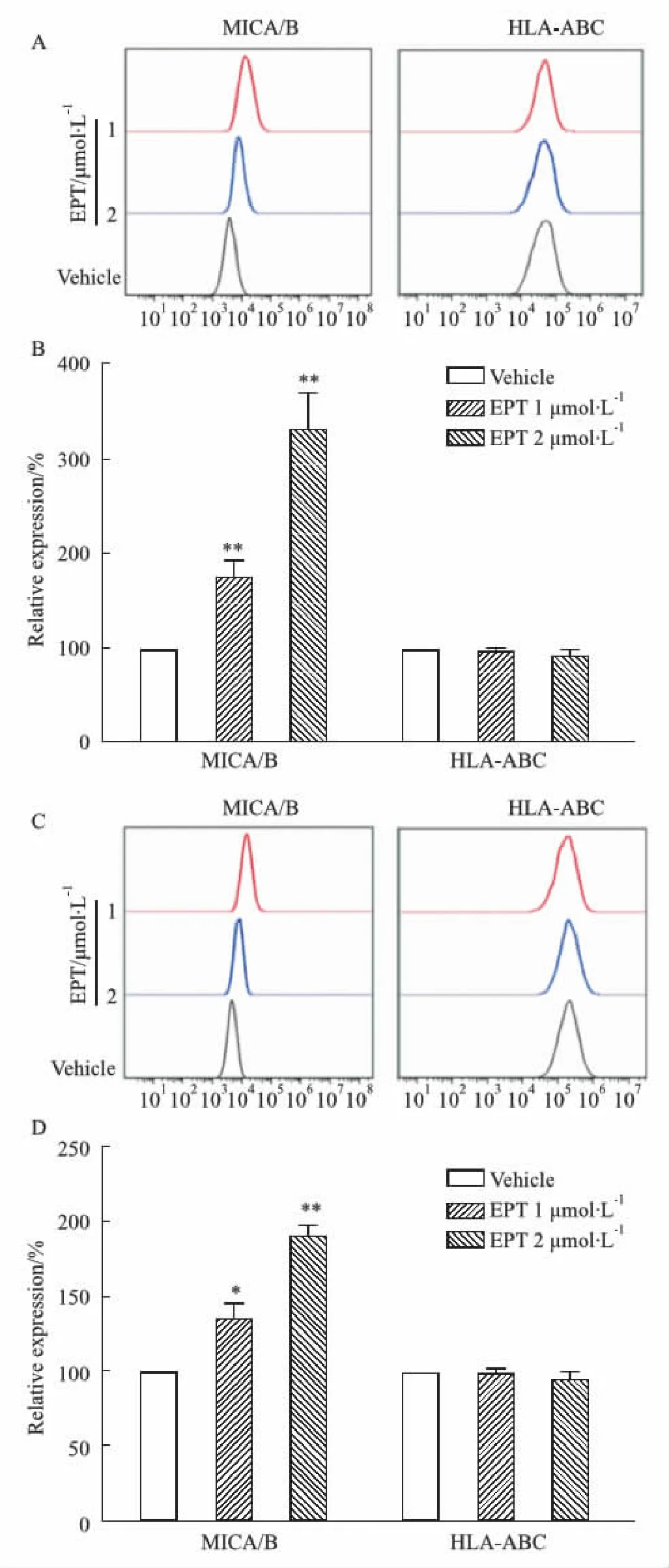
Fig 5 Effect of EPT on expression of MICA/B in A549 and H1299 cellsA: Detection of MICA/B and HLA-ABC expression in A549 cells after EPT treatment by flow cytometry (culture time: 24 h). B: Relative expression of MICA/B and HLA-ABC in A549 cells after EPT treatment n=3). C: Detection of MICA/B and HLA-ABC expression in H1299 cells after EPT treatment by flow cytometry (culture time: 24 h). D: Relative expression of MICA/B and HLA-ABC in H1299 cells after EPT treatment (x±s, n=3); *P<0.05, **P<0.01 vs vehicle group.
3 討論
NK細胞為固有免疫系統(tǒng)的重要組成部分,與T、B細胞不同,T、B細胞的激活依賴于抗原致敏、抗體或主要組織相容性復合體(major histocompatibility complex,MHC)的參與,而NK細胞不需要以上步驟的參與便能夠直接殺傷靶細胞,因此,NK細胞對比于其他免疫細胞,可以更加快速有效地清除病變細胞,其免疫監(jiān)視作用更為直接有效[6-7]。自然殺傷細胞2族成員D(natural-killer group 2 member D,NKG2D)為NK細胞表面的重要受體,與配體結合可以激活NK細胞,NKG2D配體包括MHC-I類分子相關蛋白A和B(major histocompatibility complex class I homologues A/B,MICA/B)以及人巨細胞病毒UL16蛋白的結合蛋白(UL16-binding proteins,ULBPs)等[8]。NK細胞與靶細胞接觸活化后,可以通過釋放穿孔素、顆粒酶、IFN-γ等途徑殺傷靶細胞,當靶細胞表面NKG2D配體表達增高,會NK細胞的殺傷活性。而在腫瘤或感染的細胞中DNA損傷持續(xù)被激活, NKG2D配體的表達相對于正常細胞增加,當腫瘤細胞DNA被藥物等刺激因素進一步損傷后, NKG2D配體的表達升高,能夠增加NK細胞對腫瘤細胞的識別殺傷作用[9]。
很多傳統(tǒng)化療和靶向藥物可以對腫瘤細胞DNA產(chǎn)生損傷,這一作用可以提高NK細胞的抗腫瘤活性,如舒尼替尼可以增強肝癌HepG2細胞MICA/B、ULBP1/2/3的表達,強化NK細胞的識別與殺傷,這一作用于與舒尼替尼上調(diào)NF-κβ2的表達有關[10]。5-fluorouracil(5-FU)也可以強化NK細胞對小鼠結腸癌MC38細胞的殺傷作用,在此過程中,5-FU可以上調(diào)NKG2D活化相關的DNAM-1和Rae-1配體的表達,將NK細胞人為耗竭后,5-FU誘導的殺傷作用被明顯抑制[11]。部分天然化合物也能夠提高NK細胞抗腫瘤活性,沙苑子的黃酮成分(flavonoid component from the seeds of Astragalus complanatus,F(xiàn)AC)可以上調(diào)NKG2D、NKp44的表達,強化NK-92細胞對白血病、肝癌細胞的殺傷[12]。
EPT可以誘導多種腫瘤細胞周期阻滯,同時誘導凋亡,其抗腫瘤機制與抑制拓撲異構酶Ⅱ和共價修飾DNA有關[13],Savorani等[14]報道,EPT可以抑制皮膚T細胞淋巴瘤(cutaneous T-cell lymphoma,CTCL)細胞增殖,誘導凋亡,而抑制EPT誘導DNA氧化損傷的親脂性抗氧化劑α-生育酚(α-tocopherol)能夠逆轉EPT的凋亡誘導作用。EPT的抗腫瘤作用與DNA損傷具有重要聯(lián)系。
在本研究中,EPT對NSCLC細胞具有較強抑制作用,誘導DNA損傷。在EPT本身誘導NSCLC細胞DNA損傷的同時,腫瘤細胞表面MICA/B的表達被上調(diào),從而增加了腫瘤細胞對NK細胞的敏感性,增強了NK細胞識別殺傷腫瘤細胞的能力,在自身具備抑制作用的前提下,還強化了周邊NK細胞對NSCLC細胞的識別與殺傷。這是一種強化固有免疫中NK細胞監(jiān)視功能從而殺傷腫瘤細胞的特殊作用。但是,目前腫瘤細胞的DNA損傷與腫瘤細胞表面MICA/B的表達的直接關系尚缺乏報道,DNA損傷導致的細胞表面抗原的變化具體機制目前仍待進一步探索。
EPT具備轉化為抗NSCLC藥物的潛力,而更進一步的藥效學與藥物代謝動力學及毒理學研究將加速這一進程。天然化合物很多具備高效低毒的特點,進一步深化抗腫瘤免疫的研究將有助于其成為新興的抗腫瘤藥物群體。

