金絲桃苷在大鼠蛛網膜下腔出血后早期腦損傷中的神經保護作用及機制研究
俞越 蔡菁
蛛網膜下腔出血(subarachnoid hemorrhage,SAH)是由于顱內血管壁完整性受到破壞,血液直接流入蛛網膜下腔引起的一種臨床綜合征,主要由顱內動脈瘤破裂引起。文獻報道SAH患者在初次發病時病死率即高達30%,且幸存患者常遺留不同程度的神經功能障礙[1]。早期腦損傷(early brain injury,EBI)是指 SAH 發生 72 h內腦組織的損傷過程。越來越多的研究表明,EBI是SAH預后不良的關鍵因素[2-3]。EBI的病理機制十分復雜,炎癥反應是SAH后EBI發生、發展的重要環節。因此,深入研究SAH后炎癥反應的相關機制,研發針對性治療措施,對于減輕EBI、改善SAH患者預后具有重要意義。Akt作為一種蛋白激酶,在神經元、膠質細胞和內皮細胞等部位均廣泛表達[4]。它是調控細胞發育、存活等信號轉導網絡中的一個關鍵節點,以往對Akt的研究多著眼于抗凋亡效應[5]。最新研究表明,Akt能夠結合其下游靶點GSK-3β,并促進后者發生磷酸化,進而減輕炎癥反應[6]。金絲桃苷是提取自藥用植物蘆丁的黃酮醇苷類化合物。現代藥理學研究證明,金絲桃苷具有抗氧化應激、減輕細胞凋亡、改善心血管功能、調節內分泌等多重藥理學作用,是近年來國內外學者研究的熱點中藥單體[7]。近期有研究指出,Akt信號通路是金絲桃苷發揮心肌保護等多種藥理學作用的關鍵靶點[8]。然而,金絲桃苷及其介導的Akt信號通路能否影響SAH后EBI病理過程,目前尚無相關報道。因此,本研究擬通過構建大鼠SAH模型,探討金絲桃苷在SAH后EBI病理過程中的作用及其分子機制,以期為SAH治療提供新的思路和理論依據。
1 材料和方法
1.1 實驗動物 192只體重280~320 g的健康雄性SD大鼠購自上海斯萊克實驗動物有限公司,飼養于浙江大學醫學院附屬第二醫院實驗動物中心,飼養溫度(22±3)℃,動物自由覓食、飲水,適應性喂養1周。動物相關實驗內容經浙江大學醫學院附屬第二醫院實驗動物倫理委員會審查通過,實驗過程中嚴格遵守動物實驗原則指南(1996年修訂版)的要求。
1.2 主要藥物與試劑 金絲桃苷(純度≥98%)購自南京澤朗農業科技發展有限公司;Akt抑制劑MK2206購自美國Sigma公司;2%伊文思藍溶液購自美國Sigma公司;二喹啉甲酸(BCA)試劑盒、Trizol試劑、反轉錄試劑盒均購自美國 Thermo Fisher公司;β-actin、Akt、p-Akt、GSK-3β、p-GSK-3 等兔抗大鼠一抗,Iba-1 山羊抗大鼠一抗均購自美國Abcam公司;辣根過氧化物酶標記的二抗購自北京中衫金橋公司;驢抗山羊熒光二抗購自美國Invitrogen公司;封閉液、一抗稀釋液、二抗稀釋液購自武漢碧云天有限公司;RIPA裂解液購自碧云天生物科技有限公司;loading buffer購自福德生物技術公司。
1.3 大鼠SAH模型的建立 采用頸內動脈穿刺法建立大鼠SAH模型[9]。SD大鼠用1%戊巴比妥鈉(40 mg/kg)腹腔麻醉后,仰臥位固定在手術架上。分離并暴露右側頸總動脈、頸外動脈和頸內動脈,經頸外動脈向頸內動脈置入4-0單絲尼龍線,在尼龍線頭端距頸總動脈分叉處18~19 mm稍感阻力時,再向內送入約4 mm刺破動脈管壁,造成SAH;約15 s后迅速退出尼龍線,用絲線結扎頸外動脈殘端,恢復血流,縫合頸部切口。假手術(sham)組大鼠除不刺破動脈管壁外,其余步驟相同。麻醉未清醒前繼續給予電熱毯保暖,術后大鼠單籠飼養。采用過量1%戊巴比妥鈉(40 mg/kg)深度麻醉處死大鼠并獲取腦組織標本,枕大池、基底池、小腦、腦干或大腦表面有血凝塊存在即建模成功。若建模失敗,則以備用動物補充。
1.4 動物分組與給藥 整個實驗分為3個部分進行。(1)金絲桃苷對SAH大鼠的保護作用及最佳治療濃度確定:將60只SD大鼠按隨機數字表法分為sham組、SAH+0.9%氯化鈉溶液(SAH+vehicle)組、SAH+10 mg/kg金絲桃苷(SAH+Hyp-L)組、SAH+25 mg/kg金絲桃苷(SAH+Hyp-M)組、SAH+50 mg/kg金絲桃苷(SAH+Hyp-H)組,每組12只。在建模后24 h評估神經功能,隨后處死大鼠評估SAH嚴重性評分,檢測腦組織含水量(每組6只)和血腦屏障通透性(每組6只)。(2)金絲桃苷對SAH大鼠炎癥反應的調控作用:將36只SD大鼠按隨機數字表法分為sham組、SAH+0.9%氯化鈉溶液(SAH+vehicle)組、SAH+50 mg/kg金絲桃苷(SAH+Hyp)組。在建模后24 h,采用免疫熒光法檢測小膠質細胞激活情況(每組6只),qRT-PCR法檢測炎癥因子水平(每組6只)。(3)金絲桃苷調控SAH大鼠炎癥反應的分子機制:將96只SD大鼠按隨機數字表法分為sham組、SAH+0.9%氯化鈉溶液(SAH+vehicle)組、SAH+50 mg/kg金絲桃苷(SAH+Hyp)組、SAH+50 mg/kg金絲桃苷+Akt抑制劑(SAH+Hyp+MK2206)組。在建模后24 h評估神經功能,采用 Western blot法檢測 Akt、p-Akt、GSK-3β、p-GSK-3β水平(每組6只),qRT-PCR法檢測炎癥因子水平(每組6只),同時檢測腦組織含水量(每組6只)和血腦屏障通透性(每組6只)。金絲桃苷采用灌胃給藥法,按10、25、50 mg/kg稱取金絲桃苷并溶解于1ml的0.9%氯化鈉溶液中,建模前30 min進行灌胃給藥;sham組、SAH+vehicle組大鼠在相同時間點給予1 ml的0.9%氯化鈉溶液進行灌胃。以2 μg/μl的濃度將10 μg MK2206溶解于0.9%氯化鈉溶液中,在建模前30 min使用立體定位儀注射至大鼠側腦室內。
1.5 神經功能及出血程度評估 采用改良的加西亞評分體系評估大鼠神經功能,得分越低表示神經功能越差[10]。采用Sugawara評分標準對出血程度進行評分,總分0~18分[11],得分越高表示SAH越嚴重。
1.6 腦組織含水量測定 將大鼠深度麻醉處死后迅速取出腦組織,稱取濕重。隨后置于100℃烘箱烘干72 h直至重量不再變化,測定干重。腦組織含水量=[(濕重-干重)/濕重]×100%。
1.7 血腦屏障通透性測定 取材前1 h經微靜脈注射2%伊文思藍溶液(5 ml/kg)至大鼠體內。循環1 h后處死大鼠,經PBS灌注后取出左側半球并稱重。隨后將腦組織浸潤于甲酰胺溶液,60℃孵育24 h后收集浸出液,使用酶標儀在620 nm波長處測定光密度(OD)值,評估血腦屏障通透性。
1.8 小膠質細胞激活情況觀察 采用免疫熒光法。大鼠深度麻醉后,依次經心臟灌注PBS和4%多聚甲醛后,取出腦組織置于4%多聚甲醛固定24 h,隨后轉移至30%蔗糖溶液脫水至沉底。將大鼠腦組織切至8 μm厚冷凍切片,用5%驢血清封閉后,滴加山羊抗大鼠I-ba-1一抗,4℃孵育過夜。洗滌后滴加驢抗山羊熒光二抗(美國Invitrogen公司),37℃避光孵育1 h后洗滌。封片后于熒光顯微鏡下觀察Iba-1陽性細胞數量,即小膠質細胞激活情況。
1.9 腦組織炎癥因子mRNA相對表達量檢測 采用qRT-PCR法。Trizol法提取左側大腦皮質組織內的總RNA,隨后用反轉錄試劑盒將總RNA反轉錄為cDNA。根據以下體系進行qRT-PCR:5 μl反應混合物+0.25 μl上下游引物溶液+500 ng cDNA模板,補充焦碳酸二乙酯(DEPC)水至 10 μl。qRT-PCR 引物由 Takara公司設計合成,引物序列見表1。以甘油醛-3-磷酸脫氫酶(GAPDH)為內參,采用 2-ΔΔCt法計算 TNF-α、IL-1β、IL-6、誘導型一氧化氮合酶(iNOS)、單核細胞趨化蛋白1(MCP-1)的mRNA相對表達量。
1.10 腦組織Akt、GSK-3β等蛋白相對表達量檢測采用Western blot法。腦組織加入RIPA裂解液,超聲勻漿,4℃、12 000 r/min離心15 min,取上清液,用BCA法測定蛋白濃度。隨后加入5×loading buffer,100℃加熱5 min,置于-80℃保存。10% SDS-聚丙烯酰胺凝膠電泳,每孔加入40 μg總蛋白樣品;在250 mA下將蛋白轉移至聚偏氟乙烯膜,5%牛血清白蛋白室溫下封閉1 h,將膜分別與 β-actin、Akt、p-Akt、GSK-3β、p-GSK-3等兔抗大鼠一抗于4℃孵育過夜,TBST緩沖液洗滌;在室溫下孵育辣根過氧化物酶標價的小鼠抗兔二抗1 h,TBST緩沖液洗滌后;ECL法顯影后,以β-actin為參數,用Image J軟件計算各條帶灰度值,即Akt、GSK-3β、p-Akt、p-GSK-3β 蛋白相對表達量;p-Akt、GSK-3β 的磷酸化水平(p-Akt/Akt、p-GSK-3β/GSK-3β) 分別用 p-Akt、p-GSK-3β的灰度值與各自總蛋白灰度值的比值表示。
1.11 統計學處理 采用SPSS 22.0統計軟件。符合正態分布的計量資料用表示,多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。采用Graphpad Prism6軟件進行繪圖。
2 結果
2.1 金絲桃苷對SAH大鼠的保護作用及最佳治療濃度 各模型組大鼠出血程度評分比較,差異無統計學意義(P>0.05)。與sham組相比,各模型組大鼠神經功能評分均明顯下降(均P<0.05),腦組織含水量均明顯升高(均P<0.05),血腦屏障通透性亦明顯增加(均P<0.05)。與SAH+vehicle組相比,金絲桃苷治療組大鼠神經功能評分明顯升高(均P<0.05),腦組織含水量明顯減少(均P<0.05),血腦屏障通透性明顯降低(均P<0.05),且呈劑量遞增效應,見圖1。因此,本研究后續實驗選擇50 mg/kg作為金絲桃苷的治療濃度。

表1 qRT-PCR引物序列
2.2 金絲桃苷對SAH大鼠炎癥反應的調控 與sham組相比,SAH+vehicle組大鼠腦組織內Iba-1陽性細胞數量明顯增加,TNF-α、IL-1β、IL-6、iNOS、MCP-1 等炎癥因子水平明顯升高,差異均有統計學意義(均P<0.05);與SAH+vehicle組相比,SAH+Hyp組大鼠腦組織內Iba-1陽性細胞數量明顯減少,上述炎癥因子水平亦明顯降低,差異均有統計學意義(均P<0.05),提示金絲桃苷能抑制SAH后的炎癥反應,見圖2-3。
2.3 金絲桃苷調控SAH大鼠炎癥反應的分子機制與sham組相比,SAH+vehicle組大鼠腦組織內p-Akt/Akt、p-GSK-3β/GSK-3β 均明顯下降(均 P<0.05);與SAH+vehicle組相比,SAH+Hyp組大鼠腦組織內p-Akt/Akt、p-GSK-3β/GSK-3β明顯升高(均 P<0.05);與 SAH+Hyp 組相比,SAH+Hyp+MK2206 組 p-Akt/Akt、p-GSK-3β/GSK-3β及神經功能評分均明顯降低(均P<0.05),而各炎癥因子水平、腦組織含水量及血腦屏障通透性均明顯增加(均P<0.05),提示SAH后大鼠Akt/GSK-3β信號通路被抑制,而金絲桃苷能在SAH后顯著上調Akt/GSK-3β信號通路的激活水平,見圖4。
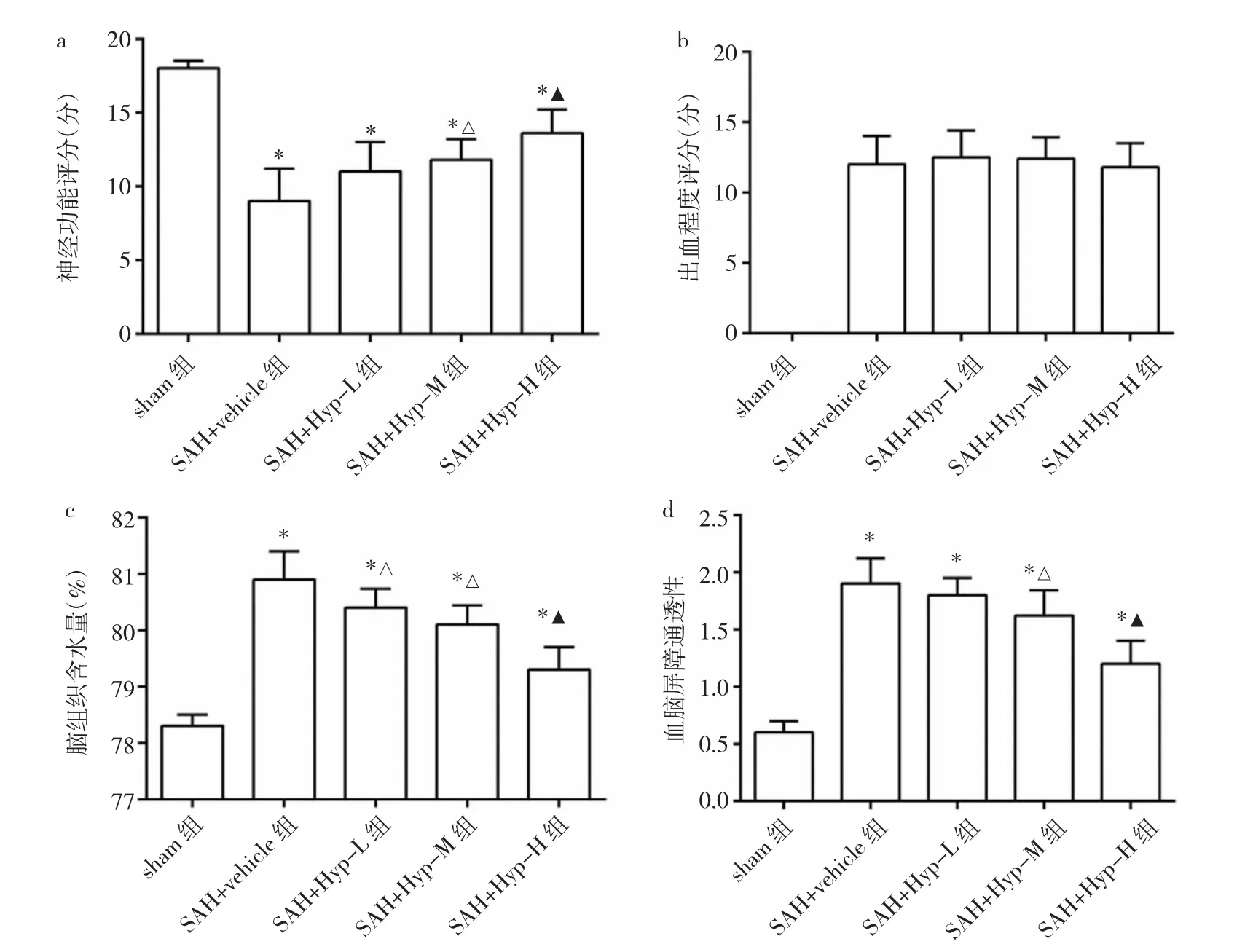
圖1 金絲桃苷對蛛網膜下腔出血(SAH)后大鼠神經功能、出血程度、腦組織含水量及血腦屏障通透性的影響(a:神經功能評分;b:出血程度評分;c:腦組織含水量;d:血腦屏障通透性;與sham組比較,*P<0.05;與SAH+vehicle組比較,△P<0.05;與SAH+Hyp-L組比較,▲P<0.05)
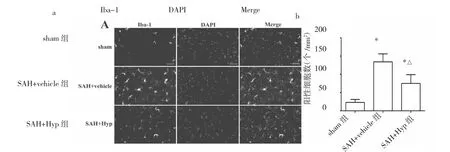
圖2 金絲桃苷對蛛網膜下腔出血(SAH)后大鼠腦組織內小膠質細胞激活的影響(a:免疫熒光染色圖,×200,DAPI為4′,6-二脒基-2-苯基吲哚,Merge為合并重疊;b:Iba-1陽性細胞數量比較,與sham組比較,*P<0.05,與SAH+vehicle組比較,△P<0.05)
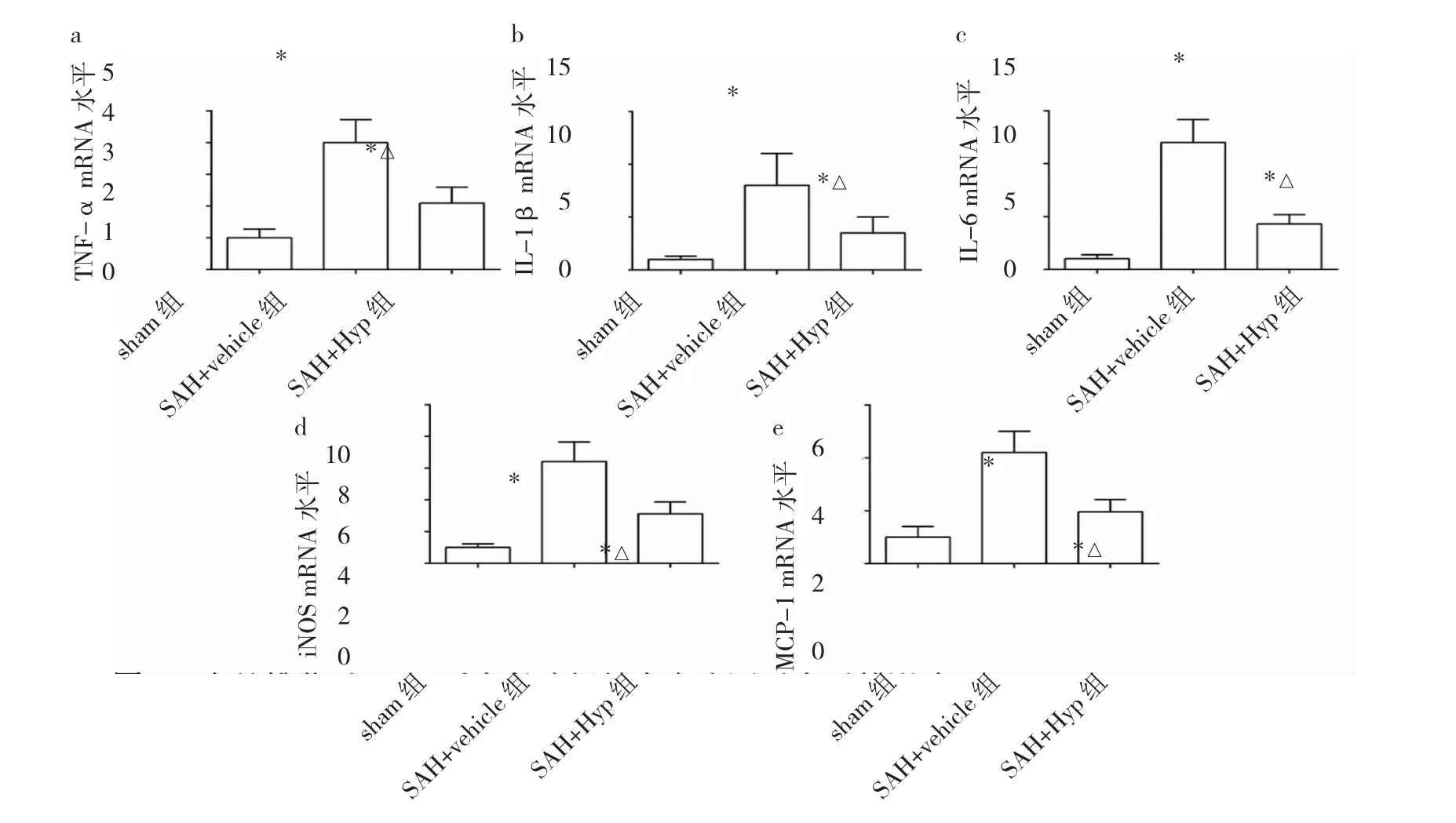
圖3 金絲桃苷對蛛網膜下腔出血(SAH)后大鼠腦組織內炎癥因子水平的影響[a:TNF-α;b:IL-1β;c:IL-6;d:誘導型一氧化氮合酶(iNOS);e:單核細胞趨化蛋白 1(MCP-1);與 sham 組比較,*P<0.05;與 SAH+vehicle 組比較,△P<0.05]
3 討論
金絲桃苷作為一種具有抗氧化應激、改善心血管功能、調節內分泌等多種藥理學作用的中藥單體,日益受到學者的關注[12-13]。然而,關于金絲桃苷在SAH病理過程中的作用及機制,目前尚無確切研究。本研究初步探索了金絲桃苷在SAH后的效應,結果發現金絲桃苷治療能明顯減輕SAH后的腦水腫、減少血腦屏障破壞。更為重要的是,金絲桃苷能夠明顯減輕SAH引起的神經功能障礙,且療效呈劑量遞增效應。以上結果提示金絲桃苷能在SAH后發揮強大的神經保護效應。
神經炎癥是SAH后EBI的關鍵致病機制,與SAH預后不良有關[14]。小膠質細胞作為常駐中樞神經系統的免疫細胞,能夠快速感知各種病理刺激,并作出迅速應答。激活的小膠質細胞一方面能夠通過合成和釋放炎癥因子,對神經細胞和內皮細胞造成直接殺傷;另一方面,小膠質細胞還可通過分泌MCP-1等趨化因子,進一步招募中性粒細胞、巨噬細胞等免疫細胞,最終放大炎癥反應,加重腦組織損傷[15]。越來越多的研究證實,通過多種途徑抑制SAH后小膠質細胞的異常激活,能夠有效地抑制炎癥反應,進而緩解EBI,改善SAH的預后[16-17]。筆者進一步探討了金絲桃苷在SAH后對小膠質細胞及神經炎癥的調控作用,發現大鼠SAH后腦組織內小膠質細胞被激活,且有大量炎癥因子合成,提示SAH后發生了顯著的神經炎癥反應,這與Gris等[18]研究結果類似;但給予金絲桃苷治療后,小膠質細胞的激活和炎癥因子的合成均被明顯抑制,提示金絲桃苷能夠在SAH后抑制炎癥反應,進而減輕EBI。
Akt作為廣泛分布于真核細胞的蛋白激酶,能夠通過激活其下游靶點參與細胞發育、分化和存活等一系列關鍵的生命過程[4]。以往研究主要集中在Akt對細胞凋亡的調控作用。Gugliandolo等[19]證實,Akt信號通路異常失活可引起多巴胺能神經元的凋亡,加速帕金森病等多種退行性神經系統疾病的病理進程。在腦外傷、脊髓損傷等疾病模型中也發現,通過外源性藥物特異性激活Akt信號通路,能夠減輕神經元凋亡,改善運動功能[20-21]。近期研究指出,Akt同樣參與了炎癥反應這一重要的生命過程。Akt能夠磷酸化GSK-3β第9號位點上的絲氨酸殘基,促進GSK-3β的激活。隨后,激活的Akt/GSK-3β信號通路可以進一步調控下游NF-κB和mTOR等靶點,減輕炎癥反應[22]。考慮到金絲桃苷能夠在體外激活Akt信號通路[23],筆者推測Akt/GSK-3β可能參與了金絲桃苷在SAH后的抗炎效應。最后,本研究通過給予MK2206來特異性地阻斷Akt/GSK-3β信號通路,以探討金絲桃苷發揮抗炎作用的分子機制,結果發現特異性地阻斷Akt/GSK-3β信號在逆轉金絲桃苷抗炎作用的同時,也消除了金絲桃苷減輕腦水腫、減少血腦屏障破壞、改善神經功能等部分保護效應。以上結果提示Akt/GSK-3β調控的抗炎信號通路參與了金絲桃苷在SAH后的神經保護效應。

圖4 金絲桃苷對蛛網膜下腔出血(SAH)后大鼠神經保護效應與Akt/GSK-3β信號通路的關系[a:p-Akt、Akt、p-GSK-3β、GSK-3β蛋白表達的電泳圖;b:p-Akt/Akt水平;c:p-GSK-3β/GSK-3β 水平;d-h:TNF-α、IL-1β、IL-6、誘導型一氧化氮合酶(iNOS)、單核細胞趨化蛋白1(MCP-1)等炎癥因子水平;i:腦組織含水量;j:血腦屏障通透性;k:神經功能評分;與sham組比較,*P<0.05;與SAH+vehicle組比較,△P<0.05;與 SAH+Hyp 組比較,▲P<0.05]
本研究重點探討了金絲桃苷在大鼠SAH后EBI中的神經保護效應及其相關機制,主要發現有以下3點:(1)金絲桃苷能夠減輕SAH后的腦水腫、減少血腦屏障破壞并改善神經功能;(2)金絲桃苷能顯著下調SAH后的炎癥反應;(3)金絲桃苷在SAH后的神經保護效應與Akt/GSK-3β信號通路有關。
綜上所述,金絲桃苷治療可以激活Akt/GSK-3β相關的抗炎信號通路,減輕SAH后的腦水腫和血腦屏障破壞,促進神經功能恢復。金絲桃苷及其介導的Akt/GSK-3β信號通路有望成為治療SAH的潛在靶點。

