鼠李糖脂對7種常見植物病原真菌的室內活性評價
張賢玉 李佳寧 劉召陽 黃麗麗 馮浩


摘要:鼠李糖脂是一種生物代謝性質的表面活性劑,近年來被認為具有開發為生物源農藥的潛力而備受關注。為了揭示鼠李糖脂對常見植物病害的生防潛能,本研究評價了其對7種常見植物病原菌的室內抑菌活性,并揭示了鼠李糖脂處理對灰葡萄孢(Botrytis cinerea)菌絲形態的影響。結果發現,鼠李糖脂對所有供試菌株菌絲生長均有一定的抑制效果,其中對B. cinerea效果最為明顯,EC50為0.51μL·mL-1;組織學觀察發現鼠李糖脂處理后B. cinerea菌絲出現分支增多、畸形等現象。可見,鼠李糖脂在藥劑開發方面具有較大潛力,為其進一步研究與應用提供了一定的理論指導。
關鍵詞:EC50;菌絲形態觀察;生防潛力;鼠李糖脂;抑菌活性
中圖分類號:S-3
文獻標識碼:A
作者簡介:張賢玉(2000-),男,本科在讀。研究方向:植物保護。
病害是威脅作物安全生產的重要生物因素之一。當前防控植物病害依舊主要依賴化學藥劑,但是長期單一施用化學藥劑會帶來抗性風險、農藥殘留及環境污染等問題。因此,開發應用高效低毒的生物源藥劑變得越來越重要。鼠李糖脂是由假單胞菌或伯克氏菌類產生的一種生物代謝性質的生物表面活性劑。近年來,憑借低毒、可降解的優勢,在堆肥、促進植物養分吸收以及土壤修復等方面受到關注[1-3]。在植物病害防控應用方面,發現鼠李糖脂具有誘導植物抗性、抑制菌絲生長、水解病菌孢子、抑制孢子萌發以及阻止孢子移動等作用,個別國家已經將鼠李糖脂作為生物農藥備案[4,5]。然而,我國對鼠李糖脂的研究主要集中在食品、醫藥和環境保護等方面,對其在真菌病害防控方面的研究較少。
為了揭示鼠李糖脂對常見植物病害的生防潛能,本研究評價了其對7種常見植物病原菌的抑菌活性,并揭示了其對B.cinerea菌絲形態影響,為鼠李糖脂的進一步研究與應用提供一定的理論指導。
1材料與方法
1.1試驗材料
1.1.1供試菌株
供試菌株見表1。1.1.2培養基
馬鈴薯葡萄糖瓊脂培養基(PDA培養基)用于供試菌株培養及藥效測定。
1.1.3供試藥劑
鼠李糖脂原液,由浙江東杰生物科技有限公司提供。
1.2試驗方法
1.2.1供試菌株對鼠李糖脂的敏感性測定
用滅菌水將鼠李糖脂原藥稀釋成特定濃度的母液,吸取不同體積母液加入PDA培養基中,充分混合均勻,倒入培養皿制成不同濃度的含藥平板(表2)。以PDA培養基作為空白對照,每個濃度設置3次機械重復,試驗重復3次。
挑取待測病菌菌絲于空白PDA培養基25℃黑暗培養3d。打孔器滅菌后在菌落邊緣打取直徑為5mm的菌餅,倒置接種于含藥平板中央,25℃黑暗培養。利用十字交叉法測量皿內菌落直徑,計算菌絲生長抑制率,所用公式如下:
菌絲生長抑制率=[(對照菌落直徑-處理菌落直徑)/(對照菌落直徑-菌餅直徑)]×100%
以藥劑濃度的對數值為橫坐標(x),菌絲生長抑制率為縱坐標(y),作線性回歸分析,計算鼠李糖脂對供試菌株菌絲生長的EC50值和相關系數R2。
1.2.2鼠李糖脂對B.cinerea的菌絲形態影響觀察
將B.cinerea接種于空白PDA培養基(對照組)和1.00μL·mL-1濃度含藥培養基上。25℃黑暗培養2d后,挑取菌落邊緣,置于載玻片,利用光學顯微鏡觀察2組菌絲的形態差異。
2試驗結果
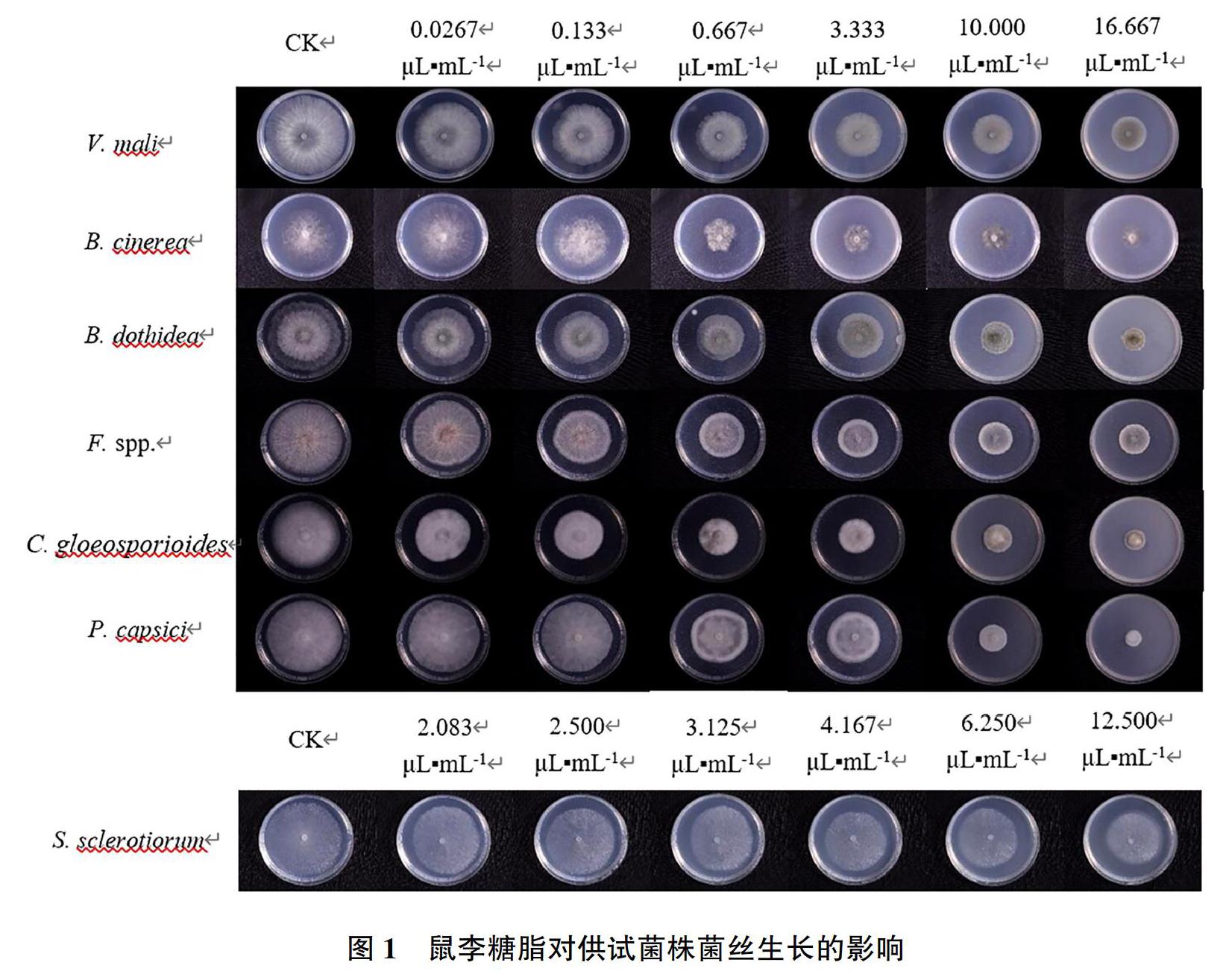
2.1供試菌株對鼠李糖脂的敏感性
試驗結果發現,鼠李糖脂對供試菌株菌絲生長均有一定抑制作用(表3、圖1)。其中對B.cinerea菌絲生長抑制作用最為明顯,EC50為0.51μL·mL-1。對V.mali、B.dothidea、F.spp.、C.gloeosporioides、P.capsici抑制效果較好,EC50在1.13~4.76μL·mL-1;對S.sclerotiorum抑制效果較差,EC50為24.20μL·mL-1。
2.2鼠李糖脂對B.cinerea的菌絲形態影響
1.00μL·mL-1鼠李糖脂處理2d后,B.cinerea菌絲形態發生明顯變化,處理組較對照組菌絲分支明顯增多(圖2a-A);處理組菌絲出現畸形,多扭曲,少數膨大,對照組則菌絲細直,不彎曲(圖2b-B);處理組細胞長度變短,較對照組細胞明顯縮短(圖2c-C)。
3討論
《全國農業現代化規劃(2016—2020年)》指出,我國農業現代化已經進入了新的發展階段,但仍然面臨糧食生產安全、食品質量安全、農田環境污染等眾多問題,其中長期單一過量使用化學藥劑進行植物病害防控存在農業污染、農藥殘留、病原菌抗藥性增強等系列問題。因此,生物源藥劑的研發和應用具有重要意義。鼠李糖脂是一種由1~2個鼠李糖分子與1~2個β-羥基脂肪酸形成共價結構而組成的一類糖脂分子。其是一種非常有效的生物源表面活性劑,在國際化、綠色化背景下,鼠李糖脂以其低毒、可降解的優點,在堆肥、土壤修復等各方面的應用中獲得越來越多的關注。
前期已有研究發現,鼠李糖脂能夠水解瓜果腐霉菌(Pythium aphanidermatum)等卵菌的孢子[6-8],并能夠抑制甘蔗鐮孢霉菌(Fusarium sacchari)、尖鐮孢菌(Fusarium oxysporum)等真菌的菌絲生長[9,10]。同時,能夠抑制茄鏈格孢菌(Alternaria solani)和辣椒炭疽菌(Colletotrichum capsici)的孢子萌發[11,12]。特別是在番茄灰霉病防控方面,Varnier等[13]發現鼠李糖脂能夠提高植物幾丁質酶和β-1,3-葡聚糖酶基因的表達水平激活植物PTI從而提高植物對灰霉病的防控效果。本研究評價了鼠李糖脂對7種常見植物病原菌的抑菌活性,并揭示了其對B.cinerea菌絲形態影響。研究結果發現,鼠李糖脂對供試菌株均有一定的抑制效果,其中對B.cinerea的抑菌效果最為顯著。由此可見,鼠李糖脂具有較大的開發為生物源藥劑的潛能。
參考文獻
[1]趙佳佳.鼠李糖脂二糖脂對堆肥中木質纖維素酶解的影響[D].長沙:湖南大學,2009.
[2]張莉.打頂和鼠李糖脂處理對西瓜前期生長及養分吸收效率的影響[D].杭州:浙江大學,2011.
[3]張澤霆.鼠李糖脂海水洗滌—生物降解修復沿海石油污染土壤的研究[D].舟山:浙江海洋大學,2018.
[4]劉菊.鼠李糖脂對西瓜枯萎病防治作用的研究[D].杭州:浙江大學,2012.
[5]王蕾,毛玉玲,許漢亮,等.鼠李糖脂防治植物真菌病害研究進展[J].廣東農業科學,2017,44(08):90-95.
[6]Kim BS, Lee JY, Hwang BK. In vivo control and in vitro antifungal activity of rhamnolipid B, a glycolipid antibiotic, against Phytophthora capsica and Colletotrichum orbiculare [J]. Pest Management Science, 2000, 56(12): 1029-1035.
[7] Stanghellini ME, Miller RM. Biosurfactants: Their identity and potential efficacy in the biological control of zoosporic plant pathogens [J]. Plant Disease, 1997, 81(1): 4-12.
[8] De Jonghe K, De Dobbelaere I, Sarrazyn R, et al. Control ofPhytophthora cryptogea in the hydroponic forcing of witloof chicory with the rhamnolipid based-biosurfactant formulation PRO1[J]. Plant Pathology, 2005, 54(2): 219-226.
[9] Goswami D, Handique PJ, Deka S. Rhamnolipid biosurfactant againstFusarium sacchari the causal organism of pokkah boeng disease of sugarcane[J]. Journal of Basic Microbiology, 2014, 54(6): 548-557.
[10] Borah SN, Goswami D, Lahkar J, et al. Rhamnolipid produced by Pseudomonas aeruginosa SS14 causes complete suppression of wilt by Fusarium oxysporum f. sp. pisi in Pisum sativum[J]. BioControl, 2015, 60(3): 375-385.
[11] Lahkar J, Borah SN, Deka S, et al. Biosurfactant of Pseudomonas aeruginosa JS29 against Alternaria solani: the causal organism of early blight of tomato [J]. BioControl, 2015, 60(3): 401-411.
[12] Lahkar J, Goswami D, Deka S, et al. Novel approaches for application of biosurfactant produced by Pseudomonas aeruginosa, for biocontrol of Colletotrichum capsica, responsible for anthracnose disease in chilli[J]. European Journal of Plant Pathology, 2018,150(1): 57-71.
[13]Varnier A L, Sanchez L, Vatsa P, et al. Bacterial rhamnolipids are novel MAMPs conferring resistance to Botrytis cinerea in grapevine[J]. Plant, Cell & Environment, 2009, 32(2): 178-193.
(責任編輯 周康)

