MyD88 抑制肽對LPS 誘導BV2 小膠質細胞極化狀態的抑制作用及其機制
楊吉平,費琳,柴學軍,茍興春
(1.西安醫學院基礎醫學研究所陜西省缺血性心血管疾病重點實驗室陜西省腦疾病防治重點實驗室,陜西 西安 710021;2.西安交通大學第一附屬醫院精神心理科,陜西 西安 710061)
小膠質細胞是機體發育過程中存在于中樞神經系統內的一類特異性免疫細胞,對顱腦內多種疾病的病理變化具有重要的調節作用[1]。近年來,不同極化狀態的小膠質細胞在神經炎癥中的功能變化逐漸被研究者所關注,促使小膠質細胞向選擇性激活狀態(M2 phenotype)極化,抑制其向經典激活狀態(M1 phenotype)極化,是治療腦創傷和腦缺血的一個潛在靶點[2-3]。存在于小膠質細胞膜表面的Toll 樣受體(Toll-like receptors,TLRs)是連接天然固有免疫和獲得性免疫應答的關鍵[4],髓樣分化因子88(myeloid differentiation factor 88,MyD88)是TLRs 下游接頭分子,也是TLRs 信號通路中的重要轉導蛋白,TLRs/MyD88 信號通路及其調控的基因表達產物在適應性免疫應答中發揮著重要作用[5]。研究[6]表明:蛛網膜下腔出血后MyD88 的選擇性抑制劑ST2825 通過降低其下游信號核因子κB(nuclear factor-κB,NF-κB)和絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)的激活,減輕炎性反應,減弱促凋亡信號,從而對蛛網膜下腔出血后的腦損傷具有保護作用。本課題組前期研究[7]結果顯示:體外神經元氧-糖剝離(oxygen-glucose deprivation,OGD)處理后可使MyD88 蛋白的表達水平明顯上調。然而,阻斷或抑制MyD88 對小膠質細胞的極化狀態是否有影響尚未見報道。因此,本研究采用脂多糖(lipopolysaccharide,LPS)誘導BV2 小膠質細胞建立體外炎癥模型,探討MyD88 抑制肽(MyD88 inhibitory peptide,MIP)能否對抗LPS 誘導的炎癥反應,并調控小膠質細胞的極化狀態,為腦缺血和腦創傷等疾病的治療提供新的策略。
1 材料與方法
1.1 細胞、主要試劑和儀器BV2 小膠質細胞為小鼠來源的小膠質細胞株,購自中國醫學科學院基礎醫學研究所。DMEM 培養基和胎牛血清(fetal bovine serum,FBS)購自美國Gibco 公司,噻唑藍(MTT)和LPS 購自美國Sigma 公司,兔抗小鼠誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗體購自英國Abcam 公司,山羊抗小鼠精氨酸酶1(arginase-1,Arg-1)抗體購自美國Santa Cruz 公司,抗小鼠β-actin 購自上海Beyotime 公司,MIP 和對照肽(control peptide,CP)購自美國Novus Biologicals 公司。Multiskan FC 酶標儀購自美國Thermo 公司,超微量核酸分析儀購自杭州Allsheng 公司,7500 型實時熒光定量PCR 儀購自美國ABI 公司,Western blotting 成像采用上海Tanon 4600 全自動化學發光系統。實驗中所用引物由西安擎科澤西生物科技有限公司合成。
1.2 細胞培養和實驗分組將BV2 小膠質細胞用含10% FBS 的DMEM 完全培養基于5% CO2、37℃條件下傳代培養。取對數生長期細胞調整成密度為每毫升2×105個細胞,接種到96 孔細胞培養板中,每孔100 μL,于細胞培養箱中貼壁培養3~4 h。實驗分為對照組,LPS 組,低、中和高劑量MIP+LPS 組。MIP 和 CP 在使用前均用0.01 mol·L-1PBS 緩沖液(pH7.4)溶解成5 mmol·L-1的儲備液。待細胞貼壁后棄掉上清,對照組細胞每孔加DMEM 培養基100 μL,LPS 組細胞每孔加入80 μL DMEM 和10 μL CP,低、中和高劑量MIP+LPS 組每孔加入80 μ L DMEM 和10 μL MIP(MIP 用DMEM 培養基依次稀釋至終濃度為25、50 和100 μmol·L-1),培養1 h 后,分別向LPS 組和不同劑量MIP+LPS 組各孔加入LPS 10 μL(LPS 用雙純水稀釋,工作濃度為1 mg·L-1),將96 孔細胞培養板置于5% CO2、37℃細胞培養箱中繼續培養24 h,進行后續實驗。
1.3 細胞存活率測定BV2 小膠質細胞培養24 h后,每孔中加入10 μL MTT 液(5 g·L-1),繼續培養4 h,每孔加入DMSO 150 μ L,震蕩 10~15 min,至藍紫色的甲臜顆粒完全溶解,于自動酶標儀490 nm 處測定各孔吸光度(A)值,計算各組細胞存活率,細胞存活率=(干預組A 值-空白孔A 值)/(對照組A 值-空白孔A 值)×100%。活化率的計算方法為各組細胞隨機拍3~5 個視野,形態學觀察“阿米巴狀”活化細胞占該視野總細胞數的百分比,采用Image J 軟件進行統計。
1.4 實時熒光定量PCR(RT-qPCR)法檢測各組細胞因子mRNA 表達水平采用Trizol 法提取各孔細胞總RNA,按照TaKaRa 逆轉錄試劑盒說明書步驟進行反轉錄cDNA,分裝保存,然后按組別分別加入反應體系,反應體系:2×SYBRⅡMix 5 μL,Rox 0.2 μL,引物(10 μmol·L-1)1 μL,cDNA 1 μL,RNase free dH2O 2.8 μL,每孔10 μ L,設3 個復孔。引物序列見表1。反應條件:94℃預變性4 min;94℃變性30 s,58℃退火30 s,72℃延伸45 s,共循環30 次;72℃延伸5 min。采用2-△△Ct法計算目的基因mRNA 表達水平,目標基因mRNA 水平通過與同組GAPDH mRNA 水平標準化后進行組間比較。
1.5 Western blotting 法檢測各組細胞中iNOS 和Arg-1 蛋白的表達水平BV2 細胞培養24 h 后,棄掉上清,分別加入終濃度為1 mmol·L-1PMSF 的RIPA 裂解液100 μL,在冰上超聲裂解15 min,4℃、12 000 r·min-1離心20 min;將上清液轉移至另一離心管中,Bradford 法檢測蛋白水平。每孔取30 μg 總蛋白上樣,以SDS-PAGE 電泳分離蛋白質,濕轉至PVDF 膜,用5% 脫脂奶粉封閉1 h,TBST 漂洗,分別加入一抗:iNOS(1 ∶300)、Arg-1(1∶300)和β-actin(1∶3 000),4℃過夜,TBST 漂洗后,加入HRP 標記的相應種屬源的二抗(1∶5 000),室溫孵育2 h。TBST 漂洗4 次,ECL 發光。采用Image J 軟件進行蛋白表達條帶灰度分析。目的蛋白表達水平=目的蛋白條帶灰度值/β-actin 條帶灰度值。
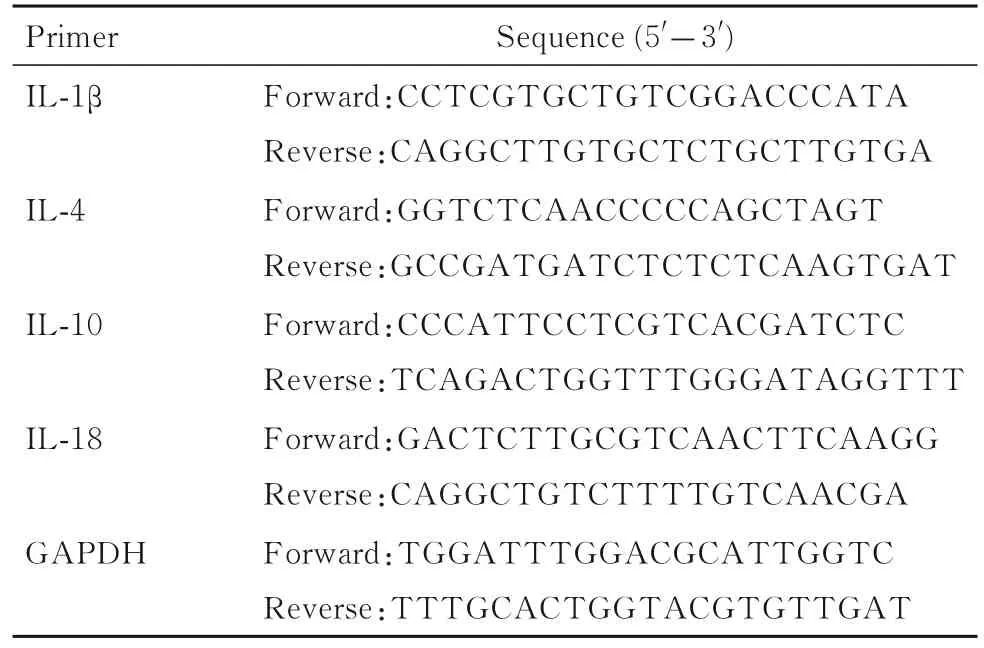
表1 引物序列Tab.1 Sequences of primers
1.6 統計學分析采用SPSS 19.0 統計軟件進行統計學分析。各組BV2 小膠質細胞的細胞存活率、4 種細胞因子mRNA 表達水平以及各組細胞中iNOS 和Arg-1 蛋白表達水平均符合正態分布,以表示,多組間樣本均數比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。以P<0.05為差異有統計學意義。
2 結果
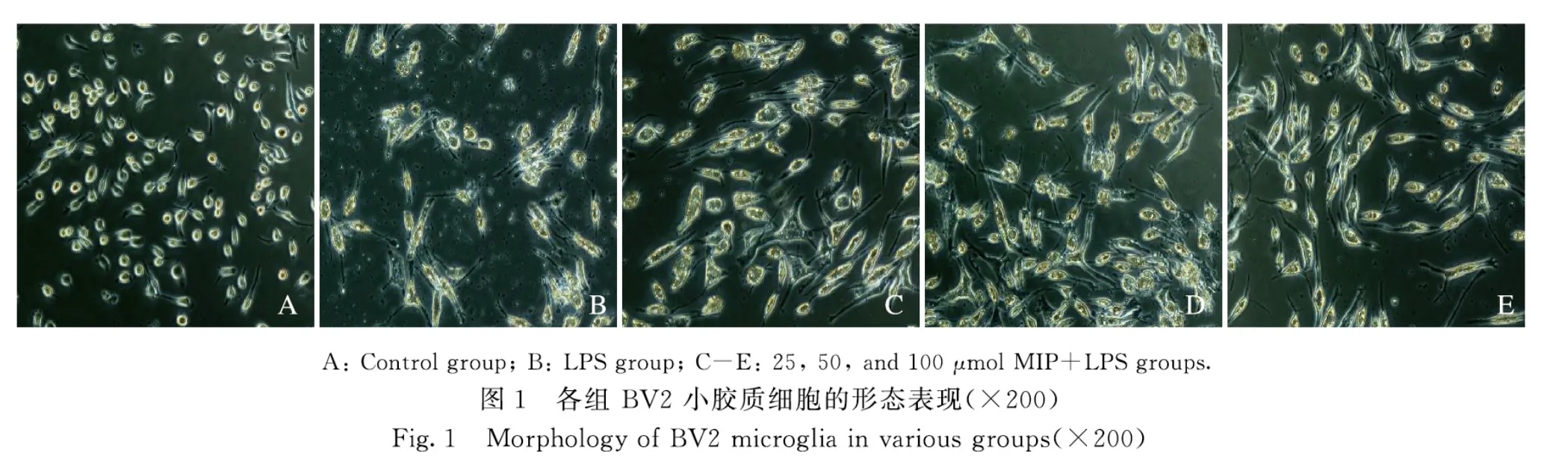
2.1 各組BV2 小膠質細胞形態表現對照組BV2 小膠質細胞胞體較小,以圓形或類圓形居多,突起較少;LPS 組細胞胞體明顯變大,突起增多,部分突起變粗變短,有時可見小棘,呈典型的“阿米巴狀”;不同劑量MIP+LPS 組BV2 小膠質細胞較LPS 組細胞突起變細變少,呈梭形,見圖1。采用Image J 軟件對活化的BV2 細胞進行統計,不同劑量MIP+LPS 組BV2 小膠質細胞的活化率較 LPS 組明顯降低(P<0.05 或P<0.01),見表2,且呈劑量依賴性,表明MIP 對LPS 激活BV2 小膠質細胞具有明顯抑制作用。
2.2 各組BV2 小膠質細胞存活率與對照組比較,LPS 組BV2 小膠質細胞存活率明顯降低(P<0.01);與LPS 組比較,不同劑量MIP +LPS 組BV2 小膠質細胞存活率明顯升高(P<0.05 或P<0.01),且呈一定的劑量依賴性。見表2。
2.3 各組 BV2 小膠質細胞中 IL-1 β、IL-18、IL-4 和IL-10 mRNA 表達水平與對照組比較,LPS 組BV2小膠質細胞中M1型細胞因子IL-1β 和IL-18mRNA表達水平明顯升高(P<0.01)。與LPS 組比較,不同劑量MIP+LPS 組BV2 小膠質細胞中IL-1β 和IL-18 mRNA 的表達水平明顯降低(P<0.05 或P<0.01),而M2 型細胞因子IL-4 和IL-10 mRNA 表達水平明顯升高(P<0.05 或P<0.01),且呈劑量依賴性。見表3。
表2 各組BV2 小膠質細胞活化率和存活率Tab.2 Activation rates and survival rates of BV2 microglial cells in various groups(n=8,,η/%)

表2 各組BV2 小膠質細胞活化率和存活率Tab.2 Activation rates and survival rates of BV2 microglial cells in various groups(n=8,,η/%)
*P<0.01 compared with control group;ΔP<0.05,ΔΔP<0.01 compared with LPS group.
2.4 各組BV2 小膠質細胞中iNOS 和Arg-1 蛋白表達水平與對照組比較,LPS 組BV2 小膠質細胞中iNOS 蛋白表達水平明顯升高(P<0.01),Arg-1 蛋白表達水平明顯降低(P<0.01);與LPS 組比較,不同劑量MIP+LPS 組BV2 小膠質細胞中iNOS 蛋白表達水平明顯降低(P<0.05 或P<0.01),而Arg-1 蛋白表達水平明顯升高(P<0.01)。見圖2 和表4。
3 討論
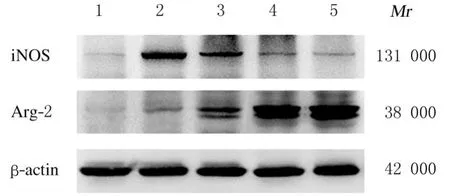
圖2 各組BV2 小膠質細胞中iNOS 和Arg-1 蛋白表達電泳圖Fig.2 Electrophoregram of expressions of iNOS and Arg-1 protein in BV2 microglial cells in various groups
BV2 小膠質細胞是源于小鼠腦內的小膠質細胞經過逆轉錄病毒v-raf/v-myc 轉染獲得的永生細胞,建立于1990 年,該細胞保留了小膠質細胞形態、表型和多種功能[8]。由于原代培養的小膠質細胞來源有限,細胞增殖分裂能力差,操作過程繁瑣,獲得的細胞數量較少,不能很好地適應體外研究需要,因此一般采用BV2 細胞系替代小膠質細胞進行體外實驗。LPS 是一種強力炎性反應誘導劑,可通過激活BV2 小膠質細胞構建體外神經炎癥模型[9]。本研究結果顯示:經1 mg·L-1LPS 刺激后,BV2 小膠質細胞胞體明顯變大,突起變粗變短,呈典型的“阿米巴狀”,表明BV2 小膠質細胞在LPS 刺激下呈激活形態;MTT 法檢測結果顯示:LPS 組BV2 小膠質細胞存活率低于對照組,這與文獻報道[10-11]相一致。
近年來,不同極化狀態的小膠質細胞在神經炎癥中的功能變化逐漸被研究者所重視,當腦組織受到各種傷害性刺激(創傷、缺血和感染等)時,小膠質細胞即從靜息態(M0)轉變為M1 型或M2 型[12-13],iNOS 是M1 型小膠質細胞表面主要的標記物之一[14]。本研究結果顯示:BV2 小膠質細胞經LPS 處理后iNOS 蛋白表達水平較對照組明顯升高,表明LPS 可使小膠質細胞向M1 方向極化;RT-PCR 法檢測結果顯示:LPS 組BV2 小膠質細胞中IL-1β 和IL-18 mRNA 表達水平較對照組明顯升高,提示LPS 可增加M1 型小膠質細胞分泌促炎性細胞因子。
表3 各組BV2 小膠質細胞中IL-1β、IL-18、IL-4 和IL-10 mRNA 表達水平Tab.3 Expression levels of IL-1β,IL-18,IL-4 and IL-10 mRNA in BV2 microglial cells in various groups (n=8,)
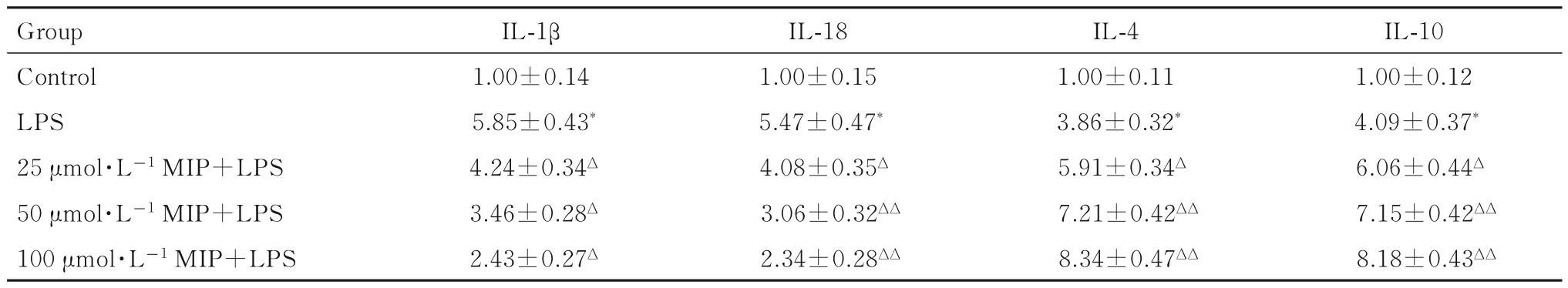
表3 各組BV2 小膠質細胞中IL-1β、IL-18、IL-4 和IL-10 mRNA 表達水平Tab.3 Expression levels of IL-1β,IL-18,IL-4 and IL-10 mRNA in BV2 microglial cells in various groups (n=8,)
*P<0.01 compared with control group;ΔP<0.05,ΔΔP<0.01 compared with LPS group.
表4 各組BV2 小膠質細胞中iNOS 和Arg-1 蛋白表達水平Tab.4 Expression levels of iNOS and Arg-1 proteins in BV2 microglial cells in various groups(n=8,)
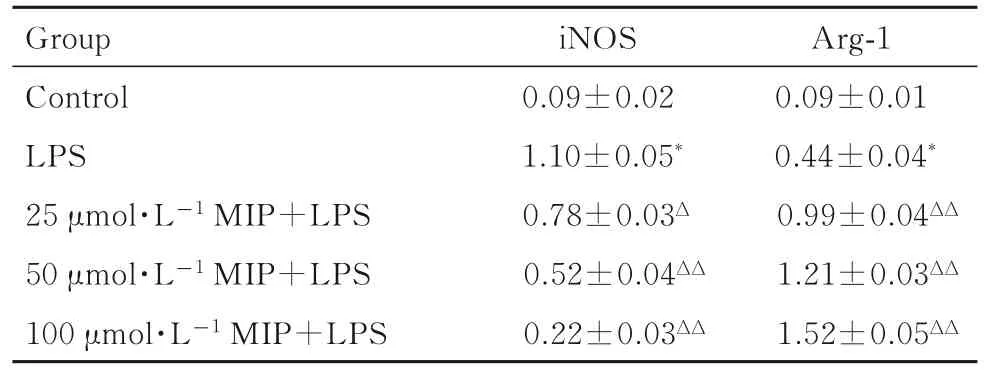
表4 各組BV2 小膠質細胞中iNOS 和Arg-1 蛋白表達水平Tab.4 Expression levels of iNOS and Arg-1 proteins in BV2 microglial cells in various groups(n=8,)
*P<0.01 compared with control group;ΔP<0.05,ΔΔP<0.01 compared with LPS group.
MyD88 是TLRs 和IL-1 家族信號通路在胞內的一個關鍵接頭蛋白,與多種炎癥性疾病的發生發展密切相關[15-17]。研究[18]表明:MyD88 基因敲除可減少癲癇持續狀態后小鼠海馬中炎癥反應,增加癲癇模型小鼠海馬CA1 區谷氨酸轉運蛋白-1 的表達,從而減少錐體神經元凋亡。本研究應用25、50 和100 μmol·L-1MIP 干預BV2 小膠質細胞后結果顯示:不同劑量MIP+LPS 組活化細胞的數目較LPS 組明顯減少,細胞存活率較LPS 組明顯提高,且呈一定的劑量依賴性,表明MIP 對LPS 激活BV2 小膠質細胞具有一定的抑制作用。M2 型小膠質細胞標記物包括Arg-1、CD163、CD206、CD209、Ym1、Fizzl 和甘露糖受體(mannose receptor,MR)等[19]。本研究結果顯示:與模型組比較,MIP 可劑量依賴性地上調BV2 小膠質細胞體外炎癥模型Arg-1 蛋白的表達水平,表明通過抑制MyD88 信號通路可使小膠質細胞向M2 方向極化,從而抑制炎癥反應,促進組織修復。
M1 型小膠質細胞能產生腫瘤壞死因子α(TNF-α)、IL-1、IL-6、IL-18 和IL-23 等促炎性細胞因子,以及多種趨化因子,促進炎癥和產生組織損傷,對神經元產生毒性作用[20]。M2 型小膠質細胞能分泌轉化生長因子β1(TGF β1)、IL-4 和IL-10 等抗炎性細胞因子,能夠抑制過度的炎性反應,有利于清除壞死組織,促進組織修復和神經元再生[21]。本研究結果顯示:LPS 組BV2 小膠質細胞M1 型細胞因子IL-1β 和IL-18 mRNA 表達水平較對照組明顯升高;與LPS 組比較,不同劑量MIP +LPS 組BV2 小膠質細胞M2 型細胞因子IL-4 和IL-10 mRNA 的表達水平明顯升高,且呈劑量依賴性,表明MIP 可抑制LPS 誘導的促炎因子釋放,劑量依賴性地增加抗炎細胞因子的分泌。
綜上所述,本研究利用MyD88 的選擇性抑制劑MIP 作用于LPS 誘導的BV2 小膠質細胞炎癥模型,結果顯示:MIP 能有效抑制BV2 小膠質細胞向M1 型極化,促進其向M2 型表型轉化,抑制炎癥的過度激活。因此,通過阻斷或抑制MyD88 表達調節小膠質細胞的極化表型,可作為一個潛在的腦卒中和腦創傷等治療策略。然而,MIP 促使小膠質細胞向M2 型轉化的具體分子機制及其能否直接發揮神經元保護作用還需進一步研究。

