舒肝解郁膠囊對心肌梗死后抑郁大鼠行為學表現及心室電生理的影響
武秀麗,劉 俊,陳居剛,丁玉琴,張錄平,徐文芳,許靜雯,孫可可,林 艷,史 培
抑郁與心肌梗死之間存在密切的雙向關系,大約20%的心肌梗死病人有重度抑郁障礙或抑郁狀態,而主訴抑郁癥狀可使急性心肌梗死增加1.31倍,心肌梗死后抑郁也可使24個月內心血管功能受損風險增加1.6~2.7倍[1-2]。研究表明,抑郁與異常的心臟電生理特征有關,如QT間期延長和心率變異性降低,并顯著增加室性心律失常(VA)和心臟猝死的風險,基礎研究也顯示,交感神經過度激活和心肌重構惡化可能是其不良預后的一種機制[3-4]。舒肝解郁膠囊主要由刺五加和貫葉金絲桃組成,是一種純中藥復合制劑,具有舒肝解郁、健脾安神的功效,其作用機制可能是由于抑制中樞的神經遞質再攝取或單胺氧化酶,使突觸間隙的單胺遞質濃度升高而發揮抗抑郁作用[5]。有研究表明,舒肝解郁膠囊可治療冠心病經皮冠狀動脈介入術(PCI)后合并輕度焦慮抑郁癥病人[6],然而舒肝解郁膠囊對心肌梗死后抑郁的行為學表現以及心室電生理作用的具體機制還未闡明,為此,本研究擬建立急性心肌梗死模型與慢性輕度不可預見性應激抑郁大鼠模型,應用行為學評價及心臟電生理技術,探究舒肝解郁膠囊的作用及機制。
1 材料與方法
1.1 實驗動物 SD健康成年雄性大鼠65只,體重(293±13)g,購于哈爾濱醫科大學附屬第二醫院動物實驗中心。
1.2 模型制備
1.2.1 急性心肌梗死模型 烏拉坦(800 mg/kg)與α-氯醛糖(40 mg/kg)聯合進行腹腔注射麻醉。麻醉后固定于鼠板上進行常規消毒、鋪巾、四肢皮下心電圖監測(GY-6328多道生理記錄儀,河南華南醫電科技有限公司),氣管插管連接動物呼吸機進行機械通氣(潮氣量3~4 mL/100 g,呼吸頻率70~80次/min),由第4肋間入胸,鈍性分離肋間肌,撕開心包,暴露心臟,在左心耳和肺動脈圓錐的交界和心尖連線上結扎冠狀動脈前降支,結扎區域心臟組織變白、心臟運動減弱以及心電圖兩個以上肢體導聯出現ST 段上抬≥0.2 mV作為急性心肌梗死建模成功的標準。術后連續3 d腹腔注射青霉素40萬U以預防傷口感染。
1.2.2 抑郁模型 根據文獻應用慢性不可預見性溫和應激建立抑郁模型[7],步驟如下:鼠籠45 ℃傾斜24 h,鼠籠搖晃15 min,禁食24 h,禁水24 h,潮濕墊料24 h,行為限制2 h,4 ℃冷水游泳5 min,42 ℃熱水游泳5 min,夾尾1 min,36 h持續光照,捕食者聲音刺激30 min。將上述11種刺激隨機安排到28 d內,每日1種刺激。同種刺激不連續出現,以使動物不能預料刺激的發生。
1.3 分組與給藥方法 將大鼠隨機分為5組:正常對照組(10只),心梗組(15只),抑郁組(10只),心梗后抑郁組(15只),舒肝解郁膠囊干預組(15只)。舒肝解郁膠囊干預組每日灌胃1%舒肝解郁膠囊3 mL/kg,其余各組同時灌胃3 mL/kg生理鹽水,連續28 d。
1.4 行為學評價 從心肌梗死第5周開始對所有存活大鼠進行行為學評價,包括糖水消耗及曠場試驗。
1.4.1 糖水消耗試驗 在正式試驗進行前,對所有大鼠進行訓練,適應含糖飲水。安靜房間,第1個24 h先將2瓶均裝1%蔗糖水同時放置于每籠,第2個24 h改換為1瓶1%蔗糖水和1瓶純凈水。隨后禁水24 h開始正式試驗,定量放置1瓶1%蔗糖水和1瓶純凈水,1 h后調換二者位置,2 h后實驗結束。動物糖水消耗百分比=糖水消耗量/總液體消耗量×100%。
1.4.2 曠場試驗 所有動物在每天相同時間點放置于75 cm×75 cm×40 cm的曠場中心內,使用自動跟蹤系統記錄并分析大鼠在曠場內10 min的總行程、平均運動速度以及直立次數。每只大鼠依此單獨試驗,每只結束后將曠場清理干凈。
1.5 血漿去甲腎上腺素(NE)水平檢測 NE是評價交感神經活性的重要指標,在進行行為學評價后采集主動脈血液,血漿NE測定根據酶聯免疫吸附實驗(ELASA)試劑盒(武漢華美生物)說明書進行操作。
1.6 心室電生理 實驗最后所有存活的動物利用心臟程序性刺激測定梗死周邊區及遠離梗死區的心室有效不應期(VERP)及心室顫動閾值(VFT)。SlS2負向掃描法,8個連續起搏周長S1S1 120 ms,S1S2 100 mm以2 mm的幅度遞減法測定VERP,VERP為S2不能引起心室除極的最長S1S2間期。而以右心室心尖部為起搏(500次/min)部位采用S1S1程序刺激測定VFT,刺激周長60 ms,脈寬10 ms,每次刺激持續30 s,間斷1 min進行下次刺激,刺激電壓從起搏閾值開始,每次以1 V遞增直至誘發心室顫動,心室顫動閾值定義為能誘發持續性心室顫動的最小刺激電壓。
2 結 果
2.1 動物模型 至心肌梗死28 d后,共53只大鼠存活,其中正常對照組10只,心梗組11只,抑郁組10只,心梗后抑郁組10只;舒肝解郁膠囊干預組12只。舒肝解郁膠囊干預組的生存率(80%,12/15)稍高于心梗后抑郁組(67%,10/15)和心梗組(73%,11/15)。
2.2 各組行為學表現結果比較 與正常對照組比較,心梗組、抑郁組、心梗后抑郁組糖水消耗量、運動量及直立次數明顯減少(P<0.05),提示這3組大鼠快感降低、活動度及空間探索減少;與心梗組及抑郁組比較,心梗后抑郁組糖水消耗量、運動量明顯減少(P<0.05)。舒肝解郁膠囊干預組糖水消耗量、運動量、直立次數較心梗后抑郁組明顯升高(P<0.05)。詳見表1。
表1 各組行為學表現結果比較 (±s)
2.3 各組血漿NE水平比較 與正常對照組比較,心梗組、抑郁組及心梗后抑郁組血漿NE水平明顯增加(P<0.05),提示交感神經活性增加。心梗后抑郁組NE水平高于心梗組及抑郁組(P<0.05)。舒肝解郁膠囊干預組血漿NE水平較心梗后抑郁組明顯下降(P<0.05)。詳見圖1。
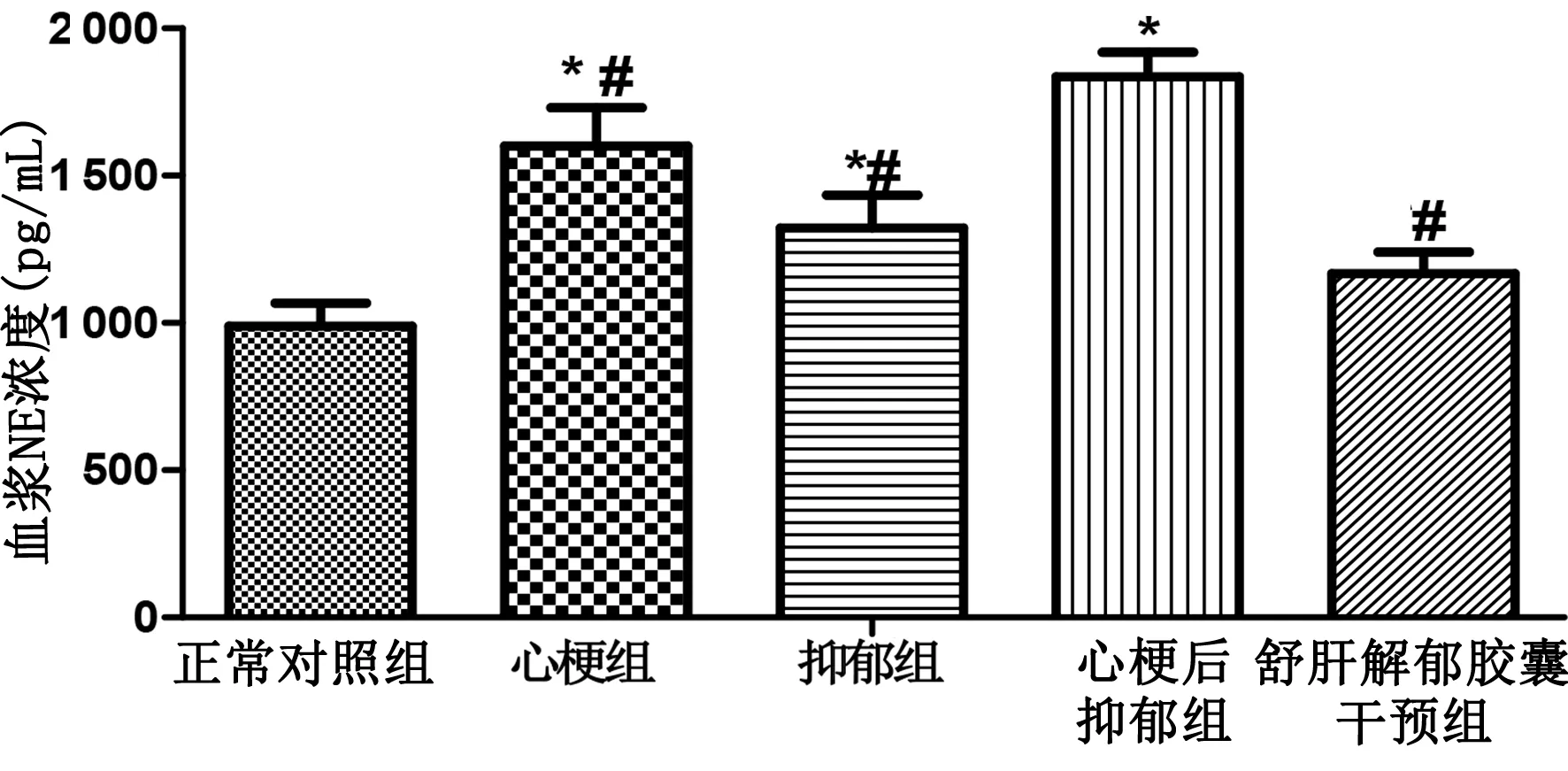
與正常對照組比較,*P<0.05;與心梗后抑郁組比較,#P<0.05。
2.4 各組心室電生理結果比較 心室ERP和VFT是評價心室電不穩定性的重要指標,對預測惡性室性心律失常發生有重要意義。與正常對照組比較,心梗組、抑郁組及心梗后抑郁組大鼠梗死周邊區VERP明顯增加,而VFT明顯降低(P<0.05);心梗后抑郁組梗死周邊區VERP高于心梗組與抑郁組,VFT低于心梗組與抑郁組(P<0.05);舒肝解郁膠囊干預組梗死周邊區VERP及VFT較心梗后抑郁組均明顯改善(P<0.05)。詳見表2。
表2 各組心室電生理結果比較 (±s)
3 討 論
根據世界衛生組織統計,目前全世界抑郁癥病人達3.5億人,抑郁癥可能成為僅次于心腦血管病的第二大疾病[8]。有薈萃分析顯示:心肌梗死后抑郁與不良預后獨立相關,在調整心臟病嚴重程度后,全因死亡率增加22%,心血管事件風險增加13%[9]。抑郁癥容易誘發室性心律失常,是心臟性猝死(sudden cardiac death,SCD)的獨立預測因子。有研究顯示,交感神經過度激活可能是抑郁癥發生的主要機制[4]。
本研究旨在探討舒肝解郁膠囊對心肌梗死后抑郁大鼠交感神經和心室電生理的作用,以明確舒肝解郁膠囊治療心肌梗死后抑郁的機制。本研究通過冠狀動脈結扎及慢性輕度不可預見性應激誘導來構建心肌梗死抑郁模型,結果顯示,心梗后抑郁組大鼠糖水消耗量、運動量及直立次數均降低,上述結果被用來模擬經典的抑郁核心癥狀,這與既往研究一致,4周慢性輕度不可預見性應激程序可誘導出穩定的抑郁樣行為[4,7];而舒肝解郁膠囊干預后上述抑郁癥狀明顯改善,提示舒肝解郁膠囊可改善心肌梗死后抑郁大鼠的行為學表現。抑郁組和心梗后抑郁組大鼠血漿NE明顯增加,表明抑郁狀態下交感神經過度激活,而在體心臟電生理結果表明,抑郁組、心梗組及心梗后抑郁組大鼠梗死周邊區VERP明顯增加,而VFT明顯降低,提示心肌梗死抑郁大鼠交感神經活性明顯增加,心室電不穩定性升高,這與既往抑郁模型大鼠心臟交感神經活性和心室電生理的研究[4,10]類似。給予舒肝解郁膠囊干預后,心肌梗死抑郁大鼠交感神經活性明顯降低,心室電不穩定性明顯改善,表明舒肝解郁膠囊可改善心肌梗死抑郁大鼠抑郁狀態及心室電不穩定性。
近年來,基礎與臨床研究發現,抑郁癥與冠心病有許多共同發病機制,如應激機制、血小板活性與5-羥色胺的影響、炎癥反應、社會心理以及生物行為[11-13]。交感神經激活是心肌梗死后惡性室性心律失常和心源性猝死的重要原因之一,目前干預交感神經已成為防治心源性猝死的重要靶點,本研究結果提示,抑郁癥可進一步增加心肌梗死大鼠交感神經活性。
目前,冠心病合并抑郁的治療主要有3種:藥物治療、心理干預治療以及物理治療,其中藥物治療是基礎和關鍵,包括三環類抗抑郁藥、5-羥色胺再攝取抑制劑,但其副作用較大,病人耐受性差;而中藥在抑郁治療方面也發揮著一定作用,包括疏肝解郁、化痰解郁、補氣活血等[14-15]。舒肝解郁膠囊主要由刺五加和貫葉金絲桃組成,是一種純中藥復合制劑,具有舒肝解郁、健脾安神的功效,其作用機制可能是由于抑制中樞的神經遞質再攝取或單胺氧化酶,使突觸間隙的單胺遞質濃度升高而發揮抗抑郁作用[5]。有研究表明,舒肝解郁膠囊可治療冠心病PCI術后合并輕度焦慮抑郁癥,相對安全,不良反應少,病人易于接受[6],本研究也表明,舒肝解郁膠囊可改善心肌梗死后抑郁狀態及心室電不穩定性,為舒肝解郁膠囊防治心肌梗死后抑郁狀態以及室性心律失常提供了理論支持。
綜上所述,心肌梗死后抑郁可通過增加交感神經活性,進而增加心室電不穩定,而舒肝解郁膠囊可通過調節抑郁樣行為及交感神經活性,改善心室電不穩定性及預后。

