miR-135a靶向調控STAT6對前列腺癌細胞生物學行為的影響
趙宇明,張 悅,代 亮,張立民
(1.秦皇島市第一醫院 泌尿外科,河北 秦皇島066000;2.秦皇島市婦幼保健院 婦科,河北 秦皇島066000)
前列腺癌屬于一種在臨床上較為常見的泌尿系統惡性腫瘤,流行病學調查顯示,此病多發于中老年男性人群,目前隨著臨床上對前列腺癌的深入研究發現,此病的發生與年齡、種族和地理位置、遺傳與家族史、雄激素、代謝綜合征、生活習慣、飲食、基因等多因素相關[1,2]。手術、放療、化療等手段為前列腺癌的主要治療方式,雖然在一定程度上改善患者癥狀,但部分患者復發轉移率較高,其原因可能與癌細胞異常增殖、遷移、侵襲相關[3,4]。本文分析miR-135a靶向調控STAT6對前列腺癌細胞生物學行為的影響,報道如下。
1 材料與方法
1.1 材料
DU145前列腺癌細胞株由中國科學院上海生命科學研究所提供。主要試劑:miR-135a NC、Hsa-miR-135a均由上海吉瑪公司提供;Lipofectamine 2000試劑由Invitrogen公司提供;Takara逆轉錄試劑盒由美國GeneCopoeia提供;MTT試劑盒由艾美捷科技有限公司提供;小鼠抗大鼠MMP-2抗體、兔抗大鼠MMP-9抗體均由武漢益普生物科技有限公司提供;小鼠抗大鼠TIMP-2抗體由艾美捷科技有限公司提供;兔抗人Bcl-2抗體由上海雅吉生物科技有限公司提供;兔抗大鼠Bax抗體由武漢益普生物科技有限公司提供。
1.2 方法
1.2.1細胞培養 將DU145前列腺癌細胞株采用含10%胎牛血清、100 μg/mL青霉素、50 μg/mL鏈霉素雙抗的DMEM培養基在溫度為37℃、5% CO2、95%飽和濕度條件的孵育箱中做培養處理,根據細胞生長情況采用0.25%胰蛋白酶每周做傳代處理,處理2次,當細胞穩定進入至對數生長期時用于后續試驗。待細胞生長至培養皿底80%左右時,加2.5 g/L胰蛋白酶給予消化,1∶3傳代,采集對數生長的第一代細胞,分為空白組、miR-135a陰性對照組、miR-135a轉染組3組。
1.2.2細胞轉染 三組細胞每孔設置為3個復孔,分別加入100 μl 1×105個/mL細胞濃度的細胞懸液,培養至對數生長期,空白組加入常規細胞培養液、生理鹽水做空白處理,miR-135a陰性對照組加入miR-135a NC、Lipofectamine 2000試劑行無義序列轉染,miR-135a轉染組加Hsa-miR-135a、Lipofectamine 2000試劑行轉染。
1.2.3細胞miR-135a、STAT6 mRNA表達量檢測 采用熒光定量RT-PCR技術鑒定miR-135a轉染效率,并檢測STAT6 mRNA表達量。取細胞,采用Trizol法提取細胞總RNA,檢測RNA純度、含量,使用Takara逆轉錄試劑盒行逆轉錄處理后獲得cDNA,采用Primer 5.0軟件設計引物序列,采用2-△△Ct方法計算。反應體系:0.4 μl上下游引物、1 μl cDNA模板、10 μl SYB Green,加蒸餾水至20 μl。反應條件:95℃預變性1 min、94℃ 30 s、60℃ 30 s,72℃ 30 s,72℃ 5 min,共進行30個循環。miR-135a引物序列:上游:5’-CCGACGCGTTCTTTTCTGTTGCCCCATC-3’,下游:5’-CCCA-AGCTTGGACCGCAGCACCTATCT-3’;STAT6引物序列:上游:5’-AGGAGAGCAGGGGAAAGGAAG-3’,下游:5’-TGGCAGGTGGTGGAACTC-TT-3’。內參基因U6引物序列:上游:5’-CTCGC-TTCGGCAGCACA-3’,下游:5’-AACGCTTCAC-GAATTTGCGT-3’。
1.2.4細胞增殖檢測 使用MTT比色法檢測三組細胞增殖情況,在細胞培養后將細胞濃度調整至3×104個/ml,接種于96孔板中,將200 μl細胞懸液加入至每孔中,在37℃、5% CO2環境下培養24 h、48 h、72 h后,加入10 μl MTT試劑繼續孵育4 h,采用酶標儀測定波長為570 nm的細胞組OD值,計算三組細胞增殖率。細胞增殖率=(細胞組OD值/參照組OD值)×100%。
1.2.5細胞凋亡檢測 使用DxFLEX流式細胞儀、Annexiv-FITC/PI雙染細胞凋亡檢測試劑盒,檢測各組細胞凋亡情況,采用PBS重復洗滌細胞2次,取另一支試管,加入70%預冷的乙醇5 ml,用吸管吸取細胞懸液迅速吹入固定劑中(乙醇)振蕩混勻,4℃冰箱固定至少18 h。將離心固定后的細胞,用PBS洗2次,細胞濃度調整為為1×106個/ml,取1 ml,離心處理后將上清液棄除,加入1 ml PI染液,4℃冰箱避光染色30 min后上機檢測,記錄激發波長488 nm處熒光。
1.2.6細胞遷移檢測 采用細胞劃痕實驗檢測細胞遷移能力,實驗步驟:將細胞接種至18孔板待其增長到80%時,使用100 μl的槍頭,垂直劃出3條直線,使用PBS緩沖液清洗2-3次,分別加入0.5 %的血清培養基,觀察24 h之后,使用倒置顯微鏡觀察三組細胞的遷移數量。
1.2.7細胞侵襲檢測 采用Transwell小室檢測三組細胞侵襲能力,培養板中放置Transwell小室,細胞懸液接種于上室,100 ng/ml IL-8接種于下室,24 h后100 μg/ml TMP溶液入至下室,孵育24 h,將上室微孔中的細胞使用棉簽擦除,PBS反復洗滌3次(每次洗滌3 min)后,將其固定于4%多聚甲醛溶液中,固定處理15 min,使用蘇木精染色處理10 min,再次使用PBS洗滌,在倒置顯微鏡下觀察上室微孔下層的細胞數,觀察三組細胞侵襲能力。
1.2.8MMP-2、MMP-9、TIMP-2、Bcl-2、Bax蛋白檢測 采用Western Blot法檢測細胞MMP-2、MMP-9、TIMP-2、Bcl-2、Bax蛋白表達量,將細胞行10000×g離心處理10 min,對上清液進行提取后,BCA進行蛋白定量檢測,在2×SDS凝膠緩沖液中加入50 μg蛋白,在100℃環境中加熱5 min。凝膠電泳完轉膜,取膜,4 ℃環境下在5%脫脂牛奶中固定、封閉處理時間為1 h,一抗使用0.05%-0.1% TBST稀釋(MMP-2、MMP-9、TIMP-2、Bcl-2、Bax一抗為1∶1000),4℃孵育過夜保存,之后使用0.05%-0.1% TBST洗膜,3次,每次為5 min,二抗被0.05%-0.1% TBST稀釋(1∶10000),搖動孵育時間為 1 h,再次采用TBST連續洗膜3次,處理時間為5 min,DAB顯色,定量分析蛋白表達情況,以GAPDH為內參。
1.3 統計學處理
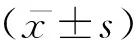
2 結果
2.1 轉染效率鑒定結果
如表1所示,與空白組相比,miR-135a陰性對照組miR-135a表達量降低,miR-135a轉染組miR-135a表達量升高,差異具有統計學意義(P<0.05),說明miR-135a轉染成功。
2.2 三組細胞STAT6 mRNA表達量對比
如表2所示,空白組、miR-135a陰性對照組、miR-135a轉染組STAT6 mRNA表達量比較,差異具有統計學意義(P<0.05);與miR-135a陰性對照組相比,miR-135a轉染組STAT6 mRNA表達量降低,差異具有統計學意義(P<0.05)。
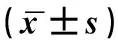
表1 轉染效率鑒定結果
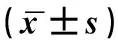
表2 三組細胞STAT6 mRNA表達量對比
2.3 三組細胞增殖、凋亡情況比較
如表3所示,空白組、miR-135a陰性對照組、miR-135a轉染組增殖、凋亡率比較,空白組、miR-135a轉染組均比miR-135a陰性對照組miR-135a轉染組增殖率降低,凋亡率升高,差異具有統計學意義(P<0.05)。
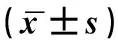
表3 三組細胞增殖、凋亡情況比較
2.4 三組細胞侵襲、遷移情況比較
如表4、圖1-2所示,空白組、miR-135a陰性對照組、miR-135a轉染組侵襲、遷移個數比較,差異具有統計學意義(P<0.05);與miR-135a陰性對照組相比,miR-135a轉染組侵襲、遷移個數降低,差異具有統計學意義(P<0.05)。
表4 三組細胞侵襲、遷移情況比較

圖1 三組細胞侵襲能力比較

圖2 三組細胞遷移能力比較
2.5 三組細胞MMP-2、MMP-9、TIMP-2、Bcl-2、Bax蛋白表達量比較
如表5、圖3所示,空白組、miR-135a陰性對照組、miR-135a轉染組MMP-2、MMP-9、TIMP-2、Bcl-2、Bax蛋白表達比較,差異具有統計學意義(P<0.05);與miR-135a陰性對照組相比,miR-135a轉染組MMP-2、MMP-9、Bcl-2蛋白表達量降低,TIMP-2、Bax蛋白表達量升高,差異具有統計學意義(P<0.05)。
表5 三組細胞MMP-2、MMP-9、TIMP-2、Bcl-2、Bax相關蛋白表達量比較
3 討論
微小RNA(miRNA)屬于一類較為重要的具有調控細胞發育、增殖、分化、應激的內源性單鏈非編碼小RNA分子,在轉錄水平上可調控多種基因的表達,使其降解和抑制翻譯過程[5]。目前臨床上隨著對前列腺癌的不斷深入研究發現,miRNA異常表達與此病的發生密切相關,可經調控基因表達發揮其促進腫瘤形成、進展、轉移過程。miR-135a為miR-135家族成員之一,其具有抑制癌細胞增殖、促進癌細胞凋亡的作用,在多種惡性腫瘤的發生發展中具有重要的作用[6]。有研究發現,miR-135a在喉癌[7]、膠質瘤[8]、胃癌[9]、非小細胞肺癌[10]中異常表達,其可經一系列的作用途徑促進癌細胞增殖,抑制癌細胞凋亡。Xu B等[11]在其研究中發現激素依賴前列腺癌組織中miR-135a的表達均高于激素非依賴前列腺癌組織,推測miR-135a表達異常亦可能與前列腺癌進展有關。本研究中構建miR-135a慢病毒載體,轉染至前列腺癌細胞中,結果顯示,轉染miR-135a后的前列腺癌細胞增殖、遷移、侵襲能力均被顯著抑制,且凋亡率顯著升高,提示,miR-135a與前列腺癌進展相關,提高其表達抑制癌細胞增殖、遷移,阻止疾病惡化,提高患者生存周期。
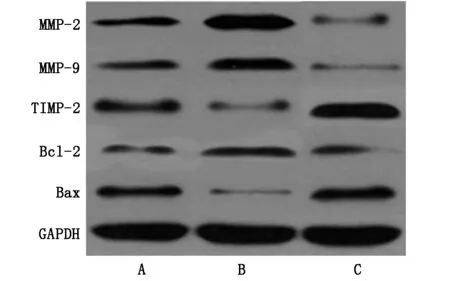
圖3 三組細胞MMP-2、MMP-9、TIMP-2、Bcl-2、Bax蛋白表達量WB圖
STATs屬于一類與細胞生長分化、細胞增殖、細胞凋亡、細胞免疫反應、惡性腫瘤發生的一種DNA結合蛋白,當其與分布于細胞表面的細胞因子受體發生特異性結合后會出現酪氨酸殘基磷酸化,形成二聚體,使其被激活,從細胞質中轉移至細胞核中,對其相應的細胞因子轉錄過程產生誘導作用[12,13]。STAT6為STAT家族成員之一,其相對分子量大約為94×103,可經作用于JAK-STAT信號轉導途徑促進多種細胞因子活化,參與機體多種生理病理變化過程,最終促進疾病的發生[14,15]。研究發現,miR-135a作用的靶基因為STAT6。本文研究結果顯示,經轉染miR-135a培養的前列腺癌細胞STAT6表達量顯著降低,此結果提示miR-135a可能經抑制STAT6表達,發揮其抑制癌細胞增殖、遷移、侵襲,促進凋亡的作用。
細胞增殖、凋亡過程與多基因相互作用相關,Bcl-2家族與此密切相關,Bcl-2家族包括抗凋亡蛋白Bcl-2和促凋亡蛋白Bax,兩者相互作用,促進癌細胞增殖,抑制癌細胞凋亡[16,17]。本文結果顯示,miR-135a轉染的前列腺癌細胞MMP-2、MMP-9、TIMP-2、Bcl-2、Bax蛋白表達明顯改善,提示著miR-135a轉染抑制前列腺癌細胞遷移、侵襲增殖的機制可能與作用于STAT6,調控MMP-2、MMP-9、TIMP-2、Bcl-2、Bax表達相關。

