利拉魯肽對2型糖尿病骨質疏松大鼠miRNA-19a、miRNA-144及骨密度的影響
王志剛 劉菊
武漢市第一醫院老年病科,湖北 武漢 430000
糖尿病性骨質疏松癥(diabetic osteoporosis,DOP)是目前臨床中常見的2型糖尿病合并癥,患者多表現為骨脆性增高、骨強度減弱、單位骨量減少和骨組織細微結構變化等全身性骨質病變[1]。有研究指出,2型糖尿病的多種并發癥中DOP是最為常見的多發性骨骼系統并發癥,一般情況下在出現DOP后患者極易出現骨折等不良預后的發生[2]。目前臨床中多采用增強骨密度和控制血糖等常規對癥方案進行干預治療,雖然其可有效改善患者主要癥狀,但對致病環境和體質改善的影響存在一定不足,且長時間治療極易導致患者出現多種不良反應[3]。有研究指出,胰島β細胞功能減退在2型糖尿病的發生和發展過程中起到十分重要的作用[4]。miRNA在胰島β細胞功能調控過程中起到十分重要作用,可有效維持并調節體內葡萄糖動態平衡[5]。利拉魯肽是經典的GLP-1類似物,可有效促進胰島素的合成與分泌,加速胰島素的生物合成[6]。但利拉魯肽在DOP中的應用仍鮮有報道,因而筆者構建DOP大鼠模型分析利拉魯肽對大鼠miRNA-19a、miRNA-144及骨密度的影響。
1 材料和方法
1.1 實驗動物
本研究中選擇使用SPF級健康4~6周齡雌性SD大鼠,體質量(162.6±7.4)g,所有大鼠均置于25~28 ℃條件下適應性飼養1周,自由飲水進食,自然采光通風,所有大鼠飼料及墊料均購買自南京青龍山動物繁育場。
1.2 分組方法造模
1.2.1DOP大鼠造模方法:將50只大鼠依照體重編號,后采用隨機數表法將所有大鼠隨機分為4組,分別為正常組、去勢對照組、模型組及給藥組,正常組及去勢對照組10只,模型組及給藥組各15只。正常組及去勢對照組大鼠使用普通飼料飼養,模型組及給藥組大鼠均給予高脂飼料飼養,4周后禁食12 h,去勢對照組、模型組及給藥組均進行去勢,且均采用手術方法將卵巢切除,后縫合肌肉和皮膚,并使用青霉素干預抗炎,后模型組及給藥組大鼠均使用2%鏈脲佐菌素依照35 mg/kg劑量腹腔注射干預,正常組注射等量的檸檬酸鹽緩沖液,72 h后采用斷尾取血法檢測大鼠空腹血糖值,若血糖值≥16.7 mmol/L則判定造模成功。造模完成后持續性高脂高糖喂養7周,后采用雙能X線骨密度檢測儀對骨密度進行測定,若造模后大鼠骨密度低于正常組的2.5個標準差則判定DOP造模成功。
1.2.2干預方法:本組研究中在造模完成后模型組及給藥組分別隨機選擇大鼠10只,后依照分組方法進行治療。給藥組大鼠采用利拉魯肽進行治療,依照每天一次每次0.1 mg/kg劑量皮下注射干預,4周后依照每天1次,每次0.2 mg/kg的劑量皮下注射,持續治療12周。正常組、去勢對照組及模型組均依照相同的給藥方法給予生理鹽水干預。
1.3 觀察指標
本研究中在治療結束后采集大鼠血液樣本,檢測大鼠空腹血糖及胰島素水平。將大鼠使用乙醚麻醉,后使用雙能X線骨密度檢測儀對骨密度進行檢測,檢測過程中固定四肢,后保持雙側股骨水平,椎體豎直,后測定腰椎、全身、骨盆及股骨骨密度。采用Western blot法檢測各組大鼠血中鈣黏蛋白11(Cad-11,抗體批號:181202-1)及胰島素受體底物1(IRS1,抗體批號:181023)水平,以Cad-11/GAPDH和IRS-1/GAPDH表示Cad-11及IRS1表達水平,所用抗體均購買自CST公司,一抗抗體稀釋比為1∶1 000,二抗抗體稀釋比1∶200。并采集大鼠血液樣本,采用Trizol法提取總RNA后采用PT-PCR法檢測血中miRNA-19a及miRNA-144水平,測定miRNA的Ct值,并計算2-△Ct值計為基因表達量,所用PCR引物均購買自南京金斯瑞生物科技有限公司。
1.4 統計學處理
本研究使用SPSS 20.0行統計學分析,采用百分率和均值±標準差表示計數和計量資料,后行卡方和方差檢驗分析組間數據差異,采用LSD-t檢驗表示兩組間數據差異,P<0.05為差異具有統計學意義。
2 結果
2.1 各組大鼠血糖及胰島素水平檢測結果
四組大鼠血糖及胰島素水平差異均具有統計學意義(P<0.05),其中正常組中大鼠空腹血糖最低而胰島素最高,給藥組空腹血糖及胰島素水平均明顯優于模型組及去勢對照組,詳見表1。
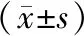
表1 各組大鼠血糖及胰島素水平檢測結果
2.2 各組大鼠miRNA-19a及miRNA-144水平檢測結果
四組大鼠miRNA-19a及miRNA-144水平差異均具有統計學意義(P<0.05),其中正常組中大鼠miRNA-19a及miRNA-144水平最低,且給藥組大鼠miRNA-19a及miRNA-144水平明顯低于模型組及去勢對照組,且差異具有統計學意義(P<0.05),詳見表2。
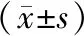
表2 各組大鼠miRNA-19a及miRNA-144水平檢測結果
2.3 各組大鼠Cad-11及IRS1水平檢測結果
四組大鼠Cad-11及IRS1水平差異具有統計學意義(P<0.05),其中正常組中大鼠Cad-11及IRS1水平最高,給藥組Cad-11及IRS1水平明顯高于模型組及去勢對照組,且差異存統計學意義,詳見表3。
2.4 各組大鼠骨密度值檢測結果
四組大鼠全身、胸腰椎、雙側股骨盆骨及腰椎部
位骨密度差異具有統計學意義(P<0.05),其中正常組中各部位骨密度最高,給藥組各部位骨密度明顯高于去勢對照組和模型組(P<0.05),詳見表4。
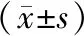
表3 各組大鼠Cad-11及IRS1水平檢測結果

圖1 WB檢測圖Fig.1 WB detection chart

表4 各組大鼠骨密度值檢測結果Table 4 Bone mineral density of rats in each
3 討論
OP是較為常見的以骨微結構改變、骨量降低為主要特診的一類疾病,OP發生后極易導致骨脆性增加并導致骨折的出現,屬于常見的全身性代謝疾病[7]。雖然有學者認為糖尿病和OP屬于獨立性疾病,糖尿病是導致OP發生與發展的獨立性危險因素,患者在出現糖尿病后并發OP的概率顯著升高[8]。此外,有流行病學研究結果顯示,與同性別、同年齡的人群相比較,糖尿病患者OP及骨質減少發生率均顯著升高,雖然其發病機制尚未完全揭示,但有研究認為其和糖尿病患者長時間胰島素分泌量不足、高血糖、多臟器病變、神經及血管系統病變等多種因素密切相關[9]。此外,糖尿病患者的飲食控制、長期服用降糖藥物、胰島素樣生長因子、雌激素、體重、瘦素、年齡及性別等因素均可能在DOP的發生及發展過程中扮演十分重要的角色。
DOP的發生及發展過程中胰島細胞的功能及數量減退在其中起到十分重要的作用,傳統的對癥治療藥物無法有效調控胰島細胞的分化、增殖等功能,且無法有效調控骨代謝失衡[10]。GLP-1類似物可有效加速修復胰島細胞,改善骨代謝。利拉魯肽是經典的GLP-1類似物藥物,GLP-1屬于有以高血糖素原前體經酶加工后而來的腸促胰島素,是由20個氨基酸構成的由L細胞釋放,可有效抑制胰高血糖素的釋放并改善胰島素的分泌量[11]。利拉魯肽是化學合成的GLP-1類似物,在對2型糖尿病進行治療時具有較高的臨床療效,利拉魯肽可有效控制血糖、減輕體質量,屬于治療糖尿病的新藥[12]。有學者采用動物實驗進行研究發現GLP-1可有效正性調節骨代謝,間接或直接作用于骨細胞,降低骨硬化蛋白水平,激活Wnt/β-catenin信號通路[13]。而miRNAs是參與細胞修復和骨代謝調控的重要內源性物質基礎,在DOP病情發生及發展過程中起到十分重要的作用。有研究指出,miRNA-19a、miRNA-144是機體內重要的胰島素信號轉導通路受體的靶基因,其參與體內胰島素生物學功能的調控[14]。因而本研究中選擇利拉魯肽作為受試藥,分析其對DOP大鼠miRNA-19a、miRNA-144及骨密度的影響。
本研究結果顯示,去勢對照組的血糖高、胰島素水平降低,分析認為,去勢對照組大鼠將雙側卵巢摘除后可能導致大鼠出現病理性改變,引起體內內分泌系統異常,導致大鼠出現代謝異常進而導致血糖水平升高,并影響胰島素代謝,降低其中胰島素水平。使用利拉魯肽治療后可顯著改善大鼠血糖及胰島素水平,有效調控miRNA-19a、miRNA-144的表達的同時提高Cad-11及IRS1水平。此外,對大鼠各部位的骨密度進行檢測結果顯示,采用利拉魯肽治療后顯著改善大鼠全身、胸腰椎、雙側股骨盆骨及腰椎骨密。分析認為,DOP大鼠采用利拉魯肽治療后可顯著改善其血中胰島素及血糖水平,其與GLP-1類似物的作用原理密切相關。有學者[15]研究結果顯示,miRNA-19a、miRNA-144是調節胞內Cad-11及IRS1基因表達,并通過調控轉錄RNA及蛋白翻譯和修飾,而Cad11及IRS1在骨代謝過程中起到十分重要的作用。本研究結果提示,利拉魯肽可通過有效調控體內miRNA-19a、miRNA-144表達水平提高Cad-11及IRS1表達進而起到逆轉骨形成與骨代謝失衡,有效加速骨質生成進而提高大鼠各部位的骨密度。本研究結果提示,在臨床中可采用利拉魯肽對糖尿病骨質疏松癥患者進行治療干預,有助于提高治療質量。
綜上所述,利拉魯肽可有效降低2型DOP大鼠miRNA-19a、miRNA-144水平,并提高大鼠骨密度。但本研究并未對利拉魯肽對DOP大鼠基因表達譜的影響進行深入研究分析,仍有待后續深入分析研究。

