山竹醇介導JAK2/STAT3信號通路發揮抗骨肉瘤作用
宋 奇 程安源 徐 立 余 鈴 夏 平
Anti-osteosarcomaEffectofGarcinolbyMediatingJAK2/STAT3SignalingPathway.SongQi,ChengAnyuan,XuLi,etal.DepartmentofOrthopedics,WuhanFirstPeople′sHospital,Hubei430022,China
AbstractObjectiveTo study the effect of garcinol on cell viability, cell cycle distribution, apoptosis of osteosarcoma cells and the growth of subcutaneous tumor in nude mice and further explore its mechanism.MethodsU2OS cells were treated with vary concentrations of garcinol. The cell viability of osteosarcoma cells were detected by CCK-8 assay.The cell cycle distribution and apoptosis rate of U2OS cells were determined by flow cytometry. The subcutaneous osteosarcoma model of nude mice was constructed to detect the effect of garcinol intraperitoneal injection on the growth of subcutaneous tumor of nude mice. RNA-Sequence analysis was used to detected genes influenced by garcinol treatment. The expression levels of proteins in JAK2/STAT3 signal pathway were detected by Western blot.ResultsCCK-8 assay showed that garcinol reduces cell viability of U2OS cells in a concentration- and time-dependent manner. The results of flow cytometry suggested that garcinol treatment could arrest cell cycle at S phase and induce apoptosis of osteosarcoma cells. Furthermore, garcinol inhibited the growth of subcutaneous tumor in nude mice. Gene-Set Enrichment Analysis showed that JAK/STAT signaling pathway was significant enriched in garcinol treated osteosarcoma cells. The expression levels of p-JAK2, p-STAT3, Bcl-xl were significantly decreased and the expression level of Bax were significantly increased in osteosarcoma cells and osteosarcoma tumor tissues treated with garcinol.ConclusionGarcinol exerts anti-osteosarcoma effect in vitro and in vivo, which may be related to the down-regulation of JAK2/STAT3 signaling pathway.
KeywordsGarcinol; Osteosarcoma cells; Cell viability; JAK2/STAT3 signaling pathway
骨肉瘤(osteosarcoma, OS)是人體骨骼系統最常見的惡性腫瘤,好發于青少年,常見于長管狀骨干骺端,惡性程度高,預后較差[1]。骨肉瘤患者的治療手段,早期主要包括外科截肢手術治療、放療及化療等,患者5年生存率不足10%。近年來隨著對腫瘤病因、病理及藥理等研究的深入,以及新輔助化療方案的出現,患者的5年生存率明顯提高,但仍無法與乳腺癌等腫瘤相比[2]。由于順鉑、阿霉素等常用的化療藥物的毒性作用及長期使用會導致化療耐藥的出現,限制了臨床上化療藥物選擇、影響治療的效果[3]。因此,亟需尋找新的低毒、高效的抗腫瘤藥物,而國內外越來越多的研究者開始從祖國傳統醫學里面尋找抗腫瘤新藥[4]。
山竹醇(garcinol)是從印度藤黃的干果皮中提取出來的黃色結晶化合物,其主要成分為多聚異戊二烯基苯甲酮,具有抗炎、抗氧化、抗腫瘤等多種藥理活性,也可作為低分子抑制劑抑制組蛋白乙酰基轉移酶活性[5,6]。既往研究表明,山竹醇對多種腫瘤細胞能產生明顯抑制作用,包括口腔鱗狀細胞癌、宮頸癌、非小細胞肺癌等,這些研究雖證明山竹醇具有抗多種腫瘤細胞活性,但是未能深入探究山竹醇抗癌機制,并且山竹醇在骨肉瘤中的作用及機制目前還未見報道[7~9]。本研究通過體外細胞實驗和在體動物實驗探究山竹醇抗骨肉瘤作用,并借助RNA-Seq測序手段初步探究其抗骨肉瘤作用的相關機制,以期為山竹醇后續進行化療藥物增敏實驗及用于臨床上骨肉瘤患者的治療提供實驗基礎。
材料與方法
1.材料:人骨肉瘤U2OS細胞系購自中國科學院上海細胞庫。α-MEM培養基購自美國Hyclone公司。1%雙抗(青霉素100U/ml, 鏈霉素100μg/ml)、細胞周期檢測試劑盒、胰蛋白酶購自武漢谷歌生物科技公司;DMSO購自美國Sigma公司,山竹醇購自美國Glpbio公司;CCK-8(Cell Counting Kit-8)購自上海陶素生物科技有限公司;細胞凋亡檢測試劑盒購自美國BD公司;抗GAPDH、JAK2、p-JAK2、STAT3、p-STAT、Bax和Bcl-xl一抗均購自美國CST公司。
2.細胞培養:人骨肉瘤U2OS細胞培養在含有5%CO2的培養箱中培養,并調整培養溫度為37℃,給予含有10%胎牛血清和1%雙抗的α-MEM培養基,隔天換1次液,后續細胞實驗和裸鼠皮下種植實驗均取對數生長期細胞進行。
3.細胞活力檢測:將細胞消化重懸后,調整骨肉瘤U2OS細胞密度為5×105/ml,取100μl接種于96孔板上,孵育8h待細胞貼壁后,加入不同濃度的山竹醇(0、1、3、10、30、100μmol/L),分別培養24h和48h,PBS洗1次后,每孔加入100μl CCK-8試劑和培養基的混合液(1∶9),37℃避光孵育1h,使用多功能酶標儀并調整波長為450nm,測量每孔細胞的吸光度值(A)。細胞活力(%)=實驗組平均A值/對照組平均A值×100%。
4.細胞周期檢測:用不同濃度山竹醇(0、3、10、30μmol/L)處理骨肉瘤U2OS細胞24h后,用冷PBS洗滌2次,收集細胞后用75%乙醇固定過夜,離心后用PBS洗滌1次,加入200μl冷PBS重懸細胞,再加入2μl RNA酶A(1mg/ml)和50μl PI(50μg/ml),室溫下置于暗盒中孵育30min,用流式細胞儀分析細胞周期分布。
5.細胞凋亡分析:不同濃度山竹醇(0、3、10、30μmol/L)處理骨肉瘤U2OS細胞24h后,離心收集細胞,取200μl結合緩沖液重懸細胞,依次加入Annexin Ⅴ/FITC和PI熒光染料,各5μl,后樣品置于暗盒中室溫下孵育20min,然后再加入300μl結合緩沖液重懸細胞,隨即用流式細胞儀進行細胞凋亡檢測。
6.Western blot法檢測:不同濃度山竹醇(0、3、10、30μmol/L)處理骨肉瘤U2OS細胞24h后,收集細胞,加入RIPA細胞裂解液冰水裂解30min,4℃、12000r/min離心后取上清,提取總蛋白蛋白,蛋白定量后取10μg總蛋白,進行10%或12%聚丙烯酰胺凝膠電泳分離,電泳條件為100V、120min,電泳完成后進行濕法轉膜,轉膜條件為200mA、90min,轉膜完成后用5%脫脂奶粉于室溫封閉1h,TBST洗滌3次,每次10min,加入相應一抗孵育過夜。TBST溶液振搖洗滌3次,每次10min,按1∶3000稀釋辣根過氧化物酶標記二抗,室溫搖床孵育1h。在暗室中將PVDF膜用底物顯影后曝光分析結果。蛋白表達水平=目的蛋白灰度值/GAPDH的灰度值。
7.裸鼠成瘤實驗:BALB/c-nu裸鼠購自武漢華聯科生物技術有限公司,18只裸鼠隨機分為3組,通過打耳標進行標記,飼養1周待小鼠狀態恢復后,于右側背部皮下接種處于對數生長期的U2OS骨肉瘤細胞,每只裸鼠接種細胞量約為5×106個。每3天監測小鼠生長情況及成瘤情況,接種1周后開始隔天腹腔注射山竹醇,分為高劑量組(2mg/kg)和低劑量組(1mg/kg)[7]。對照組注射相同體積的DMSO,每3天測量1次皮下瘤的長徑和短徑。接種4周后,裸鼠全身麻醉后通過頸椎脫位法處死,取出瘤體組織,-80℃冰箱保存。皮下瘤體積(mm3)=(長徑×短徑2/2)。
8.RNA-Seq測序分析:將山竹醇(10μmol/L)處理24h后U2OS骨肉瘤細胞樣本與對照組樣本收集后,提取總RNA,每組重復3次,-80℃保存,由武漢谷歌生物科技公司完成RNA-Seq測序。取處理組和對照組中基因改變|log2(Fold Change)|>2的基因為差異基因,使用GSEA4.0.3軟件進行基因富集分析。

結 果
1.山竹醇對骨肉瘤U2OS細胞活力的影響:用不同濃度的山竹醇處理骨肉瘤細胞24h或48h后,采用CCK-8法檢測骨肉瘤細胞活力。隨著藥物作用時間的延長或藥物濃度的增加,與空白對照組(0μmol/L山竹醇)比較,山竹醇處理組中,U2OS細胞活力逐漸降低(圖1)。
2.山竹醇對骨肉瘤U2OS細胞周期分布的影響:采用PI單染流式細胞術檢測骨肉瘤細胞經不同濃度山竹醇處理后細胞周期分布的變化。骨肉瘤細胞經不同濃度山竹醇(0、3、10、30μmol/L)處理后,處于S期的細胞顯著增加,與空白對照組比較,差異有統計學意義(P<0.05)(圖2)。
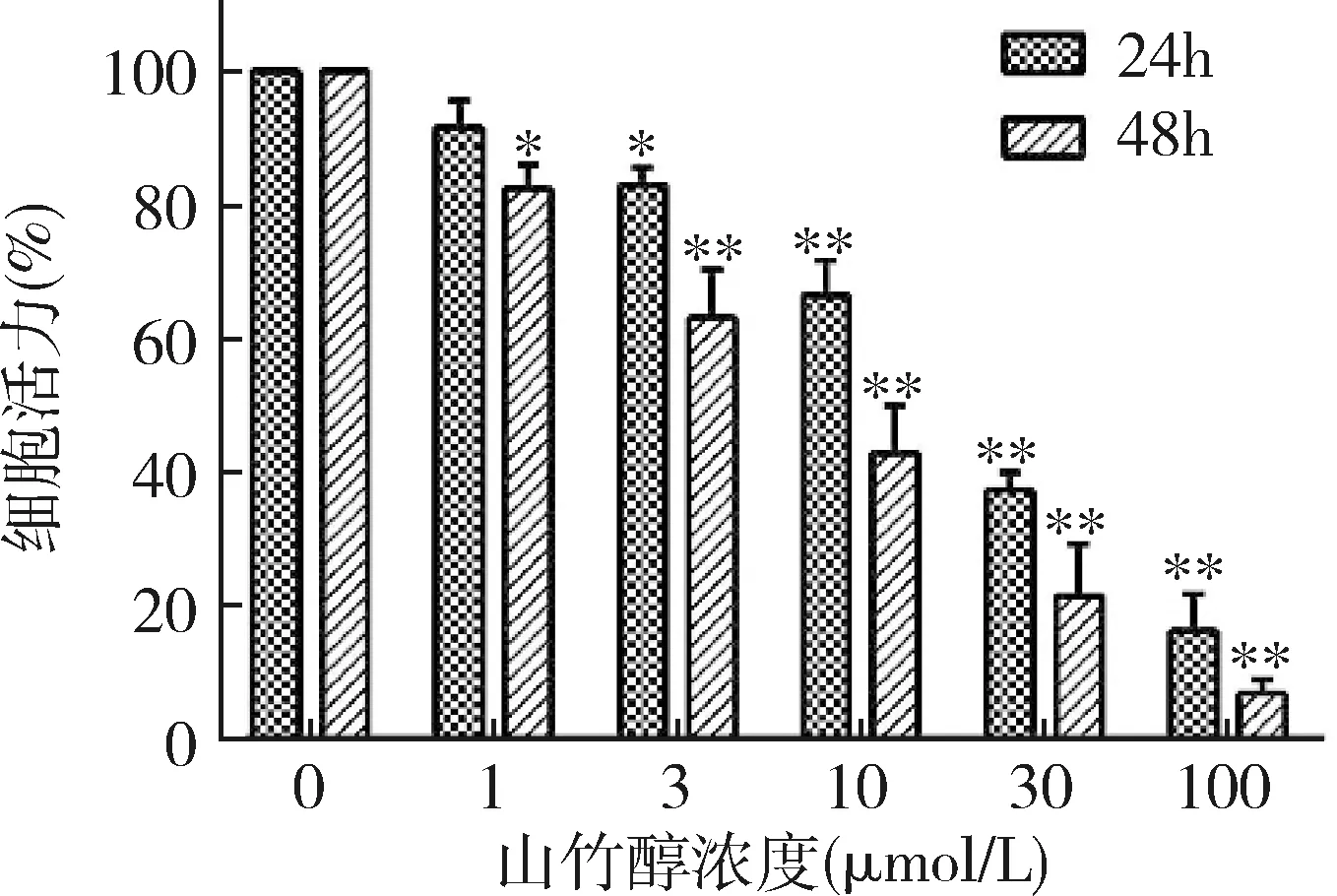
圖1 山竹醇對骨肉瘤U2OS細胞活力的抑制作用與0μmol/L比較,*P<0.05,**P<0.01
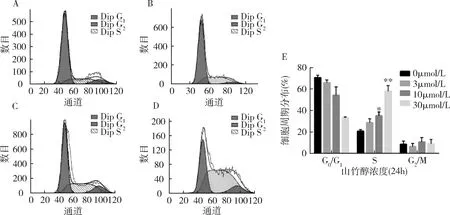
圖2 山竹醇對骨肉瘤U2OS細胞周期分布的影響A.對照組(0μmol/L山竹醇處理組);B.3μmol/L山竹醇處理組;C.10μmol/L山竹醇處理組;D.30μmol/L山竹醇處理組;E.細胞周期定量分析。與0μmol/L比較,*P<0.05,**P<0.01
3.山竹醇對骨肉瘤U2OS細胞凋亡的影響:使用不同濃度山竹醇(0、3、10、30μmol/L)處理骨肉瘤細胞24h后,采用流式細胞術檢測骨肉瘤細胞凋亡率。隨著山竹醇藥物濃度的增加,U2OS細胞凋亡率也顯著提高(圖3)。
4.山竹醇對骨肉瘤細胞JAK2/STAT3信號通路的影響:將山竹醇(10μmol/L)處理24h后U2OS骨肉瘤細胞樣本進行RNA-Seq測序分析。共有2388個基因表達水平發生改變(|log2(fold change)|>2),其中1351個基因上調,1037個基因下調。進一步通過基因富集分析發現,山竹醇處理的骨肉瘤細胞中JAK/STAT信號通路顯著富集,并且表現為信號通路活性降低。進一步通過Western blot法檢測細胞中p-JAK2、p-STAT3、Bax、Bcl-xl水平,發現山竹醇處理細胞中p-JAK2、p-STAT3、Bcl-xl水平明顯降低,而Bax表達水平顯著升高,并且具有濃度依耐性(圖4)。
5.山竹醇對裸鼠骨肉瘤生長的影響:山竹醇能抑制裸鼠皮下骨肉瘤的生長。檢測山竹醇處理骨肉瘤組織中p-JAK2、p-STAT3、Bax和Bcl-xl水平,發現山竹醇處理腫瘤組織中p-JAK2、p-STAT3和Bcl-xl水平明顯降低,而Bax表達水平顯著升高,并且具有濃度依耐性(圖5),這一結果與細胞實驗結果相符。
討 論
隨著病理學、影像學、藥理學等多學科的發展以及外科手術的進步,目前臨床上對于早期局限性骨肉瘤患者,經過規范診療后5年生存率可達70%,然而,對于復發或轉移的患者尚無切實有效的治療手段[10,11]。骨肉瘤作為一種間葉組織來源的惡性腫瘤,對放療敏感度較差,基于手術切除和化學藥物治療的綜合治療手段是骨肉瘤患者的常見治療手段[12]。其中化療藥物對殺傷腫瘤細胞、預防腫瘤的復發具有重要意義,但對正常組織細胞也具有一定的殺傷作用并且長期使用會出現藥效的下降[13]。因此尋找高效且低毒的抗腫瘤藥物是當前研究的一大方向,越來越多的學者將目光投向祖國傳統中藥。

圖3 山竹醇對骨肉瘤細胞凋亡率的影響A.對照組(0μmol/L山竹醇處理組);B. 3μmol/L山竹醇處理組;C.10μmol/L山竹醇處理組;D.30μmol/L山竹醇處理組;E.細胞周期定量分析。G1~G4.分別為壞死細胞、晚期凋亡細胞、正常細胞、早期凋亡細胞;與0μmol/L比較,*P<0.01

圖4 山竹醇對骨肉瘤細胞中p-JAK2、p-STAT3、Bax和Bcl-xl表達的影響A.基因表達矩陣火山圖分析;B.基因表達矩陣GSEA分析;C.JAK/STAT信號通路基因熱圖分析;D.蛋白電泳結果;E.蛋白定量分析。與0μmol/L比較,*P<0.05,**P<0.01

圖5 山竹醇對裸鼠骨肉瘤生長及腫瘤組織中p-JAK2、p-STAT3、Bax和Bcl-xl表達的影響*P<0.05,**P<0.01
山竹醇已被證明具有治療各種人類疾病的潛力,如糖尿病、哮喘、心血管疾病和神經退行性疾病,而近年來山竹醇抗腫瘤活性逐漸被證實。Duan等[14]研究發現,山竹醇能抑制膀胱癌細胞增殖和侵襲,可能與山竹醇抑制AKT和STAT3的磷酸化、降低MMP2、MMP9的表達有關。Zhang等[15]研究證實,山竹醇能抑制口腔鱗癌細胞的增殖、遷移和侵襲,可能與其抑制細胞線粒體氧化磷酸化,影響細胞能量代謝有關。Wang等[16]研究表明,山竹醇能通過降低p300/CBP 和p-Smad2/3水平發揮抑制食管癌轉移的作用。此外,也有學者證實,山竹醇也能影響腫瘤細胞干細胞特性和化療藥物敏感度。Huang等[17]研究表明,山竹醇能通過抑制Wnt/β-catenin/STAT3信號通路抑制非小細胞肺癌細胞“干細胞表型”。Li等[18]通過體外動物實驗發現,山竹醇能增強頭頸鱗狀細胞癌對于順鉑的敏感度。而探討山竹醇在骨肉瘤中的作用的研究目前還不多見,因此,本研究初步探索山竹醇對骨肉瘤U2OS細胞活力、細胞周期分布和凋亡的影響及對裸鼠皮下腫瘤生長的影響,并初步探索其相關作用機制,以期為后續進行化療藥物增敏實驗提供基礎。
本研究用不同濃度的山竹醇(0、1、3、10、30、100μmol/L)處理骨肉瘤U2OS細胞24h或48h后,CCK-8結果顯示,山竹醇能時間、濃度依耐性的抑制骨肉瘤細胞活力,表明山竹醇具有一定的抗骨肉瘤細胞作用。誘導細胞凋亡和周期阻滯是抗腫瘤藥物的重要特征之一,為探究山竹醇對骨肉瘤細胞凋亡率和細胞周期分布的影響,采用流式細胞術檢測不同濃度山竹醇處理后骨肉瘤細胞凋亡率及細胞周期分布的變化,結果顯示,山竹醇能誘導U2OS細胞凋亡,并導致細胞周期阻滯于S期,這一效應具有濃度依耐性。進一步驗證山竹醇的在體作用,通過皮下種植骨肉瘤細胞,2周后待皮下成瘤,通過腹腔注射山竹醇,監測皮下腫瘤的生長,結果表明,山竹醇能抑制裸鼠皮下骨肉瘤的生長。
為進一步探究山竹醇抗骨肉瘤細胞的作用機制,筆者進行了RNA-Seq測序分析。結果表明,與對照組比較,山竹醇處理細胞中共有2388個基因表達水平發生改變,其中1351個基因上調,1037個基因下調。進一步通過基因富集分析發現,山竹醇處理的骨肉瘤細胞細胞中JAK/STAT信號通路顯著富集,并且表現為信號通路活性降低。JAK/STAT信號通路是由蛋白酪氨酸激酶(JAKs家族)和信號轉導及轉錄活化因子(STATs家族)組成,目前已發現,哺乳動物中JAKs家族共有4種激酶,即JAK1、JAK2、JAK3和Tyk2,除JAK3外,在JAKs家族蛋白在組織細胞中廣泛分布。STATs家族作為JAKs的靶蛋白,共有STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6 7種,各種信號引起受體偶聯的JAKs家族激酶相互聚集,磷酸化修飾而激活,進一步引起下游STATs家族蛋白發生磷酸化修飾而發生二聚化,進入細胞核內,調控下游基因的轉錄、表達[19]。有關JAK2/STAT3信號通路的研究最為常見,大量研究證實,JAK2/STAT3信號通路在腫瘤中高度活化,廣泛參與細胞增殖、分化、凋亡以及炎癥等過程,抑制JAK2/STAT3信號通路能通過抑制細胞周期進程、誘導細胞凋亡等生物學過程而抑制腫瘤細胞的增殖[20]。
針對JAK2/STAT3信號通路的靶向治療是目前腫瘤藥物研究中熱點。本研究發現,山竹醇處理的骨肉瘤細胞及腫瘤組織中p-JAK2、p-STAT3和Bcl-xl水平明顯降低,而Bax表達水平顯著升高,并且具有濃度依耐性。這些結果表明,山竹醇可能是通過抑制骨肉瘤中JAK2/STAT3信號通路的激活,誘導凋亡相關性蛋白的表達從而發揮抗骨肉瘤作用,此外抑制JAK2/STAT3信號通路的活性能誘導腫瘤細胞周期阻滯,這與以往的研究相符,說明JAK2/STAT3信號通路可能作為抗骨肉瘤藥物研發的重要靶點。但本研究尚未探究山竹醇處理細胞中JAK2/STAT3信號通路抑制的具體機制,后續會進一步探討。
綜上所述,山竹醇能在體內、體外發揮一定的抗骨肉瘤作用,可能與其抑制骨肉瘤中JAK2/STAT3信號通路活性,導致細胞周期阻滯,誘導凋亡相關性蛋白的表達并促進細胞凋亡有關。

