熊果酸對人肝癌HepG2細胞凋亡及PI3K/Akt信號通路的影響
宗彥紅 霍麗靜 常 勝
EffectsofUrsolicAcidonApoptosisandPI3K/AktSignalingPathwayofHumanHepatomaHepG2Cells.ZongYanhong,HuoLijing,ChangSheng.HebeiGeneralHospital,Hebei050051,China
AbstractObjectiveTo investigate the effect of Ursolic Acid (UA) on the apoptosis of human liver cancer HepG2cells and its possible molecular mechanism.MethodsThe DMSO (blank control group), UA (10, 20, 40μmol/L) and LY294002 (PI3K-specific inhibitor) 10nmol/L were used to intervene HepG2cells in the growth phase. 48h after the drugs were given, the proliferation inhibition rate of the HepG2cells was detected by MTT method, the apoptotic status was analyzed by Annexin Ⅴ-FITC/PI double staining and the apoptotic rate was calculated. The expression of PI3K, p-PI3K, Akt, p-Akt, caspase-9, cleaved caspase-3, Bax, Bcl-2, p-JNK, CHOP proteins were detected by Western blot.ResultsCompared with blank control group, being intervened by UA 10, 20, 40μmol/L or LY294002 10nmol/L could increase the proliferation inhibition rate and apoptosis rate of HepG2cells (P<0.01), being intervened by UA 20, 40μmol/L or LY294002 10nmol/L could down-regulate the expression of p-PI3K, p-Akt, Bcl-2 and up-regulate the expression of caspase-9, cleaved caspase-3, Bax, p-JNK, CHOP (P<0.05), increase the ratio of Bax/Bcl-2 (P<0.01). Compared with LY294002 10nmol/L group, being intervened by UA 40μmol/L could down-regulate the expression of p-PI3K, p-Akt, and up-regulate the expression of cleaved caspase-3, Bax, p-JNK, CHOP (P<0.05), increase the ratio of Bax/Bcl-2 (P<0.01).ConclusionUA can promote the apoptosis of human liver cancer HepG2cells, inhibit the activation of PI3K/Akt signaling pathway, thus to activate the endoplasmic reticulum stress apoptotic pathway and up-regulate the expression of downstream pro-apoptotic proteins, which may be its important molecular mechanisms.
KeywordsUrsolic acid; Liver cancer; Apoptosis; PI3K/Akt;Endoplasmic reticulum stress
全球每年新發肝癌病例超過100萬,其中42.5%分布在我國,我國肝癌病死率約20/10萬,居惡性腫瘤致死率第3位[1]。隨著醫療技術的發展,手術切除并輔以放化療、生物治療等成為臨床治療肝癌的常規方案,但5年生存率仍不足40%[2]。因此探索新型高效的抗肝癌藥物仍是目前的研究熱點。
熊果酸(ursolic acid,UA)是廣泛存在于熊果、女貞子、野薔薇果、白花蛇舌草、車前草、山楂等天然藥物中的一種五環三萜類化合物,具有抗氧化、抗炎、調脂等多種生物學活性[3,4],近年來其抗腫瘤活性得到廣泛關注,已研究發現UA能夠通過抑制腫瘤細胞增殖并促進細胞凋亡對肺癌、胃癌、結腸癌細胞等生長起到抑制作用[5]。本課題組研究YAP1、β-Catenin在肝癌疾病發生及進展過程中的作用,二者對磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)通路活性具有抑制作用,而PI3K/Akt通路對細胞凋亡具有關鍵性的調控作用,因此本研究將基于PI3K/Akt信號通路探討UA對人肝癌HepG2細胞凋亡的影響及機制[6~8]。
材料與方法
1.藥物與試劑:熊果酸(純度≥98%)購自上海源葉生物科技有限公司;LY294002購自美國Sigma公司;DMSO、DMEM培養基、胎牛血清、Annexin Ⅴ-FITC/PI凋亡試劑盒購自南京凱基生物科技發展有限公司;MTT試劑盒購自美國Sigma公司;PI3K、磷酸化PI3K(p-PI3K)、Akt、磷酸化Akt(p-Akt)、caspase-9、激活型caspase-3(cleaved caspase-3)、Bcl-2、Bax、c-Jun氨基端激酶(p-JNK)、C/EBP同源蛋白(CHOP)抗體購自上海碧云天生物技術有限公司。
2.細胞:人肝癌HepG2細胞株購自中國科學院細胞庫,復蘇并重懸后接種于含10%胎牛血清和雙抗(100U/ml青霉素、鏈霉素)DMEM培養基,置于5% CO2、37℃培養箱中培養,取對數生長期HepG2細胞進行實驗。設空白對照組(DMSO)、UA(10、20、40μmol/L)和LY294002 10nmol/L實驗組[9,10]。
3.細胞增殖抑制率的測定:以0.25%胰酶消化對數生長期HepG2細胞制備濃度5×104個/毫升的單細胞懸液,轉移至96孔板(100微升/孔),置于細胞培養箱培養至貼壁生長后,分別以DMSO、UA(10、20、40μmol/L)或LY294002 10nmol/L進行干預,每組設10個復孔,48h后加入5mg/ml濃度的MTT溶液(20微升/孔),置培養箱繼續培養4h后,加入DMSO(150微升/孔)避光震蕩10min后通過酶標儀測定490nm處吸光度值(A490nm),增殖抑制率(%)=(1-實驗組A490nm/空白對照組A490nm)×100%
4.細胞凋亡分析:以0.25%胰酶消化對數生長期HepG2細胞制備濃度5×104個/毫升的單細胞懸液,轉移至6孔板(100微升/孔),置細胞培養箱培養至貼壁生長后,分別以DMSO、UA(10、20、40μmol/L)或LY294002 10nmol/L進行干預,每組設10個復孔,48h后經0.25%胰酶消化后離心(r=10cm、1500r/min、5min)取細胞,洗滌后置70%乙醇固定1h,按照Annexin Ⅴ-FITC/PI試劑盒操作說明處理后,通過流式細胞儀分析細胞凋亡狀況并計算凋亡率。
5.細胞蛋白表達檢測:以0.25%胰酶消化對數生長期HepG2細胞制備濃度5×104個/毫升的單細胞懸液,轉移至6孔板(100微升/孔),置細胞培養箱繼續培養至貼壁生長后,分別以DMSO、UA(10、20、40μmol/L)或LY294002 10nmol/L干預,每組設10個復孔,48h后,經4℃離心(r=10cm、1500r/min、5min)后取細胞,加入冷裂解液后置冰上裂解40min,經4℃離心(r=10cm、12000r/min、15min)取上清,檢測總蛋白濃度后95℃高溫變性,上樣(40μg總蛋白)、SDS-PAGE膠電泳、轉PVDF膜,置5%脫脂牛奶溶液于室溫封閉1h,滴加PI3K、p-PI3K、Akt、p-Akt、caspase-9、cleaved caspase-3、Bcl-2、Bax、p-JNK、CHOP、β-actin一抗后4℃冰箱孵育過夜,洗膜后滴加二抗室溫孵育1h,洗膜后滴加DAB顯色劑;以β-actin為內參,通過條帶灰度值半定量目標蛋白表達量。

結 果
1. UA對人肝癌HepG2細胞增殖抑制率的影響:與空白對照組比較,發現經UA 10、20、40μmol/L或LY294002 10nmol/L干預能顯著提高HepG2細胞增殖抑制率(P<0.01);與LY294002 10nmol/L組比較,UA 40μmol/L組細胞增殖抑制率明顯升高(P<0.05,圖1)。

圖1 各組人肝癌HepG2細胞增殖抑制率與空白對照組比較,*P<0.01;與LY294002 10nmol/L組比較,#P<0.05
2.UA對人肝癌HepG2細胞凋亡的影響:與空白對照組比較,發現經UA 10、20、40μmol/L或LY294002 10nmol/L干預能顯著提高HepG2細胞凋亡率(P<0.01);與LY294002 10nmol/L組比較,UA 40μmol/L組細胞凋亡率明顯升高(P<0.05,圖2、圖3)。

圖2 UA對人肝癌HepG2細胞凋亡的影響A.空白對照組;B.UA 10μmol/L組;C.UA 20μmol/L組;D.UA 40μmol/L組;E.LY294002 10nmol/L組

圖3 各組人肝癌HepG2細胞凋亡率與空白對照組比較,*P<0.01;與LY294002 10nmol/L組比較,#P<0.05
3.UA對人肝癌HepG2細胞PI3K、p-PI3K、Akt、p-Akt蛋白表達及PI3K、Akt磷酸化比值的影響:與空白對照組比較,發現經UA 20、40μmol/L或LY294002 10nmol/L干預能夠明顯下調HepG2細胞p-PI3K、p-Akt表達(P<0.05),降低PI3K、Akt磷酸化比值(p-PI3K/PI3K、p-Akt/Akt);與LY294002 10nmol/L組比較,UA 40μmol/L組p-PI3K、p-Akt表達下調且PI3K、Akt磷酸化降低(P<0.05,圖4、圖5)。

圖4 UA對人肝癌HepG2細胞PI3K、p-PI3K、Akt、p-Akt蛋白表達的影響A.空白對照組;B.UA 10μmol/L組;C.UA 20μmol/L組;D.UA 40μmol/L組;E.LY294002 10nmol/L組

圖5 各組人肝癌HepG2細胞PI3K、p-PI3K、Akt、p-Akt蛋白相對表達量及PI3K、Akt磷酸化比值與空白對照組比較,*P<0.05, **P<0.01;與LY294002 10nmol/L組比較,#P<0.05, ##P<0.01
4.UA對人肝癌HepG2細胞caspase-9、cleaved caspase-3、Bcl-2、Bax蛋白表達及Bax/Bcl-2比值的影響:與空白對照組比較,發現經UA 20、40μmol/L或LY294002 10nmol/L干預能夠明顯上調HepG2細胞caspase-9、cleaved caspase-3、Bax表達并下調Bcl-2表達(P<0.05),顯著提高Bax/Bcl-2比值(P<0.01);與LY294002 10nmol/L組比較,UA 40μmol/L組cleaved caspase-3、Bax表達明顯上調(P<0.05或P<0.01),兩組間caspase-9、Bcl-2表達比較差異無統計學意義(P>0.05),Bax/Bcl-2比值顯著升高(P<0.05,圖6、圖7)。
5.UA對人肝癌HepG2細胞p-JNK、CHOP表達的影響:與空白對照組比較,發現經UA 20、40μmol/L或LY294002 10nmol/L干預能夠明顯上調HepG2細胞p-JNK、CHOP蛋白表達(P<0.01);與LY294002 10nmol/L組比較,UA 40μmol/L組p-JNK、CHOP表達明顯上調(P<0.01,圖8、圖9)。
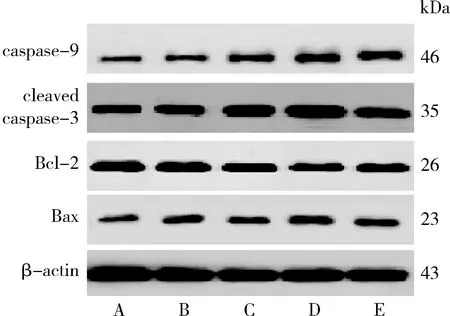
圖6 UA對人肝癌HepG2細胞caspase-9、cleaved caspase-3、Bcl-2、Bax蛋白表達的影響A.空白對照組;B.UA 10μmol/L組;C.UA 20μmol/L組;D.UA 40μmol/L組;E.LY294002 10nmol/L組

圖7 各組人肝癌HepG2細胞caspase-9、cleaved caspase-3、Bcl-2、Bax蛋白相對表達量及Bax/Bcl-2比值與空白對照組比較,*P<0.05, **P<0.01;與LY294002 10nmol/L組比較,#P<0.05, ##P<0.01

圖8 UA對人肝癌HepG2細胞p-JNK、CHOP表達的影響A.空白對照組;B.UA 10μmol/L組;C.UA 20μmol/L組;D.UA 40μmol/L組;E.LY294002 10nmol/L組

圖9 各組人肝癌HepG2細胞p-JNK、CHOP蛋白相對表達量與空白對照組比較,*P<0.05, **P<0.01;與LY294002 10nmol/L組比較,#P<0.01
討 論
肝癌在中醫屬“臌脹”、“黃疸”、“肝積”等范疇,正氣虛損、蘊結于肝、血行不暢、形成痞塊為其主要病理。隨著我國振興中醫藥戰略的實施與中藥現代化研究的深入,中藥抗腫瘤具有整體調理、標本兼治的獨特優勢[11]。UA是廣泛存在于熊果、女貞子、車前草等中藥中的一種具有廣泛抗腫瘤活性的五環三萜類化合物,誘導細胞凋亡是其主要作用機制之一。本研究發現,經UA或LY294002干預能夠明顯提高HepG2細胞增殖抑制率和凋亡率,UA 40μmol/L組效果優于LY294002 10nmol/L組,提示UA能夠促進HepG2細胞凋亡并抑制其增殖。
細胞凋亡是一種主動性的程序化死亡過程,是由多種信號通路和蛋白參與調控的復雜過程,其中caspase家族和bcl-2家族蛋白發揮著至關重要的作用[12]。caspase-9具有促凋亡作用并且能夠激活caspase-3,cleaved caspase-3參與細胞凋亡的啟動與執行等全過程;Bcl-2和Bax為bcl-2家族成員,Bcl-2蛋白位于線粒體膜,能夠保護線粒體膜通透性而抑制細胞色素C釋放,抑制caspase-9、caspase-3活化等表現出抗凋亡作用;Bax則能夠破壞線粒體膜而導致細胞色素C釋放,進而激活caspase-9、caspase-3而誘導細胞凋亡。此外,Bax能夠與Bcl-2形成異源二聚體而抑制彼此活性,所以Bax/Bcl-2比值能夠反映二者對細胞凋亡的調控作用[13]。CHOP和JNK是內質網應激通路介導細胞凋亡的信號分子,CHOP具有促細胞凋亡活性,p-JNK能夠誘導促凋亡蛋白Bim表達并且抑制Bcl-2活性而發揮促凋亡作用[14,15]。
PI3K/Akt信號通路對細胞凋亡發揮著重要調控作用[16,17]。Akt是PI3K的下游基因,能夠被p-PI3K誘導磷酸化(p-Akt)而激活,p-Akt能夠誘導caspase-9磷酸化而失活,阻斷caspase-3被caspase-9激活,并且p-Akt能夠誘導Bax表達,抑制CHOP、JNK表達和活化而抑制內質網應激通路[18~20]。本研究發現,經UA或LY294002干預能夠明顯下調HepG2細胞p-PI3K、p-Akt表達,降低PI3K、Akt磷酸化,上調caspase-9、cleaved caspase-3、Bax表達并下調Bcl-2表達,提高Bax/Bcl-2比值,并且UA 40 μmol/L組對p-PI3K、p-Akt、cleaved caspase-3、Bax表達和PI3K、Akt磷酸化及Bax/Bcl-2比值的調控作用優于LY294002 10nmol/L組,提示UA誘導HepG2細胞凋亡可能與抑制PI3K/Akt信號通路有關。
綜上所述,UA能夠促進人肝癌HepG2細胞凋亡,抑制PI3K/Akt信號通路而導致其下游促凋亡蛋白表達上調、內質網應激通路活化可能是其重要的分子機制。

