加速康復外科在達芬奇機器人輔助腹腔鏡下腎腫瘤剜除術中的應用研究
徐振宇,唐朝朋,吳 鼎,傅 點,程 文,高建平,周文泉,葛京平,張征宇
(東部戰區總醫院泌尿外科,江蘇 南京,210002)
腎細胞癌占所有成人惡性腫瘤的2%~3%,近年隨著人們體檢意識的提高及影像學等診斷技術的進步,早期局限性腎癌(T1期)的檢出率越來越高,而保留腎單位手術(nephron sparing surgery,NSS)治療早期局限性腎癌越來越被人們所接受[1]。達芬奇機器人輔助腹腔鏡下腎腫瘤剜除術作為一種新興的微創手術方式,逐漸在泌尿外科開展,并取得良好效果。機器人的多關節、多自由度的內手腕系統,配合高放大倍數的清晰視野,使得手術操作更為靈活、準確,尤其創面縫合更具優勢,使得腎腫瘤剜除術更為安全[2]。加速康復外科(enhanced recovery after surgery,ERAS)理念最早于1997年由丹麥外科醫師Kehlet等[3]首次提出,黎介壽院士等于2007年引入國內[4]。ERAS是通過改進一系列圍手術期措施,減輕患者的應激反應,從而達到加快患者康復進程的總體方案。國內首先在腹部外科應用,近年在泌尿外科的應用也越來越多,本研究將ERAS應用于機器人輔助腹腔鏡腎腫瘤剜除術,評估其對患者術后康復的影響,現總結報道如下。
1 資料與方法
1.1 臨床資料 將2016年8月至2019年6月東部戰區總醫院(原南京軍區總醫院)泌尿外科收治的120例腎腫瘤患者按計算機隨機分析產生的數字表分為ERAS組與對照組,每組60例,在圍手術期處理方面,ERAS組采用加速康復處理方案,而對照組采用常規處理方案。兩組患者均行機器人輔助腹腔鏡下腎腫瘤剜除術,由同一術者施術,兩組患者在性別、年齡、腫瘤位置與大小、腫瘤分期、RENAL評分等方面差異均無統計學意義(P>0.05)。兩組患者的入選標準均為局限早期腎腫瘤(T1a、T1b期),無嚴重內臟器官功能障礙、嚴重腹部創傷及手術、出凝血功能障礙、嚴重肝腎功能不全等。見表1。兩組具體圍手術期處理措施見表2。
表1 兩組患者臨床資料的比較(±s)
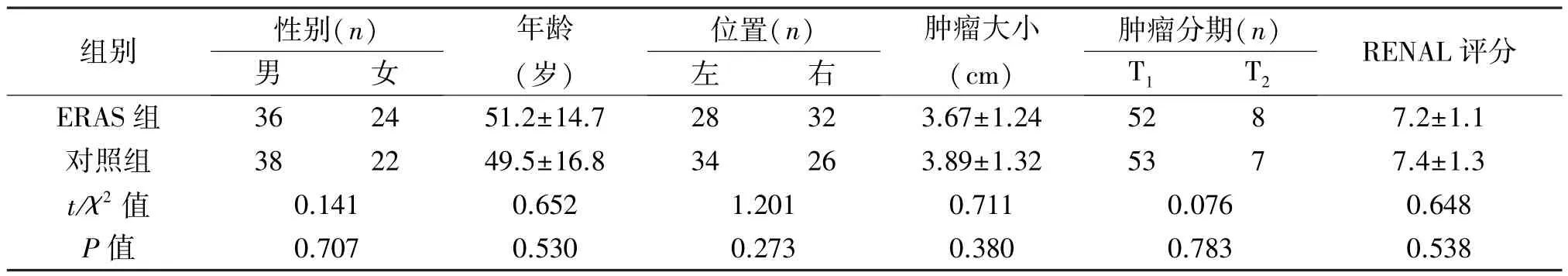
表1 兩組患者臨床資料的比較(±s)
組別 性別(n)年齡(歲)位置(n)腫瘤分期(n)男 女 左 右腫瘤大小(cm)T1 T2 RENAL評分ERAS 組 36 24 51.2±14.7 28 32 3.67±1.24 52 8 7.2±1.1對照組 38 22 49.5±16.8 34 26 3.89±1.32 53 7 7.4±1.3 t/χ2 值 0.141 0.652 1.201 0.711 0.076 0.648 P值 0.707 0.530 0.273 0.380 0.783 0.538

表2 兩組圍手術期處理方式
1.2 手術方法 全麻,患者取健側斜臥位45度,抬高腰橋,降低下肢15°。取患側臍上2 cm腹直肌外緣做切口,穿刺氣腹針建立氣腹,穿刺12 mm Trocar作為觀察孔,直視下分別于患側鎖骨中線附近距觀察孔10 cm處穿刺Trocar作為左、右器械孔,于正中線附近劍突、臍下距上述各孔10 cm處做輔助孔。按照鏡頭鏡臂與鏡頭孔在一直線水平為指引,將床旁機械臂手術系統由患者背側移入位,將機器人三臂分別與各Trocar相連接。依次置入鏡頭、馬里蘭雙極抓鉗(2號臂)、單極電剪(1號臂)及各輔助器械。進入腹腔后切開側腹膜,切斷肝(脾)結腸韌帶,成功游離輸尿管,沿輸尿管平面游離腎蒂,仔細分離腎動脈(結合術前CT血管造影檢查注意觀察有無異位動脈或早發分支)(圖1)。沿腎包膜表面游離腎臟及腎腫瘤,用血管阻斷鉗阻斷腎動脈主干(包括異位動脈),腫瘤旁開0.5~1 cm處完整切除腫瘤組織(圖2),快速將其置入標本袋內,更換1號臂為持針器,使用倒刺縫線對腎實質進行間斷縫合,并以Hem-o-lok加固。對于腫瘤較深或切破腎盞的患者,用1-0倒刺縫線基底部連續縫合,關閉切破的腎盞,再對腎實質進行間斷縫合,并用Hem-o-lok加固。見圖3。隨即松開血管阻斷鉗恢復腎臟血供,檢查創面有無出血,必要時再加固縫合。清點器械無誤后取出標本袋,留置硅膠管引流,逐層縫合關閉切口。
1.3 觀察指標 包括手術持續時間、術中出血量、術后首次肛門排氣時間、首次進食時間、胃腸道相關并發癥、術后首次下床恢復活動時間、導尿管與引流管留置時間,以及術后2 h、24 h、48 h疼痛評分,術后其他并發癥,總住院時間及總治療費用等。疼痛檢測方法采用視覺模擬評分法(visual analogue scale,VAS)。VAS量表是臨床科研與醫療人員常用的有效測量工具,為一條10 cm長的水平線或垂直線,兩端分別標有0表示“無痛”,10表示“最痛”,標記出最痛點即為能準確代表疼痛強度的標出點,測量0到標出最痛點的平均距離即為疼痛強度評分的平均值,0分:患者無痛;3分以下:患者僅有輕微疼痛,能很好地忍受;4~6分:疼痛嚴重影響睡眠,尚能忍受;7~10分:疼痛漸強烈,難以忍受。分別測量患者靜 息與輕聲咳嗽時的疼痛程度。
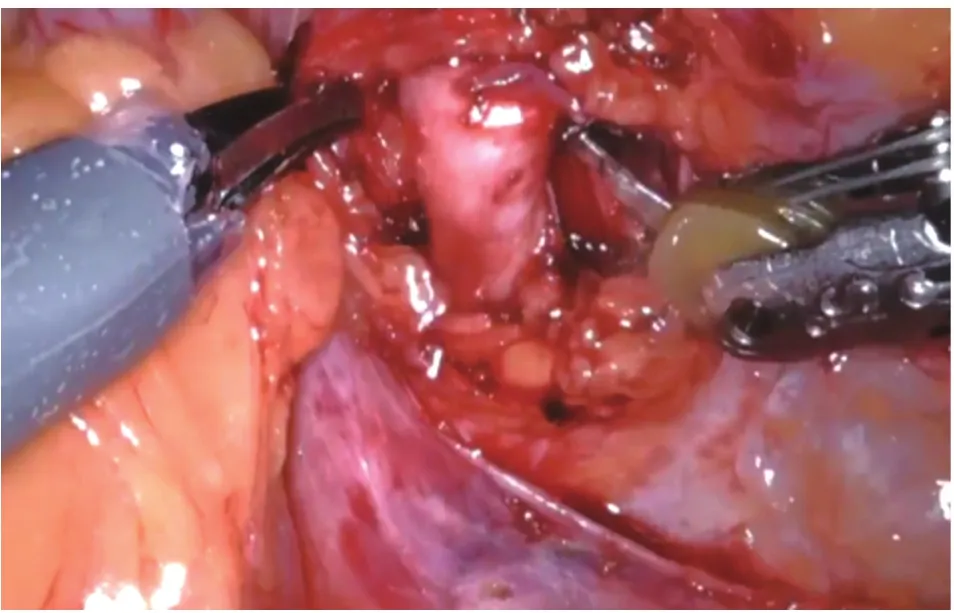
圖1 游離腎動脈
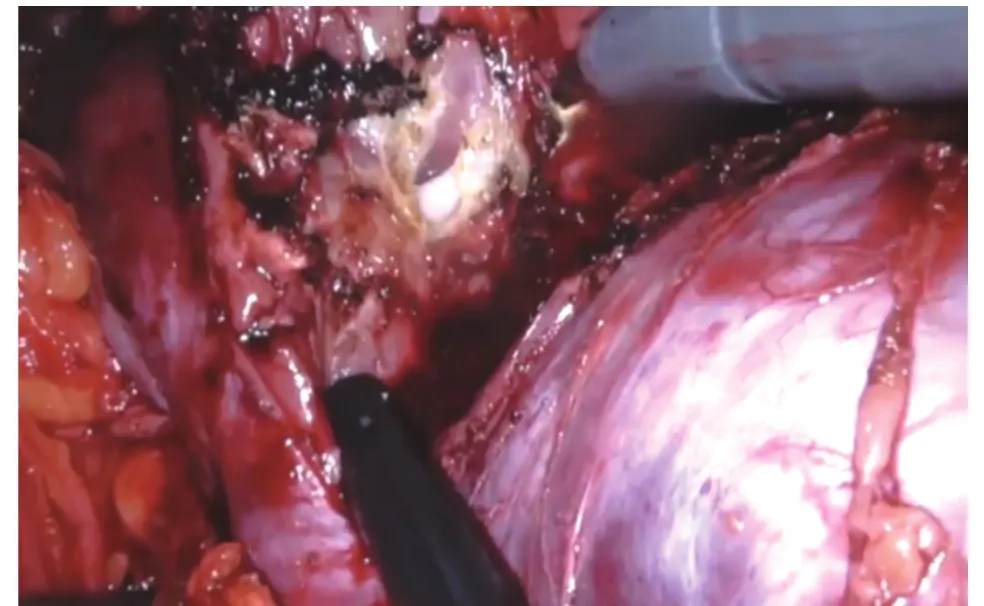
圖2 切除腫瘤組織
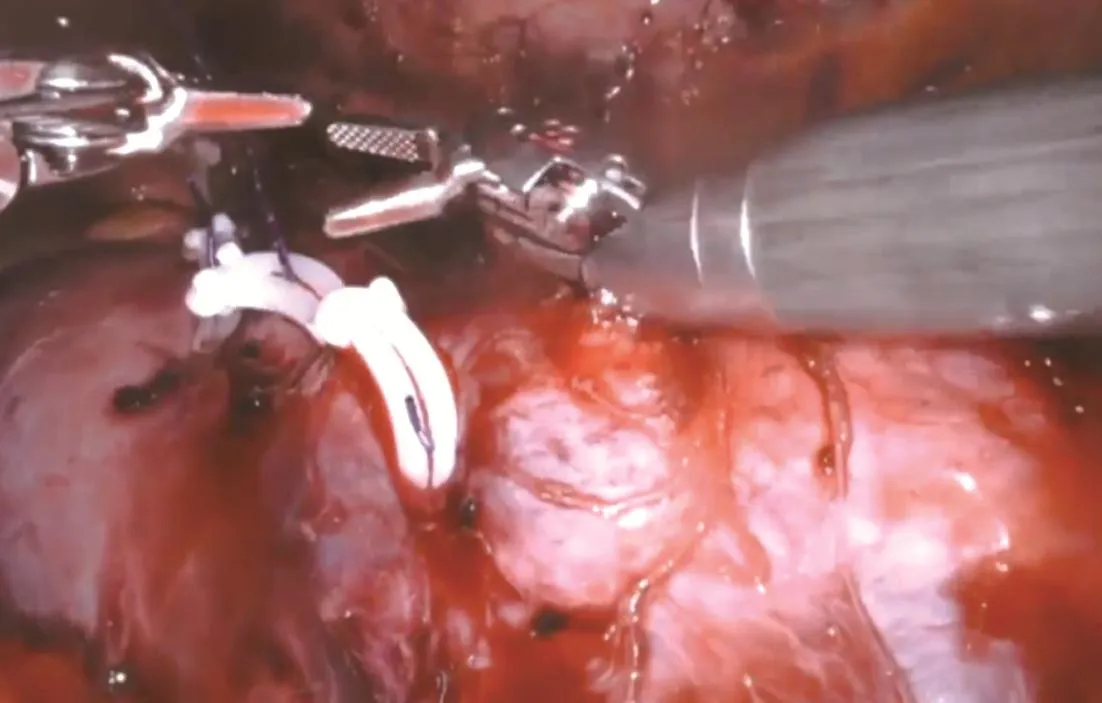
圖3 縫合創面
1.4 出院標準 患者可進食固體或脂溶性食物,可自由地活動,口服藥物治療(無需輸液),達到上述標準并結合患者意愿安排出院。
1.5 隨訪 患者出院后2個月內采取短信、微信或電話的方式與患者進行隨訪聯絡,了解患者術后一般情況、切口疼痛情況、飲食情況、尿色及尿量等,一旦患者病情發生變化,隨時與醫生聯系,評估是否需要采取干預措施。
1.6 統計學處理 采用SPSS 18.0軟件進行數據分析,計量資料以均數±標準差(±s)表示,采用t檢驗,率的比較采用χ2檢驗,重復測量資料采用方差分析,P<0.05為差異有統計學意義。
2 結 果
2.1 手術結果的比較 兩組均由同一組術者成功完成機器人輔助腹腔鏡下腎腫瘤剜除術。兩組手術時間、出血量差異無統計學意義(P>0.05);術中均無周圍器官損傷、大出血(出血量>400 mL)、中轉其他術式發生,見表3。術后病理:ERAS組透明細胞癌48例、乳頭狀腎細胞癌8例、嫌色細胞癌2例,錯構瘤2例;對照組透明細胞癌51例、乳頭狀腎細胞癌5例、嫌色細胞癌3例,錯構瘤1例。
2.2 術后相關指標的比較 ERAS組肛門首次排氣時間、開始進食時間短于對照組,差異有統計學意義(P<0.05),兩組腸道并發癥發生率差異無統計學意義(P>0.05)。見表3。ERAS組首次下床活動時間、導尿管留置時間、引流管留置時間、總住院時間、住院費用優于對照組,見表4。ERAS組5例、對照組3例術后48 h內發生一過性血尿(血色素下降值均小于2 g/mL),患者制動,加強止血治療后癥狀均緩解。病理報告切緣均為陰性,無嚴重漏尿、肌酐明升高需要血透的患者。術后2 h、24 h、48 h靜息狀態下,兩組VAS評分差異均無統計學意義(P>0.05);輕微咳嗽狀態下,術后2 h,兩組VAS評分差異無統計學意義(P>0.05),術后24 h、48 h兩組評分差異有統計學意義(P<0.05)。見表5。
2.3 隨訪結果 術后進行2個月的隨訪,ERAS組4例發生切口延期愈合,對照組發生3例,兩組患者均未發生呼吸道、切口感染,無繼發性出血需輸血、漏尿、需再次住院治療的病例。
表3 兩組患者手術結果及術后胃腸道恢復情況的比較(±s)
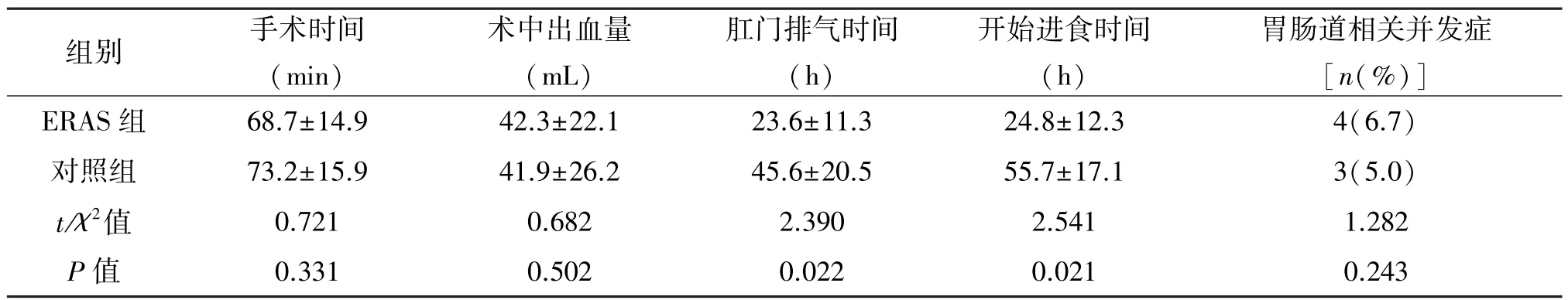
表3 兩組患者手術結果及術后胃腸道恢復情況的比較(±s)
組別 手術時間(min)術中出血量(mL)肛門排氣時間(h)開始進食時間(h)胃腸道相關并發癥[n(%)]ERAS 組 68.7±14.9 42.3±22.1 23.6±11.3 24.8±12.3 4(6.7)對照組 73.2±15.9 41.9±26.2 45.6±20.5 55.7±17.1 3(5.0)t/χ2值 0.721 0.682 2.390 2.541 1.282 P值 0.331 0.502 0.022 0.021 0.243
表4 兩組患者術后觀察指標的比較(±s)

表4 兩組患者術后觀察指標的比較(±s)
組別 首次下床活動時間(h)導尿管留置時間(h)引流管留置時間(h)住院時間(d)住院費用(萬元)ERAS 組 45.0±11.3 82.4±11.5 80.4±14.3 9.7±1.23 5.87±1.07對照組 124.6±25.9 132.6±32.6 140.6±31.2 13.0±1.54 7.34±1.68 t值 3.451 2.380 2.931 2.651 2.252 P值 0.001 0.020 0.005 0.011 0.030
表5 兩組患者術后靜息狀態與咳嗽狀態VAS評分的比較(±s)
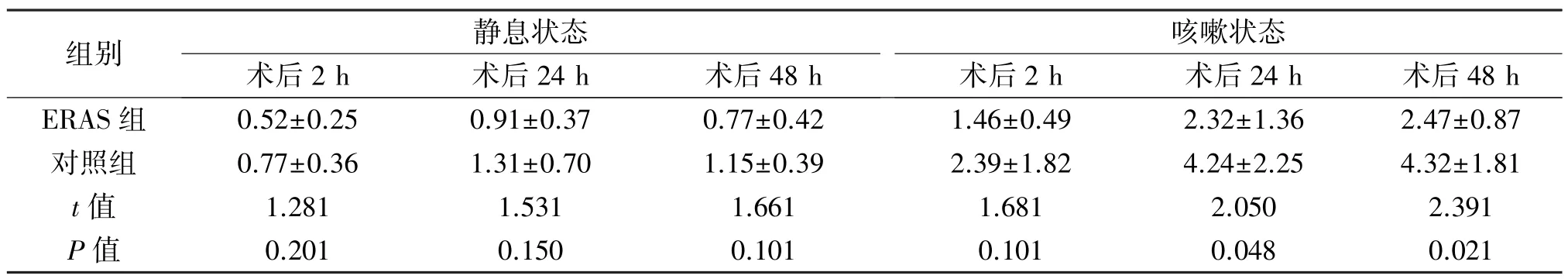
表5 兩組患者術后靜息狀態與咳嗽狀態VAS評分的比較(±s)
組別 靜息狀態咳嗽狀態術后2 h 術后24 h 術后48 h 術后2 h 術后24 h 術后48 h ERAS 組 0.52±0.25 0.91±0.37 0.77±0.42 1.46±0.49 2.32±1.36 2.47±0.87對照組 0.77±0.36 1.31±0.70 1.15±0.39 2.39±1.82 4.24±2.25 4.32±1.81 t值 1.281 1.531 1.661 1.681 2.050 2.391 P值 0.201 0.150 0.101 0.101 0.048 0.021
3 討 論
近年腎癌發病率逐年升高[5]。NSS治療早期局限性腎癌可最大程度保留患者的腎功能,且在臨床腫瘤學效應方面與根治性腎切除術相當,因此NSS越來越被廣大醫生及患者接受。NSS術式經歷了開放手術、腹腔鏡下腎腫瘤剜除術及達芬奇機器人輔助腹腔鏡腎部分切除術(robotic-assisted partial nephrectomy,RAPN)三個階段。自 2004年 Gettman等[6]報道了首例RAPN后,國內外對RAPN進行了相繼的研究報道。與傳統腹腔鏡技術相比,達芬奇機器人手術系統具有獨特的深部及精細操作技術優勢,并具有3D高清視野成像系統、全自由度關節及符合人體工程學的操控系統,克服了傳統腹腔鏡的不足,使術者可更加從容地施行腎腫瘤手術。目前研究證實,RAPN在縮短熱缺血時間或降低并發癥發生率方面優于腹腔鏡腎部分切除術,而在腫瘤學控制方面,兩者相近[7]。由于NSS手術較為復雜,術后潛在的風險與并發癥較多,因此該術式應用ERAS的報道較少。隨著外科技術的不斷提高,尤其機器人輔助手術鏡下縫合技術水平得到很大提高,這使得ERAS應用于NSS成為可能。
ERAS的核心是盡量減少患者圍手術期的應激反應,加快康復進程[8]。其中胃腸道功能的恢復是患者加速康復的關鍵,ERAS采取術前不再進行機械性腸道準備、長時間禁食,術后盡早恢復進食等措施,可減少患者機體的應激反應,加速康復[9]。由于RAPN術中僅打開側腹膜,絕大多數手術操作均在腎周筋膜內完成,因此對患者腸道蠕動的影響及潛在損傷更小,因此相較腹部外科手術,RAPN對腸道的干擾更小,因此對于術前免灌腸、較短時間的禁飲食,術后盡早恢復進食等措施,患者耐受性更好。此前我們在腹腔鏡下腎癌根治術及腎上腺切除術圍術期采用上述措施,均取得明顯效果[10-11]。本研究中將ERSA理念應用于機器人輔助下腹腔鏡腎腫瘤剜除術,結果表明ERAS組術后胃腸功能恢復方面優于對照組。
此外,術后良好的鎮痛也是ERAS另一個比較重要的措施,可有效降低患者的應激反應,多模式鎮痛可有效鎮痛并降低并發癥發生率、促進早期康復[12]。阿片類藥物用于術后鎮痛可引起包括呼吸抑制、術后惡心嘔吐、尿潴留、腸梗阻等并發癥的發生,因此應盡量避免使用。本組病例在以前經驗基礎上,仍采用非甾體類抗炎藥鎮痛,顯示了安全有效的鎮痛效果。有效鎮痛是早期活動的前提保證,也是減輕患者應激反應、促進加速康復的重要舉措。
腎腫瘤剜除手術較腎癌根治更加復雜,術后有發生繼發出血或尿漏的風險,完整切除腫瘤組織,并確切縫合殘余創面,減少繼發出血及漏尿等并發癥的發生,才能談得上加速康復。因此外科手術的精準實施及術后及時觀察處理成為此術式應用ERAS理念的關鍵。本組術前常規行CTA檢查,明確腎動脈有無變異,防止遺漏,術中利用機器人靈活機動的優點,根據腫瘤大小、位置決定切除的深度及縫合方法。對于腫瘤位置較深、可能切破血管竇或腎盞的患者,予以倒刺線分層縫合;余者予以倒刺線全程貫穿縫合。術中盡量縮短熱缺血時間,術后嚴密觀察有無繼發出血、漏尿、胃腸道損傷及腎功能變化等,并及時處理。入組的120例患者,無一例中轉其他術式,且無大出血病例(大于400 mL),熱缺血時間平均(18.3±6.8)min,術后密切觀察引流量及引流液性狀,觀察每日尿量及尿液性狀變化,ERAS組即使腫瘤位置較深,由于采用分層縫合較為確切;如果術后引流顏色淡,引流量少,尿色清,我們鼓勵患者盡早恢復進食,盡早下床活動,盡早拔管。對于術后引流液偏多、顏色偏深甚至有血尿的ERAS組患者,我們還是適當延遲其進食、活動及拔管時間。兩組患者均于術后13 d內順利拔除引流管及導尿管。
機器人手術就是精準手術,ERAS理念則是在圍手術期盡量減少患者的應激反應,兩者目標一致;本研究結果表明,ERAS理念應用于機器人手術也可取得滿意效果。相信隨著泌尿外科手術越來越微創、越來越精準,ERAS在泌尿外科會有更廣泛的應用前景。

