核糖體肽生物合成中的典型翻譯后修飾研究
汪金秀 張琪 丁偉 陳拓
(1. 中國科學院西北生態環境資源研究院,蘭州 730000;2. 復旦大學化學系,上海 200433;3. 中國科學院大學,北京 100049;4. 上海交通大學生命科學技術學院,上海 200030)
抗生素濫用導致細菌耐藥性日趨嚴重,天然產物作為抗生素的主要來源,根據其生物合成途徑的不同,可以分為聚酮、聚肽、萜類和生物堿等,其中聚肽類可分為非核糖體肽化合物(Non-Ribosomal Peptides,NRPs)和核糖體肽化合物(Ribosomally synthesized and posttranslationally modified peptides,RiPPs)兩大類[1],RiPPs 類天然產物因其化學結構和生物活性多樣性在抗生素開發方面受到廣泛的關注[2-3]。
RiPPs是以核糖體翻譯合成的前體肽(Precursor peptide,一般由20-110氨基酸組成)為基礎,經過一系列后修飾酶的化學修飾,最終生成的具有一定生物活性的多肽類天然產物。其生物合成邏輯具有共同的特征,即都來自于前體肽,前體肽由結構基因翻譯出的N端前導肽(Leader peptide)和C端的核心肽(Core peptide,某些C端含有識別序列Recongnition sequence),具有潛在活性的核心肽被催化生成具有成熟活性的肽類天然產物,前導肽和識別序列最終被移除(圖1)。核糖體肽復雜多樣的翻譯后修飾使其呈現出廣泛的化學結構多樣性多樣性(圖2)。
1 RiPPs分類及作用機制
細菌、真菌、植物及動物都可產生核糖體肽化合物[4],其中,產生RiPPs最多的為細菌中的厚壁菌門[5]。目前,已知RiPPs有500余種,根據翻譯后修飾特征及其形態特征,將其分為18類[6](圖3)。RiPPs不僅種類眾多,生物活性更是多種多樣。因發現較早,種類較多,羊毛硫肽是RiPPs中的“明星”家族,其代表分子Nisin長期用于食品保鮮劑[7],但這些并不能掩蓋其余RiPPs的光芒,如真菌來源的核糖體肽 Phomopsin A具有良好的抗腫瘤活性,Siamycin具有抗HIV活性[8],Microcin具有抗革蘭氏陰性菌活性[9],Capistruin是RNA酶抑制劑[10]等。
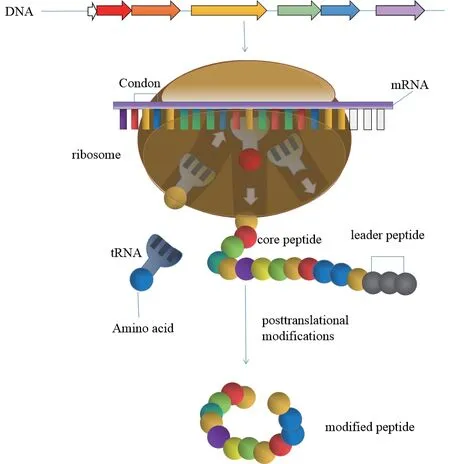
圖1 RiPPs類天然產物生物合成邏輯
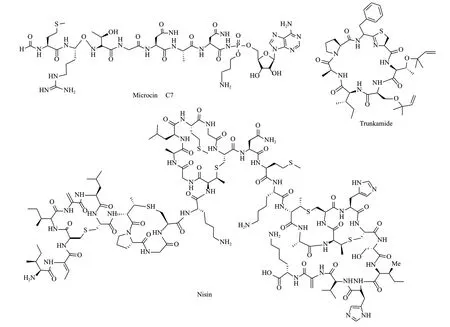
圖2 三種形態特征各異具有抗生素活性的核糖體肽類天然產物
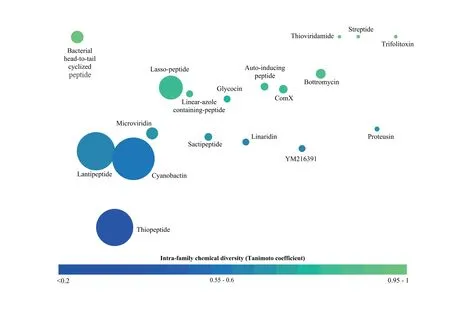
圖3 RiPPs種類
RiPPs類天然產物復雜多樣的化學結構使其抗菌機制呈現多元化及多重化,現有研究表明RiPPs可以作用于細菌細胞壁、細胞膜、DNA、RNA或酶等[11],如Salivaricin A2通過形成A環與細菌細胞 壁 的 脂 質II結 合[12],Polytheonamides的β螺 旋二級結構及N-酰基輔助單元可以使細胞膜形成孔道[12-13],Microcin J25是RNA聚合酶抑制劑等。有些RiPPs還具有多重抗菌機制[14],既可抑制細菌細胞壁的形成,又可以使細胞膜穿孔,如Nisin[15](圖4)。
2 翻譯后修飾
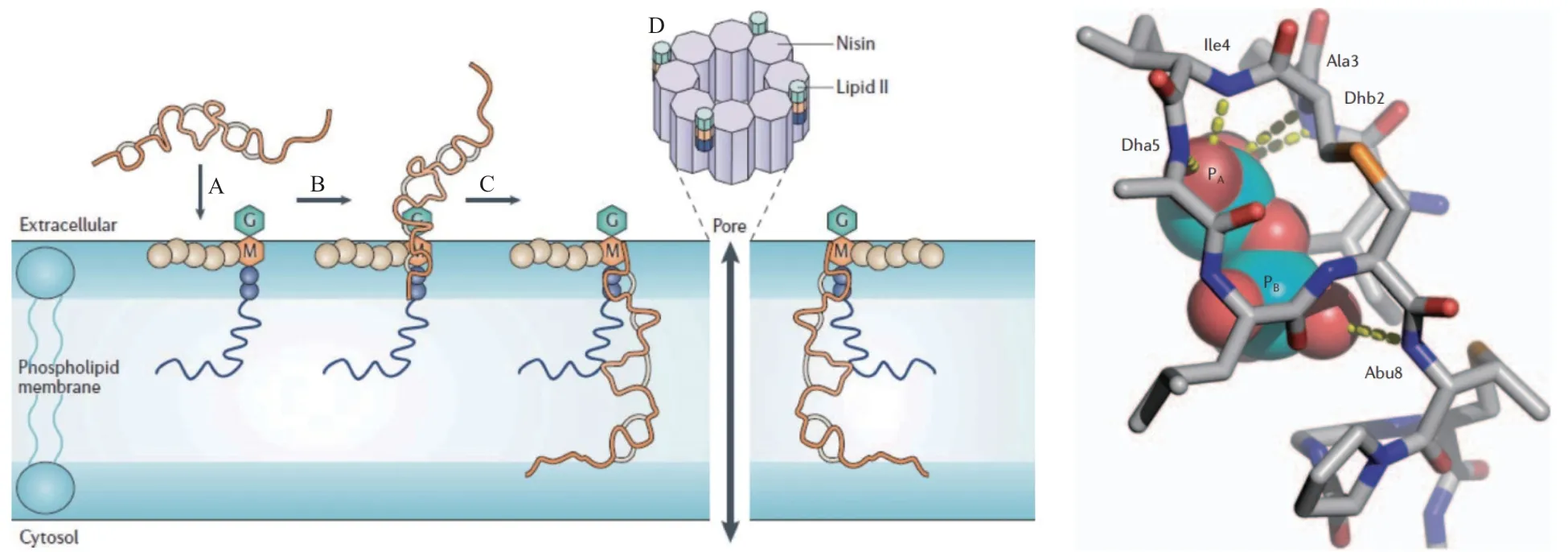
圖4 Nisin作用機制及與lipid II作用圖
復雜多樣的翻譯后修飾在RiPPs化學結構多樣性和生物活性多樣性中起著極其重要的作用[16]。這一重要過程的“主角”是前體肽(Precursor peptide)和修飾酶(Tailoring enzymes),前體肽由N端的前導肽(Leader peptide)和C端核心肽(core peptide)組成,核心肽被后修飾酶如脫水酶、氧化還原酶或環化酶等催化修飾,前導肽隨后被一系列轉運體、肽酶或兩者的結合體移除,最終成為具有生物活性的成熟的核糖體肽類天然產物[16](圖5)。前導肽雖然最終被切掉了,但是在翻譯后過程中,它是修飾酶、免疫以及輸出過程必不可少的識別“卡片”。雖然生物合成酶識別前體肽的具體細節尚不清楚,但是研究表明大多數前導肽在溶液中或與生物合成蛋白結合時都傾向于形成α螺旋。前導肽和核心肽的長度在不同系統中差異很大,值得注意的是,其長度與成熟肽的長度并無相關性。前體肽通過翻譯后修飾最終成為成熟的肽,修飾主要有脫水、環化和重排。此外,還可以形成二硫鍵和雜環,大環化和核苷酸化等[14];根據修飾發生的位置,可以分為主鏈修飾和側鏈修飾[17]。酶在各類翻譯后修飾過程中具有舉足輕重的作用[18]。
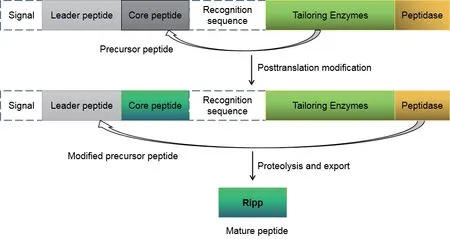
圖5 RiPPs翻譯后修飾過程[16]
2.1 側鏈修飾
2.1.1 絲氨酸和蘇氨酸脫水(Dehydratase) 絲氨酸(Ser)和蘇氨酸(Thr)脫水是側鏈常見修飾,含羥基的氨基酸Ser和Thr在脫水酶(Dehydratase)的作用下分別生成2,3-雙脫氫丙氨酸(Dha)和(Z)-2,3-雙脫氫丁氨酸(Dhb)[19],絲氨酸和蘇氨酸脫水形成的雙鍵進而可以和分子內的巰基或胺基發生加成反應,生成醚或亞胺,這種分子內的親電加成反應可以生成已知化學結構的RiPPs的中特征結構單元,如羊毛硫肽(Lanthionine),含氨基乙烯基半胱氨酸殘基(AviCys)的多肽,含賴丙氨酸的多肽[20](圖6)。
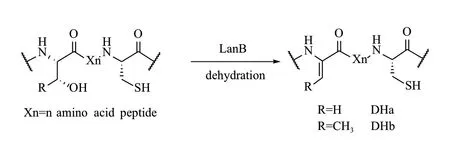
圖6 I型羊毛硫肽合成酶LanB催化絲氨酸(Ser)和蘇氨酸(Thr)脫水[20]
2.1.2 半胱氨酸、絲氨酸和蘇氨酸雜環化(Heterocyclization) 當來源于Cys,Ser或Thr的側鏈硫醇或羥基親核進攻相鄰氨基酸的羰基碳時,分別形成噻唑啉,惡唑啉或甲基惡唑啉[21-22],而α-β連接部分的進一步氧化,分別形成了噻唑環、噁唑環或甲基噁唑環(圖7)。雜環化在RiPPs中具有重要作用,首先,雜環結構限制了肽骨架的構象,使多肽結構更穩定。其次,雜環作為非常通用的藥效團,與含雜環的天然產物、蛋白質或核酸之間存在多種相互作用[23]。另外,噻唑常出現在許多鐵載體中,這為某些含雜環的核糖體肽類物質充當金屬螯合劑提供了可能性[23]。噁唑啉和噻唑啉氧化成噁唑環和噻唑環,這進一步限制了肽的構象,并能夠顯著影響生物活性。將噁唑啉/噻唑啉氧化成噁唑/噻唑可顯著降低水解開環傾向[24],這點是否具有生物相關性尚不清楚。最后,盡管Cys和Ser衍生的雜環是電子等排的,但已有論據證明噁唑啉/噁唑取代噻唑啉/噻唑之后會在極大程度上影響生物活性[25]。
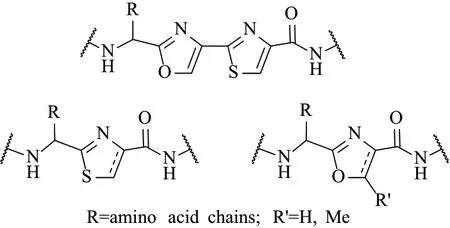
圖7 來源于半胱氨酸,絲氨酸和蘇氨酸的雜環[22]
2.1.3 異戊二烯化(Prenylation) RiPPs中,在核心分子中加入異戊二烯衍生的亞基是極為普遍的。在初級代謝中,異戊二烯衍生對正常的細胞功能也至關重要,如蛋白的法尼基化和四異戊二烯化作用[26]。目前文獻報道的異戊二烯化的RiPPs有2個家族,其一是從芽孢桿菌(Bacillus)分離的ComX信號肽家族。高度保守的Trp殘基進行法尼基化(Farnesylated)或香葉基化(Geranylated),以生成異戊二烯化的肽。生物合成的異戊二烯化反應在異戊二烯基焦磷酸的1位C和Trp的3位C之間形成C-C鍵,同時在Trp的N原子和Trp的2位C之間形成新鍵,在Trp殘基上形成第3個環[27](圖8)。其二是來自藍細菌(Prochloronspp. cyanobacteria)的Cyanobactin peptides的修飾,有學者推測是通過由二甲基烯丙基焦磷酸化(DMAPP)得到,共價醚鍵由Ser/Thr羥基和DMAPP 3位C碳親核反應形成[28]。來自藍細菌的其他烯丙基化小肽在DMAPP的1位C或3位C處被修飾。通常,RiPPs的異戊烯化會增強其親脂性[29](圖8)。
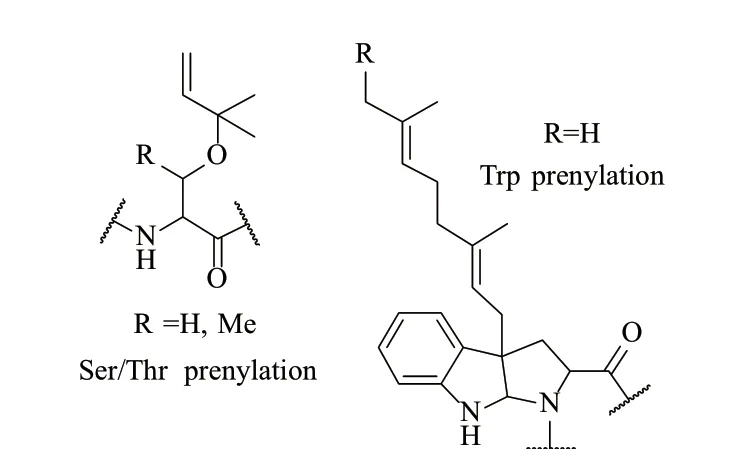
圖8 Ser、Thr和Trp的烯丙基化后的結構[26]
2.1.4 SAM自由基修飾 在RiPPs中,自由基S-腺苷甲硫氨酸(RadicalS-adenosylmethionine,rSAM)蛋白質家族可以負責進行一些十分困難的生物學轉化[30]。rSAM 中4Fe-4S簇通常與3個半胱氨酸殘基連接,而這3個半胱氨酸殘基通常是來源于易于識別的CxxxCxxC序列。Fe-S簇將電子轉移到SAM上,對SAM的不穩定的S原子進行還原裂解,從而得到甲硫氨酸和5'-脫氧腺苷(5'-Ado)自由基(圖9-A)[31]。該自由基被用于進行各種具有挑戰性的合成反應,如Sactipeptide中 硫 醚 鍵 的 形 成(圖9-B)[32-33];隨著家族成員的增多,rSAM蛋白的功能不斷擴展,如那西肽(Nosiheptide)含有的吲哚酸衍生物就是由兩種rSAM酶NosL和NosN催化的,NosL 負責L-色氨酸重排至3-甲基-2-吲哚酸(3-methyl-2-indolic acid,MIA)[34](圖9-C)。其中,NosL是rSAM家族中第一個可以同時使底物發生裂解和重排的酶。
此外,rSAM依賴的自由基酶催化多樣性是RiPPs生物合成的一大研究方向和熱點。
2.2 主鏈修飾
2.2.1 蛋白水解(Proteolysis) 前體肽的蛋白水解是RiPPs生物合成中的主要特征,除Pyrroloquinoline quinone(PQQ)和Cyanobactins在N端和C端都發生水解之外,蛋白水解一般發生在肽N端,蛋白水解后RiPPs才具有活性[35](圖2)。有些蛋白水解酶與ABC轉運蛋白偶連在一起,即可以進行前體肽水解,同時也可以進行轉運輸出,如II型羊毛硫肽中LanT,H?varstein等[36]認為這與前體肽序列中的雙甘氨酸基序有關。每類RiPPs都有相同的前體肽保守序列作為前體肽水解酶的識別位點,I型羊毛硫肽前體肽保守序列位于位于-18和-15區,-1位的精氨酸和-4位的丙氨酸對于水解酶NisP的識別是必須的;II型羊毛硫肽和一些細菌素,識別位點為GG或GA[37](圖10)。因此,僅使用生物信息學方法就可以準確預測一些RiPPs最終產物的氨基酸組成。雖然前體肽最終被切除,但它在RiPPs的生物合成過程中具有重要意義,它不僅是修飾酶、免疫及輸出過程必不可少的識別“卡片”,還能起到保護宿主的作用[38]。
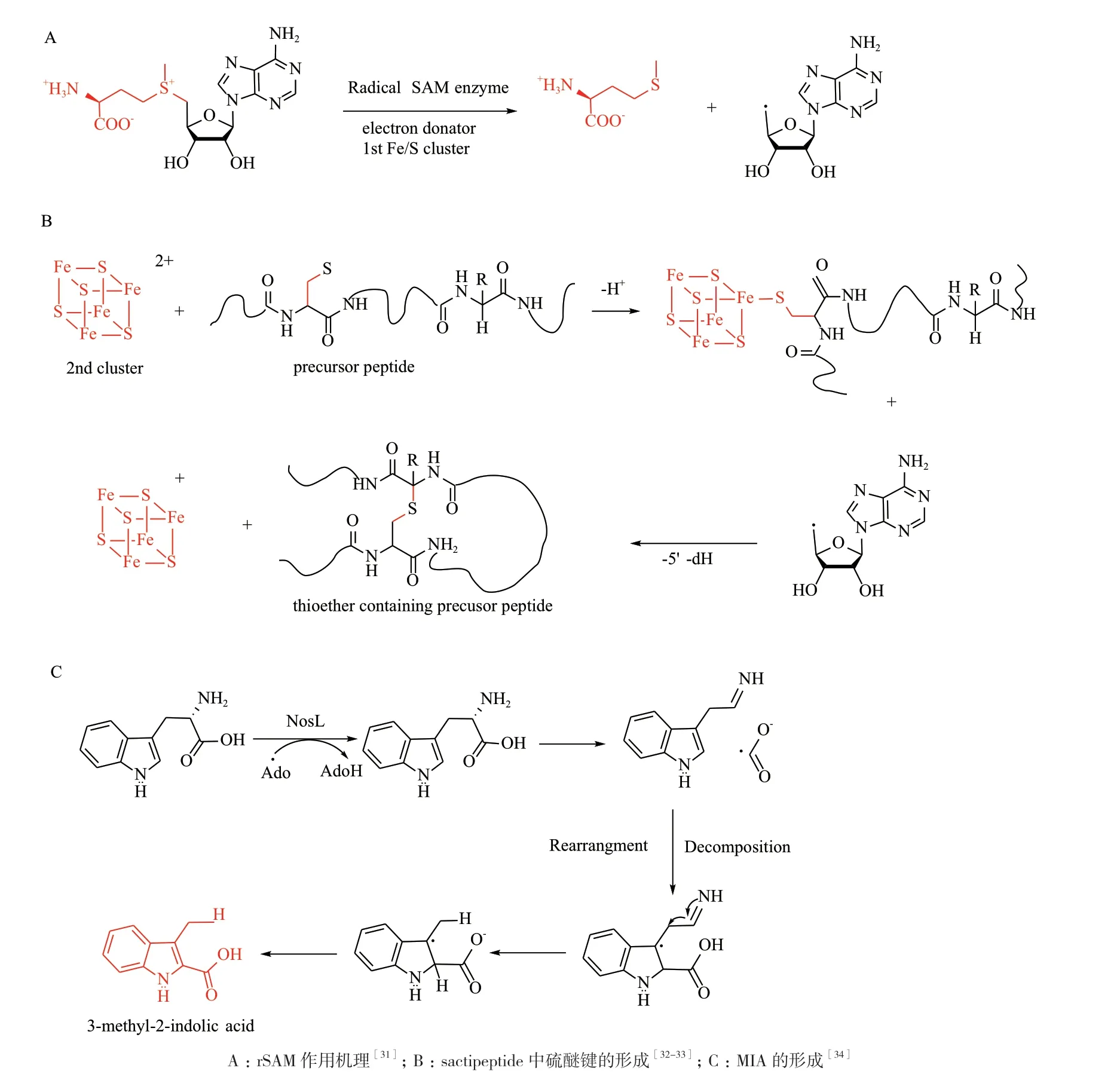
圖9 rSAM依賴的生物學轉化
2.2.2 大環化(Macrocyclization) 真核生物中,RiPPs一般是N-C末端大環化,而在細菌RiPPs中,除了N-C大環化形成酰胺鍵之外,一些親核側鏈殘基之間也可以形成酰胺鍵(圖11),細菌來源的N-C端大環化的RiPPs在大小上差異較大,如Cyanobactins僅由6-12個氨基酸組成[39],Uberolysin和Butyrivibriocin AR10等可以多達70個氨基酸,Subtilosin A有35個氨基酸,且除了N-C端的大環外,還含有硫醚鍵形成的小環[40]。RiPPs環化可以賦予化合物結構剛性以增加代謝穩定性,修飾N和C末端以限制外切蛋白酶降解的敏感性。有學者認為構象剛性可以讓化合物更好的與目標靶點結合,另外環化特征也可以賦予化合物藥理學特性[41]。
2.2.3 核苷酸化(Nucleotidylation) 核苷酸修飾在生物分子中十分常見,然而,在所有的細菌素中,僅Microcin C7(或被稱為Microcin C51320)是被核苷酸化修飾過的[42](圖12)。這種修飾有趣之處在于通過形成氮磷磷酰胺鍵來實現核苷酸修飾。修飾后的Microcin C7是腺苷化的天冬氨酸Asp的結構類似物,而這個中間體可使得天冬酰胺-tRNA帶上電荷。

圖10 I型和II型羊毛硫肽和非羊毛硫肽細菌素的序列比對圖[37]
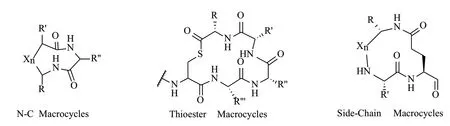
圖11 幾種環化RiPPs[6]

圖12 Microcin C7核苷酸化修飾[42]
2.2.4 形成內酯(Lactone formation) 細菌的RiPPs中,僅在革蘭氏陽性細菌產生的Quorum sensing peptides中發現內酯,特別是產自葡萄球菌(Staphylococcus)的多種自誘導肽(Auto-inducing peptide,AIP)衍生物,這類自誘導肽衍生物含有5-9個氨基酸,結構中含有多個硫代內酯環[43]。一般是C末端的5個Cys殘基上的巰基SH進攻末端羧基形成硫代內酯。而僅有兩個特例,當5個Cys殘基突變為Ser殘基后,形成的是內酯而非硫代內酯。這種環狀結構對于生物活性至關重要,某些細菌菌株會產生內酯酶,可以破壞Quorum sensing peptides[44]。
2.2.5 吡咯并喹啉醌(Pyrroloquinoline quinone,PQQ)修飾 PQQ是細菌代謝中的氧化還原輔因子,具有獨特的結構特征[45]。前體肽PqqA的長度為23-39個氨基酸,其具體長度取決于細菌種族。在前體肽PqqA中發現的是序列:Glu-Val-Thr-Leu-Tyr,與Cyanobactins一樣,其C端和N端均會從前體肽中切除。在加工過程中,將Glu和Tyr連接在肽上,并切除所有其他氨基酸。在生物合成過程中形成1個C-C鍵和2個N-C鍵,通過幾次氧化反應縮合生成PQQ雜環[46](圖13)。
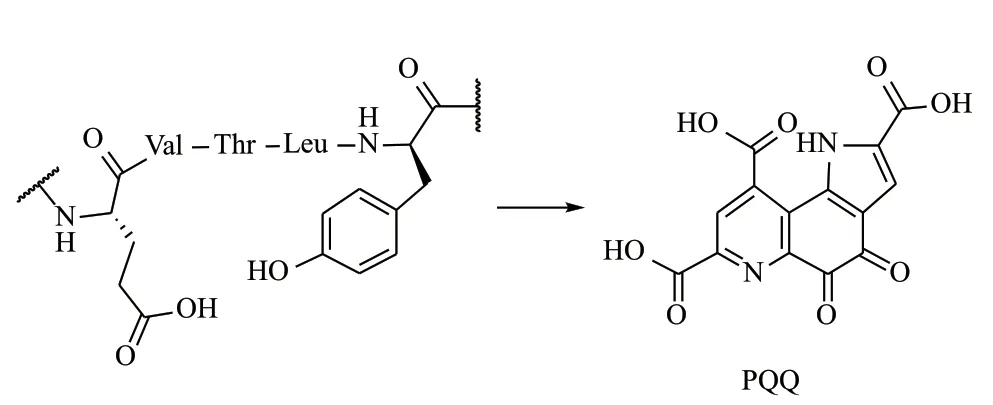
圖13 PQQ的形成過程[46]
正是這些種類繁多的后修飾反應,才造就了核糖體肽類抗生素的化學結構多樣性和生物活性多樣性。RiPPs生物合成酶的不斷出現,極大拓展了我們對自然界有機反應及酶的進化適應性的認識。但是自然界還有大量RiPPs修飾酶未被表征,相應地,許多翻譯后修飾的生物合成過程也依舊未揭開其神秘的面紗,這將是未來RiPPs研究的焦點和趨勢所在。
3 基因挖掘與發現新的RiPPs
生物信息學的發展極大推動了RiPPs研究,利用編碼前體肽或生物合成蛋白的基因之間的序列相似性,在DNA和蛋白序列數據的數量不斷增加,以及有關RiPPs生物合成途徑的不斷更新的背景下通過生物信息技術與合成生物學相結合的方法,因此得以發現許多新的RiPPs[47-48],RiPPs基因組挖掘策略如圖14。目前,RiPPs基因組挖掘所用的工具通常有BLAST、BAGEL、antiSMASH、ClusterFinder和RiPP-PRISM等。Emmanuel開發的NeuRiPP系統利用深度神經網絡(Deep neural network,DNN)模型可以在一定程度上預測新前體肽序列[49],但是前體肽的識別仍然是一項需要繼續完善的工作。有研究者分析了65 421個原核生物的基因組發現,編碼RiPPs的原核生物多達20%,編碼RiPPs基因組多達近2 000個[50],而目前已知的RiPPs不過500余種,RiPPs具有極大的開發潛能。
通過比對各種數據庫,一方面,可以根據前體肽(Precursor peptide)中保守的前導肽(Leader peptide)序列找到同一家族未被挖掘的RiPPs;另一方面,生物信息學揭示了許多生物合成途徑可以利用同樣的酶進行某一翻譯后修飾過程,可以通過序列相似性網絡圖清楚了解目標酶所屬的類群,從而更好更有目的性的去研究其結構和功能,如參與羊毛硫肽(Lanthepteptides)生物合成的Ser/Thr脫水酶也在硫肽和一些線性含唑肽(leucine aminopeptiolase,LAP)的生物合成途徑中發揮作用[51-53];而某些參與硫肽中噁唑和噻唑形成的酶也在LAP、肉毒桿菌素和藍藻素的生物合成基因簇中發現;編碼SAM自由基酶的基因也出現在硫肽和肉毒桿菌素(Bottromycins)的生物合成基因簇中[54-55]。由此可見,翻譯后修飾酶基因的水平轉移極大推動了化合物結構進化。基因組挖掘為發現更多的化學結構和生物活性新穎的RiPPs提供了加速器。
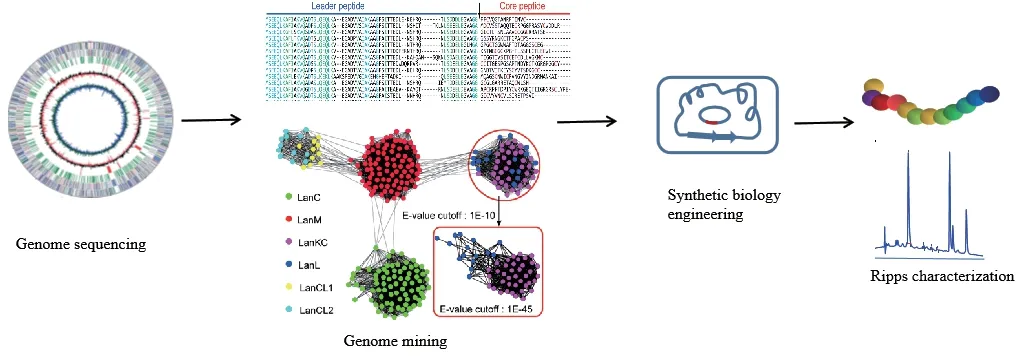
圖14 RiPPs基因組挖掘策略流程圖
4 總結與展望
來源于細菌、真菌、植物及動物的各類RiPPs,擴充了化合物的化學結構多樣性和生物活性多樣性。相較NRPs必須通過非核糖體肽合成酶功能改造才能獲得化學結構新穎的類似物,RiPPs的優勢在于可僅從基因水平上改變幾個密碼子來改變化合物的骨架結構,通過組合生物等改造手段獲得多種具有生物活性的衍生物,其生物改造簡單易行,這在新化合物合成和發現方面獨具優勢,尤其在細菌耐藥性日益增強而新抗生素日漸式微的當下,RiPPs對于開發新藥意義重大。RiPPs種類繁多的翻譯后修飾過程研究不僅具有重要的理論價值,同時為代謝工程和合成生物學奠定了基礎。
生物信息學的不斷前進,勢必會加速新RiPPs的挖掘,通過在各類數據庫中比對保守的前導肽序列,找到同一家族未被挖掘的RiPPs,通過修飾酶序列相似性網絡圖清楚了解目標酶所屬的類群,從而更有目的性的去研究其結構和功能,再結合合成生物學、分子生物學及生物化學等方法,完成從基因序列到活性化合物的研究過程,從而挖掘出更多結構和功能新穎的化合物。
此外,各類生物技術,如基因編輯技術、蛋白質工程和細胞工程等的不斷進化和發展也是新RiPPs挖掘的加速器,相信隨著這些技術的不斷完善和進化,未來將有更多功能和結構新穎的RiPPs與我們見面。

