結直腸廣基鋸齒狀病變臨床病理研究進展
范思斯,曾 俊,劉 勇
1996年Torlakovic和Snover[1]首次報道6例“增生性息肉病”中觀察到廣基鋸齒狀息肉(sessile serrated polyp, SSP),并稱之為形態學類似增生性息肉的“鋸齒狀腺瘤”。2003年Torlakovic等[2]再次對無“增生性息肉病”的289例鋸齒狀息肉進行詳細評估,發現了一組異常增殖的鋸齒狀息肉,與1996年觀察到的廣基鋸齒狀息肉形態學相似,為使此類息肉患者接受密切結腸鏡監測,作者建議將其命名為廣基鋸齒狀腺瘤(sessile serrated adenoma, SSA)。鑒于上述鋸齒狀息肉缺乏腺瘤樣上皮,WHO(2010)消化系統腫瘤分類中采納廣基鋸齒狀腺瘤/息肉(SSA/P)并列的命名方式。2017年英國胃腸病學會發布結直腸鋸齒狀息肉臨床指南,考慮缺乏細胞學異型性且不完全呈息肉狀,因而推薦使用廣基鋸齒狀病變(sessile serrated lesion, SSL)[3]。WHO(2019)消化系統腫瘤分類[4]中采納廣基鋸齒狀病變或廣基鋸齒狀病變伴異型增生(sessile serrated lesion with dysplasia, SSLD)的命名,不再推薦SSA/P的命名。
1 結直腸廣基鋸齒狀病變臨床表現
SSL多位于近端結腸,即乙狀結腸以近,有文獻報道國人乙狀結腸也是好發部位[5]。直徑常>5 mm,中位年齡61歲[6],無明顯性別差異。普通白光內鏡下易遺漏,病變多扁平,邊界模糊。巴黎分型主要為0~Ⅱa型,部分為0~Ⅰs型,偶有0~Ⅱa+Ⅱc型或0~Ⅰs+Ⅱc型。放大內鏡下SSL具有獨特的隱窩開口模式,即工藤分類Ⅱ-open(Ⅱ-O)型,較經典Ⅱ型星芒狀隱窩開口更寬更圓。Aoki等[7]比較了388例結直腸鋸齒狀病變和普通型腺瘤的放大內鏡表現,91例Ⅱ-O型病變中87.9%為SSL。窄帶成像內鏡下黏液帽呈紅色,隱窩表面見黑點及曲張微血管,NICE分型Ⅰ型多見。
SSLD較少見,占全部SSL的2%~14%[6,8-9],也主要位于近端結腸,中位直徑為9~12 mm[9-10],中位年齡66~75歲[6,9-10],女性多發[6,9-10]。普通白光內鏡下巴黎分型為Ⅱa+Ⅰp或Ⅱa+Ⅲ型,放大內鏡下工藤分類為Ⅱ-O+Ⅲ/Ⅳ型[11]。Aoki等[7]的研究發現36例Ⅱ-O+Ⅲ/Ⅳ型病變中69.4%為SSLD。窄帶成像內鏡下也類似普通型腺瘤改變,NICE分型呈Ⅱ型。
2 結直腸廣基鋸齒狀病變病理特征
SSL的增殖中心不同于正常結直腸中位于隱窩基底部,而是沿隱窩腔雜亂分布,隱窩上皮細胞從各增殖中心向隱窩開口及基底部雙向遷移,形成了一系列結構異常:(1)隱窩整體不規則,扭曲;(2)隱窩拉長,甚至陷入黏膜下層造成“假浸潤”;(3)鋸齒狀結構延伸至隱窩基底部;(4)隱窩下部不對稱性擴張,形成分支,或平行于黏膜肌生長,呈L或倒T形、“高跟鞋樣”或“錨狀”隱窩。WHO(2010)分類中寫到如果有2~3個以上連續隱窩顯示上述特征時診斷SSL,Rex等[12]國際多學科專家組建議只要有一個明確的異常隱窩就足以診斷。Bettington等[13]比較了采用WHO(2010)診斷標準時SSL約占所有結直腸息肉的12.1%,而采用上述多學科專家組建議時SSL的占比為14.7%。WHO(2019)分類更新為1個以上明確的異常隱窩足以診斷SSL[4]。SSL細胞學形態溫和,主要由杯狀細胞和含微泡型黏液的細胞構成,后者胞核小且位于基底,核仁不明顯。隱窩基底部出現杯狀細胞而缺乏神經內分泌細胞,即成熟反轉[12]。也有文獻提到SSL中存在一定程度的神經內分泌細胞增生[14]。隱窩表面及腔內可見多量黏液,少數情況下固有層間質神經束膜樣細胞增生,黏膜下層見顯著的脂肪瘤樣脂肪組織[12]。免疫組化標記Ki-67顯示隱窩腔及基底部雜亂著色,無MLH1表達缺失,無p53和p16過表達或表達缺失。
診斷SSLD需要在1張HE切片中見到SSL陡然轉變為異型增生的區域,該區域隱窩結構復雜程度增加伴不同程度的細胞學非典型。WHO(2010)分類中描述了兩類SSLD,分別是與普通型腺瘤類似的腸型異型增生和鋸齒狀異型增生,許多SSLD相關研究中進一步區分低/高級別[6,8,15]。Cenaj等[15]發現與普通型腺瘤相比,SSLD中出現浸潤癌的概率增加,并且腸型異型增生比鋸齒狀異型增生更多出現浸潤癌。2017年Liu等[9]提出了四類SSLD組織學亞型,分別是微偏型異型增生、腺瘤樣異型增生、鋸齒狀異型增生和非特指型異型增生。其中微偏型異型增生約占SSLD的19%[9],出現輕微的隱窩結構紊亂、擁擠,細胞學異型性不明顯,需要借助MLH1免疫組化標記來識別,表現為幾個鄰近隱窩MLH1表達丟失,偶爾見到1個或多個鋸齒狀結構不明顯的隱窩基底部MLH1丟失不足以診斷微偏型[14]。腺瘤樣異型增生約占SSLD的8%[9],SSL表面為與普通型腺瘤類似的異型增生,無MLH1丟失,無BRAF V600E表達,可能代表了普通型腺瘤異型增生與SSL的碰撞[16]。鋸齒狀異型增生約占SSLD的12%[9],細胞學異型性明顯,胞質豐富嗜酸性,胞核空泡狀,核仁明顯,核分裂象多見且位于隱窩腔緣。多數保留MLH1表達。非特指型異型增生約占SSLD的79%[9],隱窩結構和細胞學改變各異,異型性明顯但不能歸入上述三類特指型。多數MLH1表達缺失。WHO(2019)分類在WHO(2010)分類基礎上增加了對于微偏型異型增生的描述[4]。實際工作中SSLD并不需要嚴格分型,而是結合MLH1表達情況識別SSLD以避免漏、誤診。
依據上述SSLD組織學分型,Pai等[14]認為目前消化道普遍采用的異型增生兩級分類系統并不適用于SSLD分級,MLH1表達缺失與兩級分類系統無可靠相關性,后者不能充分反應SSLD的惡性潛能。這一點在Pai等[4]編寫的WHO(2019)分類“結直腸鋸齒狀病變和息肉”中也有相同描述,但此新版分類中卻給出了鋸齒狀異型增生低/高級別異型增生的ICD-O編碼。WHO(2019)分類正文中對鋸齒狀異型增生描述較為簡單,并未詳細列出相應低/高級別異型增生特點。同時新版分類中鋸齒狀異型增生的附圖顯示鋸齒狀增生上皮輕度異型,胞質嗜酸性,深染增大的細胞核呈輕微復層排列[4]。與之相對的是Liu等[8]描述的鋸齒狀異型增生細胞學異型性明顯,Pai等[14]也建議鋸齒狀異型增生只用于具有高級別核特征的異型增生,不區分低/高級別,所謂的“低級別鋸齒狀異型增生”代表的可能只是SSL中出現部分上皮嗜酸性變。
3 結直腸廣基鋸齒狀病變鑒別診斷
3.1 SSL與增生性息肉(hyperplastic polyps, HP)普通白光內鏡下SSL與HP表現類似,需結合其它內鏡、病變部位、大小和形態學加以鑒別。放大內鏡下HP為經典Ⅱ型隱窩開口;窄帶成像內鏡下HP無曲張微血管。HP多見于遠端結直腸,直徑多<5 mm,而SSL多見于近端結腸,且直徑多>5 mm。光鏡下HP的鋸齒狀結構位于隱窩中上2/3,基底部無鋸齒狀結構或其它異常結構。杯狀細胞型HP合并黏膜脫垂時可出現隱窩基底部對稱性擴張,但無其它異常結構。準確鑒別HP與SSL有賴于正確的組織塊包埋方向,必須縱切同時顯示隱窩淺部和深部。內鏡活檢時巴黎分型為Ⅱa的病變一般能鉗取到黏膜全層,而Ⅰs的病變不一定能鉗取到黏膜全層,即不能見到黏膜肌時很難鑒別兩者。還有SSL中可以多數隱窩基底部結構大致正常而少數甚至一個隱窩出現結構異常,由于活檢取材的局限性也可能漏診。
3.2 SSL與傳統鋸齒狀腺瘤(traditional serrated adenoma, TSA)TSA比SSL少見,占所有結直腸息肉的1%~2%,中位年齡64歲,無明顯性別差異,多見于遠端結腸和直腸,中位直徑12 mm[17]。內鏡下巴黎分型多為Ⅰp型的隆起大息肉,偶有扁平型。放大內鏡下工藤分類多為Ⅱ+Ⅲ/Ⅳ型或Ⅱ-L+Ⅲ/Ⅳ型[7]。TSA光鏡下主要表現為裂隙樣鋸齒狀結構和異位隱窩灶,細胞溫和,胞質豐富強嗜酸性、胞核呈柵欄狀排列,無核分裂象,Ki-67陰性。實際工作中需鑒別:(1)SSL中出現小灶上皮嗜酸性變,局限于隱窩淺部,其它區為典型SSL形態學,這可能是反應性改變[15]。(2)SSL伴鋸齒狀異型增生與扁平型TSA的鑒別,后者細胞溫和且形態一致,若后者也伴鋸齒狀異型增生時,還能見到裂隙樣鋸齒狀結構或異位隱窩灶,部分鑒別困難的病例歸入未分類的鋸齒狀腺瘤。(3)部分扁平型TSA起源于SSL[18],需分別報告。
4 結直腸廣基鋸齒狀病變分子病理學進展
從正常腸黏膜到SSL再到SSLD,最終發展為鋸齒狀腺癌的過程被稱為鋸齒狀通路,有別于染色體不穩定性通路和微衛星不穩定性通路。鋸齒狀通路早期事件主要表現為BRAF突變和CpG島甲基化表型(CpG island methylator phenotype, CIMP),Cappellesso等[19]采用微切割方法檢測同一病例緊鄰的SSL和黏膜下浸潤癌中11個結直腸癌相關基因164個熱點區域突變譜,兩者具有大致相同的分子學改變,即BRAF V600E突變和CIMP陽性。依據CpG島甲基化基因不同分為MLH1甲基化的微衛星不穩定性通路和非MLH1甲基化的微衛星穩定性通路。上述兩個通路前期涉及的分子改變不同,有研究示前者出現MLH1甲基化和FBXW7突變,后者出現TP53突變,甲基化基因尚不明確,后期都可出現Wnt通路激活,表現出β-catenin異常核表達[20]。
SSL中82%為BRAF V600E突變,BRAF非V600E突變約1.2%,另外KRAS突變約10.3%,NRAS突變約0.4%[21]。60%BRAF V600E突變合并高CIMP2(NEUROG1、CACNA1G、IGF2、RUNX3、SOCS1),16%KRAS突變合并高CIMP2[21]。SSL中高CIMP、低CIMP和陰性CIMP所占比例分別為25%、55%和20%,CRAB1、NEUROG1和CDKN2A為早期甲基化標志物,CACNA1G、IGF2和RUNX3為中期甲基化標志物,而SOCS1和MLH1為晚期甲基化標志物[22]。高CIMP和(或)MLH1甲基化主要見于50歲以上、近端結腸、直徑>5 mm的SSL[22]。BRAF突變/高CIMP的SSL與工藤分類Ⅱ-O型密切相關,而且Ⅱ-O型SSL可進展為BRAF突變/高CIMP/微衛星不穩定性癌[7]。另外SSL的MLH1啟動子PMR值(percentage of methylated reference)明顯低于SSLD[22],SSL隨MLH1甲基化程度增高而進展,表現在免疫組化上SSL保留或部分保留MLH1表達而SSLD完全丟失MLH1表達。
相比SSL,Wnt通路基因突變更常見于SSLD。SSLD中見到50%RNF43、9%APC和7%ZNRF3蛋白截短突變,而SSL只見7%RNF43突變[23]。SSLD中91%Wnt通路靶基因MYC過表達,SSL中為9%,SSLD中76%β-catenin核異常表達,SSL中為11%[23]。另外保留MLH1表達和丟失MLH1表達的SSLD中Wnt通路基因突變譜系不同,前者86%為RNF43單核苷酸重復序列框移突變,后者RNF43突變和APC突變為34%、13%[23]。
5 結直腸廣基鋸齒狀病變臨床處理
目前SSL治療主要是內鏡下完整切除,根據病變外形及大小選擇冷/熱圈套息肉切除、內鏡黏膜切除術或內鏡黏膜下剝離術等。大的廣基病變或病變邊界不清給完整切除帶來困難,另外闌尾開口和回盲瓣開口病變內鏡下難于切除可能需要手術[24]。內鏡下治療2~6個月[3]后建議內鏡活檢病變切除邊緣確保病變完整切除從而減少間期癌。
2006年Sheridan等[25]在5例SSL中觀察到高級別SSLD和浸潤癌,4例病變直徑≤10 mm,最小的為3 mm。2009年Oono等[26]報道1例未處理的升結腸扁平息肉,8個月后復查時發現黏膜下浸潤癌,并見浸潤癌與管狀腺瘤及SSL三者相移行。因此SSL被認為具有快速惡性轉化潛能。一項大宗回顧性研究顯示SSL與鋸齒狀腺癌中位年齡相差15年,SSL進展時間遠比普通型腺瘤長[6]。2017年Bettington等[13]所做橫向研究顯示SSL中位年齡比SSLD早17年,而SSLD與鋸齒狀腺癌中位年齡相似。上述兩項研究提示快速惡性轉化階段存在于SSLD后而非SSL時,這有待于大樣本縱向研究證實,但縱向研究本身存在延遲SSL臨床處理的倫理問題。關于SSL完整切除后內鏡監測間隔問題各指南建議不一(表1)[12,27],且多數監測間隔指南都屬于低水平證據,有待大樣本隨訪資料提供高質量證據。
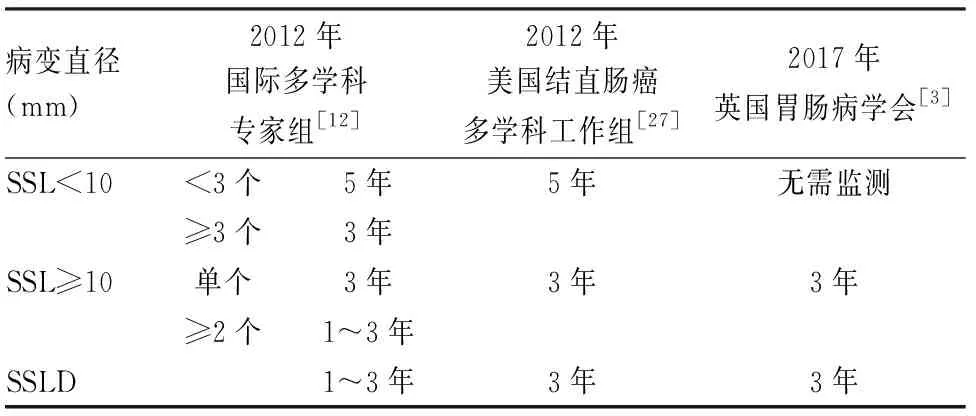
表1 結直腸廣基鋸齒狀病變完整切除后內鏡監測間隔

