肺炎Ⅰ號顆粒對肺炎模型小鼠Th1/Th2細胞因子表達的影響
劉建璇 李會影 于映霞 赫慧 王增玲
【摘要】 目的:探討肺炎Ⅰ號顆粒對肺炎模型小鼠Th1/Th2細胞因子表達的影響,為藥物治療提供理論基礎。方法:選擇60只SPF級BALB/C小鼠,采用隨機數字表法,將其分為空白對照組、模型組、肺炎Ⅰ號高劑量組、肺炎Ⅰ號中劑量組、肺炎Ⅰ號低劑量組,每組12只。連續給藥7 d后,觀察各組小鼠肺組織病理學變化情況,檢測BALF中IL-1β、IL-12、IFN-γ、TNF-α的水平。結果:肺炎Ⅰ號高劑量組、中劑量組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平均明顯低于模型組,差異均有統計學意義(P<0.05);肺炎Ⅰ號低劑量組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平與模型組比較,差異均無統計學意義(P>0.05)。結論:肺炎Ⅰ號顆粒能顯著減少肺炎模型小鼠的肺部炎癥,改善肺組織病理狀態;其作用機制與降低肺炎模型小鼠的Th1/Th2細胞因子IL-1β、IL-12、IFN-γ、TNF-α的表達有關。
【關鍵詞】 肺炎Ⅰ號顆粒 肺炎模型 Th1/Th2
[Abstract] Objective: To investigate the effect of Pneumonia Ⅰ Granules on the expression of Th1/Th2 cytokines in mice with pneumonia, and to provide theoretical basis for drug therapy. Method: A total of 60 SPF BALB/C mice, using the random number table method, they were divided into blank control group, model group, Pneumonia Ⅰ high-dose group, Pneumonia Ⅰ middle-dose group, Pneumonia Ⅰ low-dose group, 12 cases in each group. After 7 d of continuous administration, the changes of lung histopathology were observed and the levels of IL-1β, IL-12, IFN-γ, TNF-α in BALF were measured. Result: The levels of IL-1β, IL-12, IFN-γ, TNF-α in BALF of Pneumonia Ⅰ high-dose group and middle-dose group were significantly lower than those of model group, the differences were statistically significant (P<0.05). The levels of IL-1β, IL-12, IFN-γ, TNF-α in BALF of the Pneumonia Ⅰ low-dose group compared with the model group, the differences were not statistically significant (P>0.05). Conclusion: Pneumonia Ⅰ Granules can significantly reduce pneumonia model mice lung inflammation, improve lung tissue pathology; the mechanism of action is associated with decreased expression of Th1/Th2 cytokines IL-1β, IL-12, IFN-γ, TNF-α in mice with pneumonia model.
[Key words] Pneumonia Ⅰ Granules Pneumonia model Th1/Th2
First-authors address: Jilin Academy of Traditional Chinese Medicine, Changchun 130012, China
doi:10.3969/j.issn.1674-4985.2020.26.006
肺炎患兒機體感染后,可刺激機體的淋巴細胞分泌不同的細胞因子,從而引發機體發生一系列的炎癥反應,表明細胞因子可能在發病過程中發揮著重要作用,是導致機體產生一系列臨床表現及免疫紊亂的重要原因[1]。Th細胞是重要的免疫調節細胞,根據分泌的細胞因子不同,分為Th0、Th1、Th2、Th3四個亞型,對機體的特異性免疫和非特異性免疫均有調節作用。正常情況下,機體的Th1/Th2細胞間處于動態平衡。Th1主要分泌IL-12、IFN-γ、TNF-α等細胞因子,介導細胞免疫;Th2主要分泌IL-1β等細胞因子,介導體液免疫;Th1/Th2的動態平衡一旦被打破,機體便會出現免疫異常的相關疾病,因此,維持此動態平衡及機體自身穩定狀態具有非常重要的意義[2]。為此,本項目通過建立小鼠銅綠假單胞菌肺炎模型,探討肺炎Ⅰ號顆粒對肺炎模型小鼠Th1/Th2細胞因子表達的影響,發掘藥物治療肺炎小鼠可能的作用機制。
1 材料與方法
1.1 實驗動物 2019年1-12月選取SPF級BALB/C小鼠60只,雌雄各半,體重20~22 g,由遼寧長生生物技術股份有限公司提供,許可證號:SCXK(遼)2015-0001。飼養于吉林省中醫藥科學院動物室,動物室為清潔級,室溫:20~25 ℃,相對濕度:40%~60%。通風換氣次數≥14次/h,每周更換一次墊草料,光照良好,采用標準飼料喂養。籠具15 cm×18 cm×30 cm,每籠6只動物(標記組別及每只動物序號)。
1.2 實驗用藥 肺炎Ⅰ號顆粒,是由麻黃、苦杏仁、甘草、石膏、栝樓、黃芩、清夏、葶藶子等十二味中藥組成的復方制劑。實驗用肺炎Ⅰ號干膏粉,本品呈棕褐色,味微苦、澀。每克粉相當于5.81 g生藥,由吉林省中醫藥科學院制劑室提供。配制方法:臨用時將肺炎Ⅰ號顆粒以蒸餾水配成所需濃度,用時搖勻,4 ℃保存。該藥具有清熱開閉、滌痰平喘之功效,用于小兒肺炎急性期,處于邪熱亢盛、正邪相爭階段的治療。
1.3 菌株 銅綠假單胞菌標準菌株CMCC(B)10104,由上海魯微科技有限公司提供。將銅綠假單胞菌菌落混懸于PBS液中,充分震蕩,混勻,應用血細胞計數板調節密度至1×107 cfu/mL。
1.4 主要儀器、試劑 戊巴比妥鈉(生產廠家:國藥集團化學試劑有限公司,規格:25 g/瓶);低速冷凍離心機(安徽中科中佳科學儀器有限公司,型號:KDC-2046);酶標儀(上海科華實驗系統有限公司,型號:ST-360);細胞因子試劑盒(IL-1β、IL-12、IFN-γ、TNF-α)由美國RD公司提供。
1.5 實驗方法
1.5.1 分組及造模 實驗前小鼠適應性飼養3 d,正常進食,自由飲水。采用隨機數字表法,將60只BALB/C小鼠按體重分為5組,空白對照組、模型組、肺炎Ⅰ號高劑量組、肺炎Ⅰ號中劑量組、肺炎Ⅰ號低劑量組,每組12只。各組小鼠造模前稱量體重,對照組小鼠腹腔注射生理鹽水,經鼻孔滴入生理鹽水;其余各組小鼠均腹腔注射戊巴比妥鈉(40 mg/kg)麻醉,小鼠麻醉后,將小鼠頭后仰,經鼻孔滴入銅綠假單胞菌液,使菌液流入呼吸道,滴入的同時注意觀察小鼠的呼吸情況和鼻尖及耳廓的顏色,若出現窒息情況立即給予牽拉前肢、擠壓心臟處理。模型評價標準:(1)觀察小鼠的精神、毛色等一般狀態,是否存在呼吸困難、皮膚發紺等狀況;(2)計算肺炎模型標本中每克肺組織的含菌量,一般認為一個標本中含菌量>1×103 cfu/g為菌液接種成功;(3)小鼠肺組織病理學觀察:肺組織標本中毛細血管和肺泡周圍存在大量淋巴細胞、中性粒細胞、巨噬細胞等炎性細胞的浸潤;支氣管肺泡周圍存在水腫、充血;伴有纖維素樣滲出;支氣管肺泡有萎縮、塌陷、壞死灶等情況的出現[3]。
1.5.2 給藥 造模成功后,空白對照組和模型組分別給予生理鹽水灌胃,肺炎Ⅰ號高、中、低劑量組分別按劑量給予肺炎Ⅰ號顆粒灌胃,肺炎Ⅰ號顆粒的臨床等效劑量為37.92 g生藥/kg,本次實驗涉及的高、中、低劑量組分別為75.84 g生藥/kg,37.92 g生藥/kg,18.96 g生藥/kg。各組小鼠均連續給藥7 d,用藥期間每天觀察各組小鼠表現,如小鼠存活、進食、飲水、活動度、精神狀態差,有無豎毛寒戰、咳嗽,口鼻分泌物有無增多。給藥結束后,小鼠采用腹腔注射戊巴比妥鈉(40 mg/kg)麻醉,麻醉后固定于解剖板。75%酒精消毒后,剖胸腔,從右心室插至肺動脈,生理鹽水快速沖洗干凈后,4%的甲醛溶液注入進行內固定,待小鼠全身僵硬固定后取肺上葉,放入4%的甲醛溶液外固定24 h以上,然后采用酶聯免疫吸附測定(ELISA)法檢測BALF中IL-1β、IL-12、IFN-γ、TNF-α等細胞因子的水平,操作步驟嚴格按照試劑盒說明書進行。
1.6 統計學處理 采用SPSS 18.0軟件對所得數據進行統計分析,計量資料用(x±s)表示,比較采用t檢驗;計數資料以率(%)表示,比較采用字2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 各組小鼠一般資料比較 空白對照組,雌6只,雄6只,平均體重(20.7±2.3)g;模型組雌6只,雄6只,平均體重(20.9±2.5)g;肺炎Ⅰ號高劑量組雌6只,雄6只,平均體重(20.6±2.1)g;肺炎Ⅰ號中劑量組雌6只,雄6只,平均體重(21.1±2.4)g;肺炎Ⅰ號低劑量組雌6只,雄6只,平均體重(20.9±2.3)g。各組小鼠一般資料比較,差異均無統計學意義(P>0.05),具有可比性。
2.2 各組小鼠一般狀況觀察 銅綠假單胞菌接種后第1天,小鼠的進食、飲水、活動度正常,精神狀態略差。接種第2天開始,小鼠的進食、飲水明顯減少,活動度開始下降,精神狀態差,豎毛寒戰,尤其是口鼻部分泌物明顯增多,頻繁出現張口呼吸、打噴嚏、咳嗽等癥狀。空白對照組小鼠的一般狀況無異常表現。
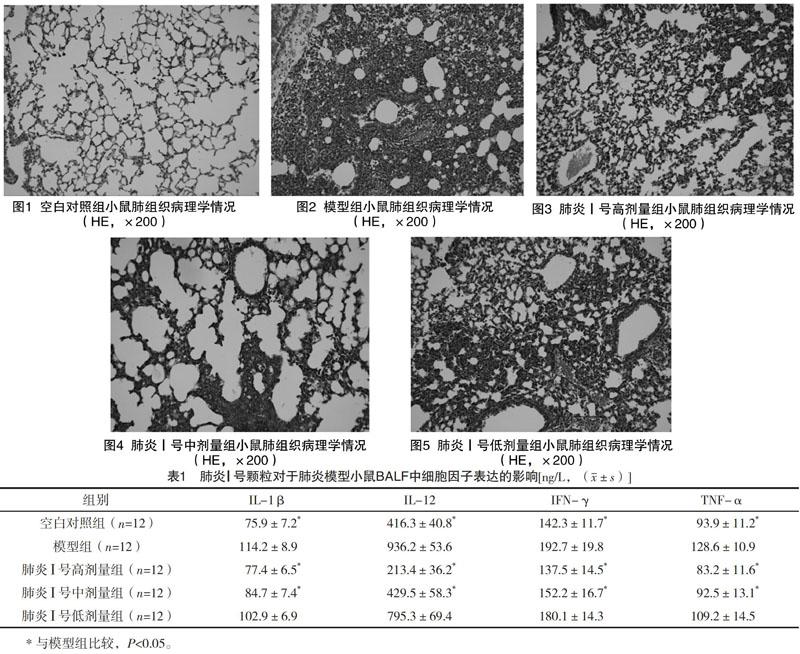
2.3 各組小鼠肺組織病理學變化情況 空白對照組正常小鼠肺組織內解剖位置內未見炎細胞浸潤,氣道通暢,未見炎性滲出,肺泡形態規整,未見肺泡間隔增寬,為正常肺組織,見圖1。銅綠假單胞菌肺炎模型組小鼠,肺組織內可見較大肺膿腫,大量中性粒細胞集中分布在肺內主氣道附近的肺泡與肺間隔內,局部肺泡結構破壞、崩解、出血;部分肺間隔增寬增厚,其內可見炎細胞聚集性浸潤;殘存肺泡擴張融合,形成較小的肺氣腫,符合典型肺炎急性感染期的形態變化,見圖2。肺炎Ⅰ號高劑量組肺炎小鼠肺內炎癥浸潤程度與累計范圍明顯減輕,與模型組比較,肺組織病理狀態改善明顯,見圖3。中劑量組肺內氣道周圍可見輕度炎癥反應,肺泡間隔中度增寬,肺泡中度擴張,未加明顯肺實變與肺膿腫形成,有效減少憤怒炎癥反應,有效保護肺臟對抗細菌攻擊,見圖4。低劑量組肺內氣道旁可見中度炎癥反應,肺泡間隔增寬,可見局部肺泡融合,炎細胞浸潤程度重于高、中劑量組,與模型組比較,炎癥程度與受累范圍有減輕,可以在一定程度上,控制炎癥的擴散范圍,見圖5。
2.4 肺炎Ⅰ號顆粒對于肺炎模型小鼠BALF中細胞因子表達的影響 模型組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平均明顯高于空白對照組,差異均有統計學意義(P<0.05);肺炎Ⅰ號高劑量組、中劑量組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平均明顯低于模型組,差異均有統計學意義(P<0.05);肺炎Ⅰ號低劑量組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平與模型組比較,差異均無統計學意義(P>0.05)。見表1。
3 討論
小兒肺炎被世界衛生組織列為全球三種重要的兒科疾病之一,我國政府也將其列為兒科重點防治的四種疾病之一[4]。肺炎Ⅰ號顆粒是在祖國傳統醫學理論指導下,經臨床醫院長期應用而確定的經驗方,該方是基于“開”法治療痰熱閉肺型小兒肺炎的全新研究,治療時通過向外、向上宣肺、清肺以祛邪,向內、向下肅降痰熱水濕,以恢復肺的升降出入功能。本項目通過深入研究中醫藥治療小兒肺炎的優勢特色,旨在發掘中醫藥治療小兒肺炎的創新技術方法,為進一步促進中醫藥事業發展貢獻力量[5-6]。
銅綠假單胞菌是全球公認的醫院獲得性感染最常見、最重要的致病菌之一,在呼吸內科住院患者肺部感染病原菌中,革蘭陽性桿菌感染約為47%,銅綠假單胞菌約占15%。呼吸系統感染疾病在臨床上較為常見,但實驗動物通常對于致病菌具有較強的耐受性,為了建立穩定可靠的肺炎模型,關鍵在于選取致病力強而毒性穩定的感染菌株,且造模過程操作熟練,切實保證小鼠肺炎模型的成功率,從而建立與人類肺炎疾病相似的模型[7-12]。
本實驗采用銅綠假單胞菌標準菌株CMCC(B)10104建立小鼠肺炎模型,造模成功率高,模型小鼠肺組織內可見較大肺膿腫,局部肺泡結構破壞、崩解、出血;部分肺間隔增寬增厚,其內可見炎細胞聚集性浸潤;殘存肺泡擴張融合,形成較小的肺氣腫,符合典型肺炎急性感染期的形態變化[13-20]。通過采用ELISA法檢測BALF中IL-1β、IL-12、IFN-γ、TNF-α水平發現,模型組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平均明顯高于空白對照組,差異均有統計學意義(P<0.05);肺炎Ⅰ號高劑量組、中劑量組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平均明顯低于模型組,差異均有統計學意義(P<0.05);肺炎Ⅰ號低劑量組小鼠BALF中IL-1β、IL-12、IFN-γ、TNF-α水平與模型組比較,差異均無統計學意義(P>0.05)。
綜上所述,肺炎Ⅰ號顆粒能顯著減少肺炎模型小鼠的肺部炎癥,改善肺組織病理狀態;其作用機制與降低肺炎模型小鼠的Th1/Th2細胞因子IL-1β、IL-12、IFN-γ、TNF-α的表達有關。
參考文獻
[1] Li Z,Clemens D L,Lee B Y,et al.Mesoporous silica nanoparticles with pH-sensitive nanovalves for delivery of moxifloxacin provide improved treatment of lethal pneumonic tularemia[J].ACS Nano,2015,9(11):10778-10789.
[2]馬菲菲,車向前,林育紅.銅綠假單胞菌肺部感染小鼠模型中IL-17A的表達研究[J].中國微生態學雜志,2014,26(12):1396-1397,1404.
[3] Merchabt Z,Buckton G,Taylor K M,et al.A newera of pulmonary delivery of nano-antimicrobial therapeutics to treat chronic pulmonary infections[J].Curr Pharm Design,2016,22(17):2577-2598.
[4]徐輝,何曉靜,李曉冰,等.銅綠假單胞菌慢性肺部感染合并免疫低下大鼠模型的建立[J].中國醫院藥學雜志,2017,37(24):2428-2431.
[5] Nicolls M R,Haskins K,Flores S C.Oxidant stress, immune dysregulation, and vascular function in type Ⅰ diabetes[J].Antioxid Redox Signal,2012,9(7):879-889.
[6]丁鳳鳴,陳宇清,廖若敏,等.SOCS3過表達對銅綠假單胞菌慢性肺部感染小鼠Th17免疫反應的影響[J].免疫學雜志,2017,33(5):389-393,399.
[7] Yoshimura A,Suzuki M,Sakaguchi R,et al.SOCS,inflammation,and autoimmunity[J].Front Immunol,2012,3:20.
[8]楊青梅,張蘋,沈策.銅綠假單胞菌慢性肺部感染模型的建立及評價[J].中國呼吸與危重監護雜志,2008,7(1):40-42,56,80.
[9]李春江,孫蕾,張敬凱,等.銅綠假單胞菌醫院感染分布及耐藥性分析[J].中國微生態學雜志,2009,21(6):540-542.
[10] Izzard A S,Rizzoni D,Agabiti-Rosei E,et al.Small artery structure and hypertension: adaptive changes and target organ damage[J].J Hypertens,2011,23(2):247-250.
[11]宋方,呂歡,何曉靜,等.大鼠銅綠假單胞菌慢性肺部感染模型的建立與評價[J].中國醫院藥學雜志,2015,35(9):786-789.
[12]董培紅,李驥,張慧芳,等.銅綠假單胞菌的臨床分布和耐藥性變遷[J].中國微生態學雜志,2007,19(5):452-454.
[13]譚中富,楊明.炎琥寧注射液輔助治療難治性肺炎支原體肺炎患兒的臨床療效及其對免疫功能、細胞因子的影響研究[J].實用心腦肺血管病雜志,2017,25(7):48-52.
[14]陳柱榮.兒童支原體肺炎診斷及治療的研究進展[J].中外醫學研究,2014,10(9):162-164.
[15]楊新利,陳麗萍,李霞,等.痰熱清注射液佐治小兒肺炎支原體肺炎對輔助T細胞及其細胞因子的影響[J].兒科藥學雜志,2015,21(7):33-36.
[16]施弦,郁峰,黃秋玲.支原體肺炎患兒的臨床特點分析[J].中華醫院感染學雜志,2014,13(1):206-207.
[17]李曉丹,程燕,陳慧.小兒肺炎支原體肺炎的細胞免疫功能研究進展[J].現代中西醫結合雜志,2010,19(17):2202-2203.
[18]陳廣道,梁少媛,馮柏潮.兒童支原體肺炎的臨床表現和實驗室檢查及影像學特點分析[J].中國全科醫學,2015,8(1):59-64.
[19]王有鵬,景偉超,譚杰軍.兒童支原體肺炎IFN-γ、IL-4水平中西醫研究現狀[J].中醫藥學報,2014,16(4):133-135.
[20]王樹堅.血清Th1/Th2細胞因子檢測對兒童支原體肺炎的應用分析[J].中國社區醫師,2016,32(33):142-143.
(收稿日期:2020-03-04) (本文編輯:張爽)

