全國卷化學有機實驗綜合題的命題特點和復習指導
福建 陳女婷 新疆 張新芹
一、有機制備實驗綜合題的考查角度和命題特點
1.考查角度
筆者分析近幾年全國卷高考有機實驗綜合題的考查情況結果詳見表1,發現2012~2014年連續3年考查以有機物制備為載體的實驗綜合題。但是由于有機制備實驗的基本裝置、基本操作、實驗步驟等都比較相似,命題模式和考查方式也相對比較固定,因此,有機制備實驗綜合題已經許久沒有出現在全國卷中。2019年全國卷Ⅱ和卷Ⅲ繼續出現了對有機制備綜合實驗題的重點考查。
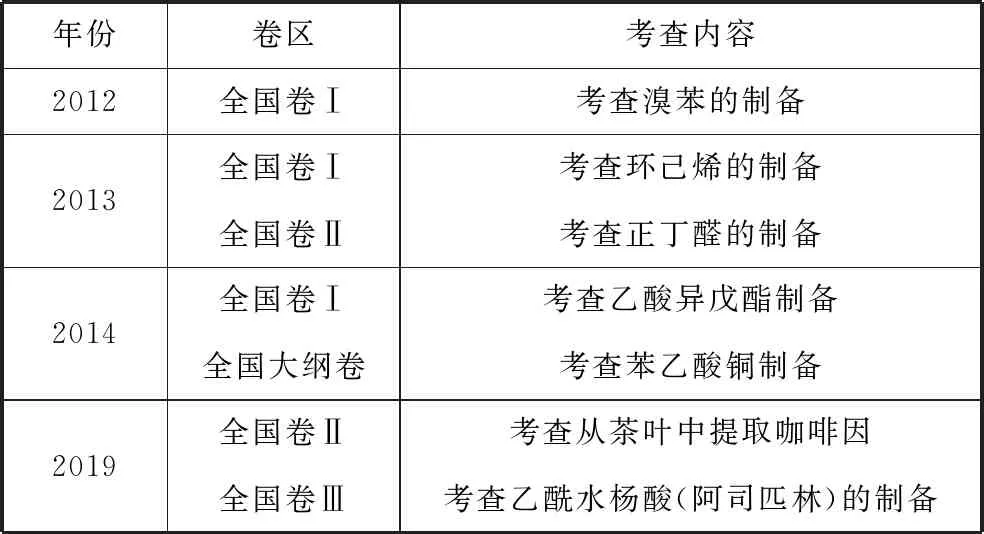
表1 近幾年全國卷有機實驗綜合題的考查情況
2.命題特點
有機制備實驗綜合題常以大學有機化學或中學化學實驗中陌生有機物的制備為命題載體,命題形式上緊扣有機物的制備流程:制備合成→分離提純→獲得目標產物。命題落腳點主要集中在實驗儀器和裝置名稱或作用、合成條件的分析與控制、實驗關鍵步驟的操作、粗產物的分離與提純、合成有機物產率的計算等方面。
二、有機制備綜合實驗典型例題分析
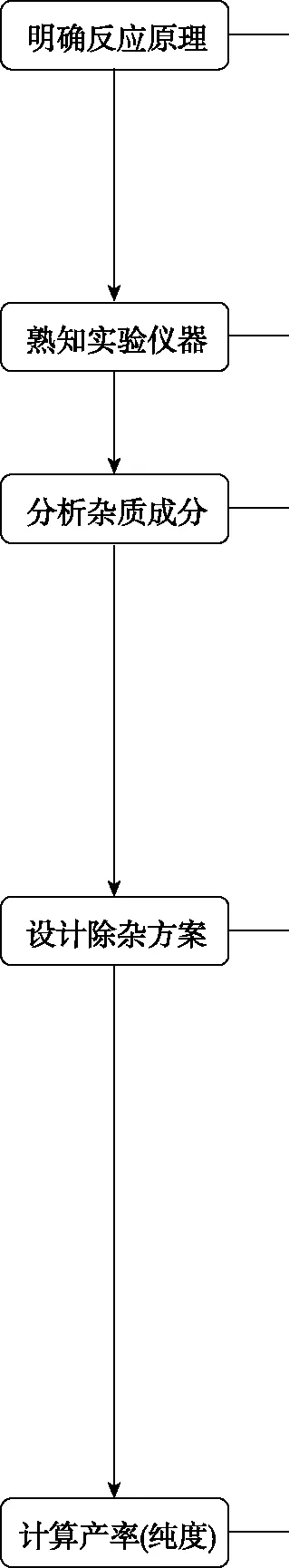
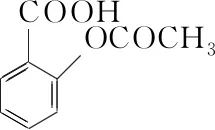
【例1】(2019·全國卷Ⅲ·27)乙酰水楊酸(阿司匹林)是目前常用藥物之一。實驗室通過水楊酸進行乙酰化制備阿司匹林的一種方法如下:
水楊酸 醋酸酐 乙酰水楊酸
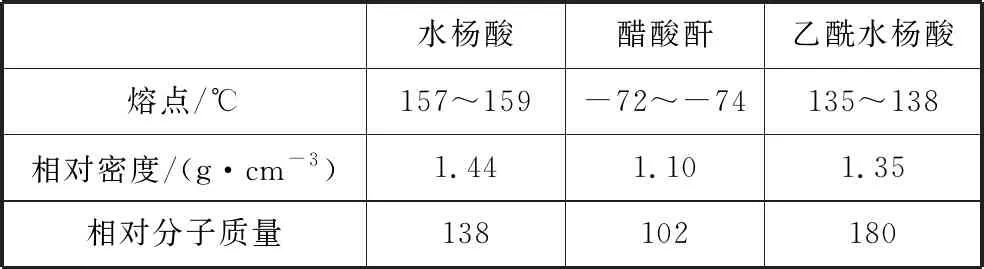
水楊酸醋酸酐乙酰水楊酸熔點/℃157~159-72~-74135~138相對密度/(g·cm-3)1.441.101.35相對分子質量138102180
實驗過程:在100 mL錐形瓶中加入水楊酸6.9 g及醋酸酐10 mL,充分搖動使固體完全溶解。緩慢滴加0.5 mL濃硫酸后加熱,維持瓶內溫度在70℃左右,充分反應。稍冷后進行如下操作:
①在不斷攪拌下將反應后的混合物倒入100 mL冷水中,析出固體,過濾。
②所得結晶粗品加入50 mL飽和碳酸氫鈉溶液,溶解、過濾。
③濾液用濃鹽酸酸化后冷卻、過濾得固體。
④固體經純化得白色的乙酰水楊酸晶體5.4 g。
回答下列問題:
(1)該合成反應中應采用________(填標號)加熱。
A.熱水浴 B.酒精燈 C.煤氣燈 D.電爐
(2)下列玻璃儀器中,①中需使用的有________(填標號),不需使用的________(填名稱)。
B
D
(3)①中需使用冷水,目的是______________。
(4)②中飽和碳酸氫鈉的作用是______________,
以便過濾除去難溶雜質。
(5)④采用的純化方法為________。
(6)本實驗的產率是________%。
【答案】(1)A
(2)BD 分液漏斗,容量瓶
(3)充分析出乙酰水楊酸固體(結晶)
(4)生成可溶的乙酰水楊酸鈉
(5)重結晶
(6)60
1.命題立意和價值
(1)體現應用性,強化價值導向
乙酰水楊酸(阿司匹林)的提取具有重要的產業化價值。試題以大學教材經典的有機制備實驗“水楊酸進行乙酰化制備阿司匹林”為背景,體現化學學科的應用價值和實驗方法在解決實際問題中的重要作用。乙酰水楊酸(阿司匹林)的制備反應及用途在選修1 《化學與生活》中有所涉及。
(2)體現基礎性,考查必備知識
試題起點較高,以典型有機物的制備“乙酰水楊酸(阿司匹林)的提取”為情境素材,但落點和難度較為適中。命題落腳點主要集中在實驗儀器和裝置的名稱及作用、合成條件的分析與控制、實驗操作的關鍵步驟、粗產物的分離與提純、合成有機物產率的計算等。
(3)體現綜合性,考查關鍵能力
試題以文字形式介紹乙酰水楊酸制備的簡要實驗流程,以表格信息的形式提供水楊酸、醋酸酐和乙酰水楊酸的物理參數,并提供制備乙酰水楊酸的化學反應方程式,考查學生的獲取、加工信息的能力和現場學習能力。要求學生在系統把握“物質制取程序”和“化學實驗體系三要素”(物質體系、儀器體系和操作體系)的基礎上綜合解決有機合成實驗操作的一系列問題。
2.試題考點及解析
(1)本小題考查合成條件的分析與控制,即合成反應采用的加熱方式。反應溫度在70℃左右,低于水的沸點,且需維持溫度不變,故采用熱水浴加熱。
(2)本小題考查實驗儀器的選擇,即①中使用的儀器及儀器的名稱。操作①需用燒杯量取和存放冷水,并進行過濾,故需用到燒杯、漏斗,無需使用分液漏斗、容量瓶。
(3)本小題考查實驗試劑的作用,即①中使用冷水的作用。反應時溫度較高,水楊酸和乙酰水楊酸的熔點分別為157~159℃、135~138℃,使用冷水可降低混合液的溫度并降低有機物的溶解度,有利于乙酰水楊酸固體析出。
(4)本小題考查實驗試劑的作用,即②中飽和NaHCO3溶液的作用。乙酰水楊酸難溶于水,為除去其中的雜質,可將生成的乙酰水楊酸與NaHCO3溶液反應生成可溶性乙酰水楊酸鈉。
(5)本小題考查分離與提純的方法,即④中采用的提純方法。每次結晶過程中會有少量雜質一起析出,可通過重結晶的方法進行純化。
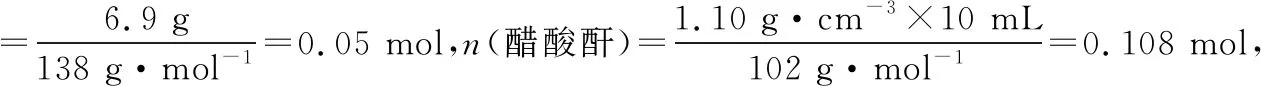
3.解題思維流程
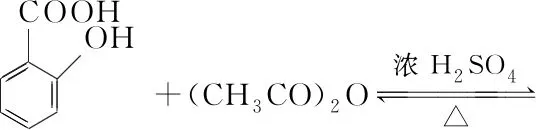
水楊酸 醋酸酐
乙酰水楊酸
合成反應(錐形瓶、水浴裝置)、過濾(燒杯、漏斗、玻璃棒)
該制備反應為可逆反應,故生成的乙酰水楊酸、乙酸中會混有水楊酸、醋酸酐、硫酸等雜質
信息:熔點(乙酰水楊酸>100℃、水楊酸>100℃、醋酸酐<0℃)和溶解性(乙酸、硫酸易溶于水)
除雜方案:水洗(冷水可除去乙酸、硫酸、醋酸酐,析出固體水楊酸和乙酰水楊酸)→鹽洗(飽和NaHCO3將水楊酸、乙酰水楊酸分別轉化成可溶性水楊酸鈉、乙酰水楊酸鈉,混有NaHCO3)→鹽酸(生成乙酰水楊酸固體、水楊酸固體,混有NaCl、HCl)→過濾(得到乙酰水楊酸固體、水楊酸固體)→重結晶(得到乙酰水楊酸固體)
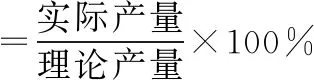
4.制備實驗模型
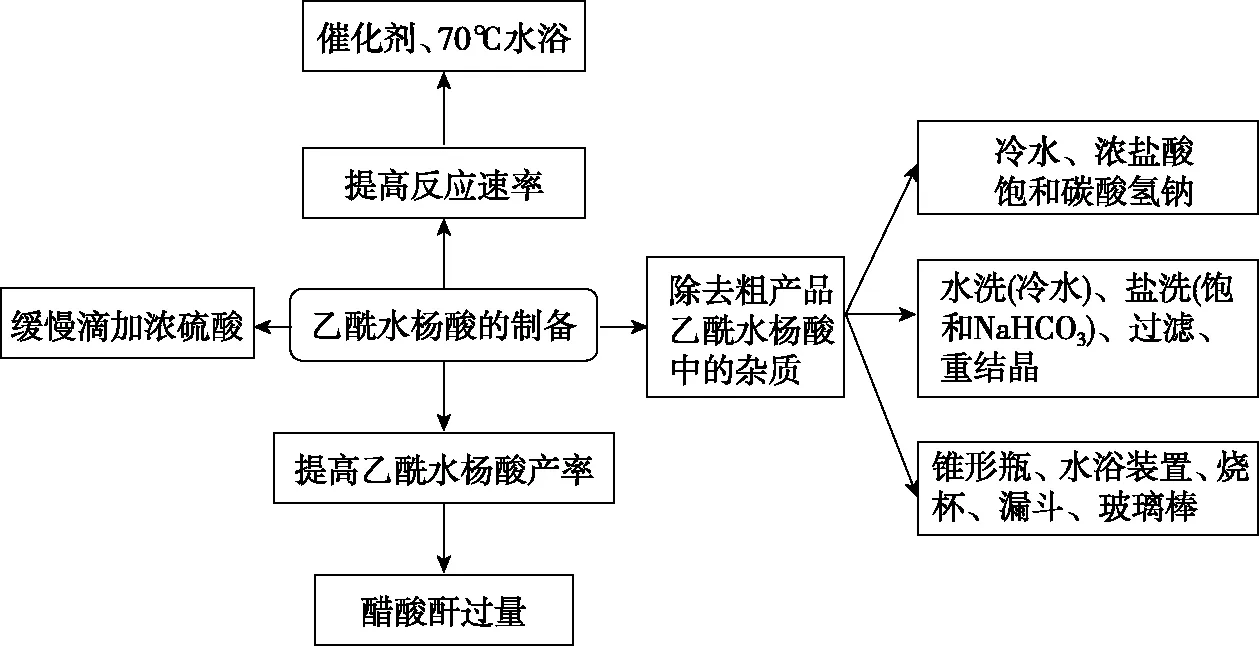
三、解答有機制備實驗綜合的思維流程
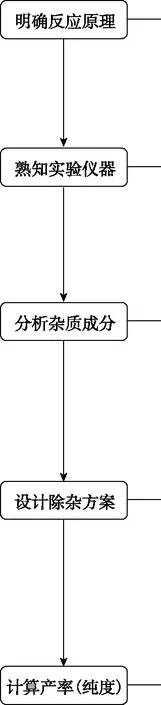
認真審題和解讀題給信息,依據實驗要求確定有機物制備的反應原理;分析反應特點(如可逆反應等)及可能發生的副反應
選擇合適的實驗儀器和裝置,達到控制反應條件的目的;通過分析裝置的特點及物質的制備原理,確定每個裝置的作用
依據有機物的制備原理,確定反應物、生成物的成分,并推測可能發生的副反應,利用題目提供的各物質的溶解性、密度等信息判斷產品中可能混有的雜質
依據產品和雜質的性質差異(如溶解度、熔沸點、密度、物質狀態等)選擇合適的分離提純方法,常見的除雜步驟的大體順序為水洗→(酸/堿/鹽)洗→水洗→干燥→蒸餾

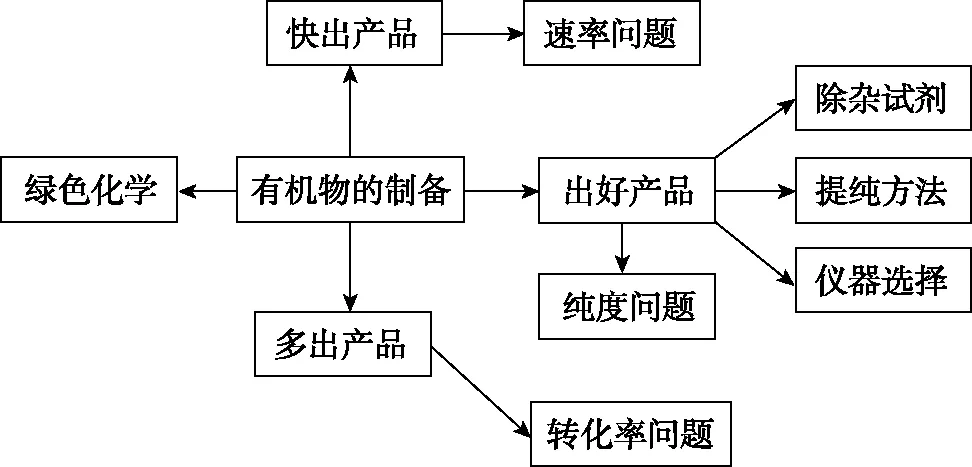
四、有機制備實驗解題模型的建構
五、有機物制備實驗綜合題的變式練習
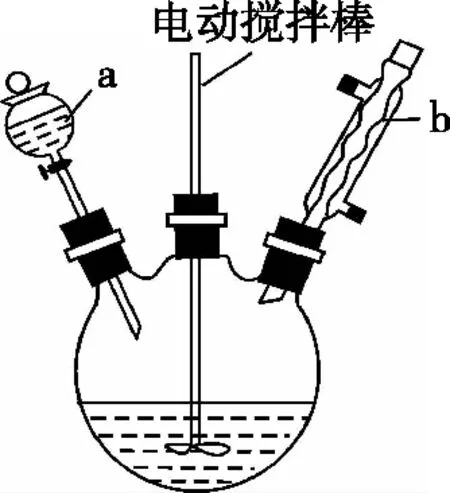
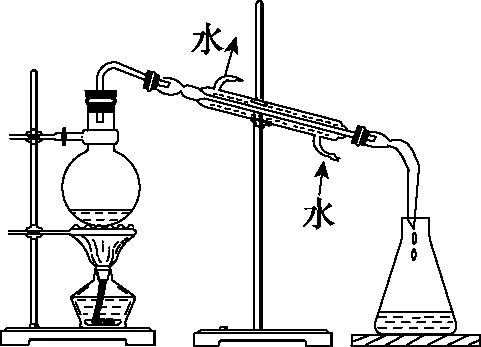
苯甲醛是一種重要的化工原料,某小組同學利用如圖所示實驗裝置(夾持裝置已略去)制備苯甲醛。
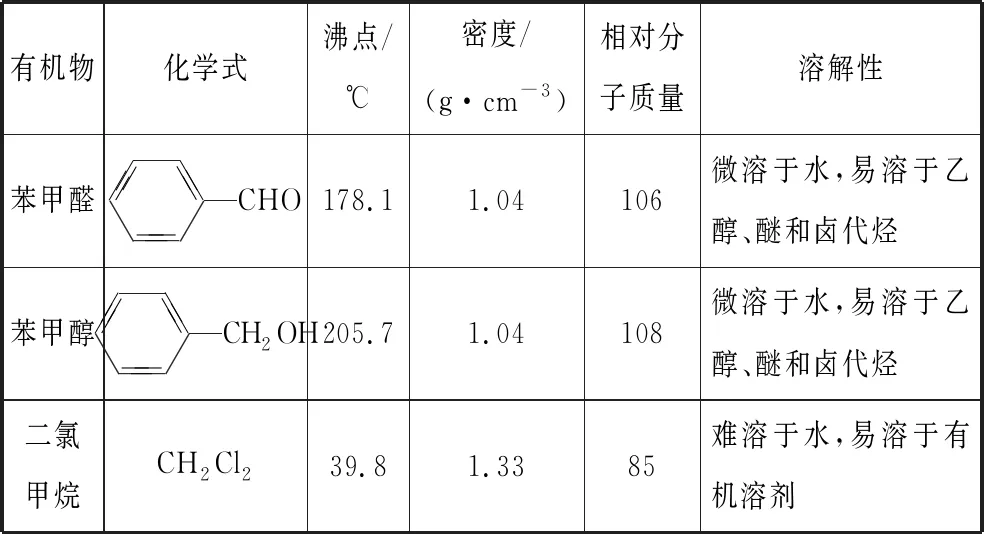
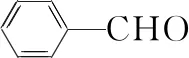
有機物化學式沸點/℃密度/(g·cm-3)相對分子質量溶解性苯甲醛CHO178.11.04106微溶于水,易溶于乙醇、醚和鹵代烴苯甲醇CH2OH205.71.04108微溶于水,易溶于乙醇、醚和鹵代烴二氯甲烷CH2Cl239.81.3385難溶于水,易溶于有機溶劑
實驗步驟:
①向容積為500 mL的三頸燒瓶中加入90.0 mL質量分數為5%的NaClO溶液(稍過量),調節溶液的pH為9~10后,加入3.0 mL苯甲醇、75.0 mL二氯甲烷,不斷攪拌。
②充分反應后,用二氯甲烷萃取水相3次,并將有機相合并。
③向所得有機相中加入無水硫酸鎂,過濾,得到有機混合物。
④蒸餾有機混合物,得到2.08 g苯甲醛產品。
請回答下列問題:
(1)儀器b的名稱為__________,電動攪拌棒的作用是
______________。
(2)苯甲醇與NaClO反應的化學方程式為________________________。
(3)步驟①中,投料時,NaClO不能過量太多,原因是
______________;步驟③中加入
無水硫酸鎂的目的是______________。
(4)步驟②中,應選用的實驗裝置是________(填字母代號),該操作中分離出有機相的具體操作方法是______________________。
A
B
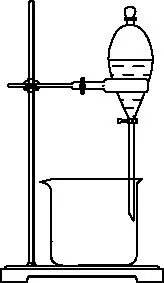
C
D
(5)步驟④中,加熱蒸餾時應收集________左右的餾分。
(6)本實驗中,苯甲醛的產率為________(保留到小數點后一位)。
【答案】(1)球形冷凝管 使物質充分混合,反應更充分
(3)防止苯甲醛被氧化為苯甲酸,使產品的純度降低 除去少量的水(干燥),提高產品純度
(4)C 打開分液漏斗頸部的玻璃塞(或使玻璃塞上的凹槽對準分液漏斗上的小孔),再打開分液漏斗下面的活塞,使下層液體慢慢沿燒杯內壁流下,當有機層恰好全部放出時,迅速關閉活塞
(5)178.1℃
(6)67.9%
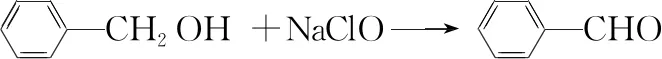
【解題思維流程】
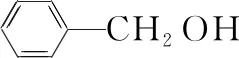
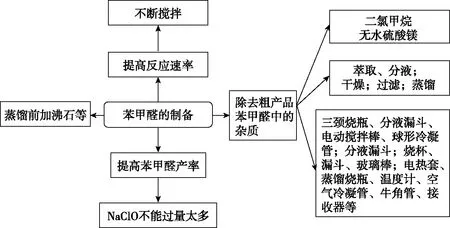
三頸燒瓶(分液漏斗、電動攪拌棒、球形冷凝管)、分液(分液漏斗)、過濾(燒杯、漏斗、玻璃棒)、蒸餾裝置(電熱套、蒸餾燒瓶、溫度計、空氣冷凝管、牛角管、接收器)
生成的苯甲醛、NaCl會混有未反應完全的苯甲醇、NaClO;同時,若NaClO過量太多則苯甲醛會進一步被氧化成苯甲酸
題干信息:二氯甲烷易溶于苯甲醛、苯甲醇,難溶于水
除雜方案:萃取、分液(二氯甲烷萃取水相,分液后有機相為苯甲醛、苯甲醇、苯甲酸、二氯甲烷和少量水)→干燥(無水硫酸鎂,除去有機物中的少量水)→過濾(除硫酸鎂固體,得苯甲醛、苯甲醇、苯甲酸、二氯甲烷的混合物)→蒸餾(收集178.1℃左右餾分,得到苯甲醛)
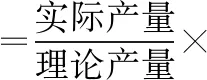
【制備實驗模型】
六、有機物制備實驗綜合題的考查趨勢預測


