尋規律 攻克電化學選擇題
四川 王夢林
化學與能量關系緊密,以化學能與電能相互轉化為依據的電化學知識是高考的高頻考點。在全國卷中近幾年已經屬于高頻考題,分值較大,學生在學習這部分知識時也感覺有一定難度,因此如何幫助學生在高考中得到電化學部分的分數是我們應該思考的問題。
一、近三年全國卷統計
我們先統計近三年全國卷電化學選擇題的考查頻率,再總結不同情境下電化學題目的相同考點。考頻、考點統計表如下:

電極判斷離子、電子移動方向電極方程式的書寫或物質判斷電化學計算其他2019·全國卷Ⅰ·12DB、C反應條件的比較2019·全國卷Ⅲ·13DB、C海綿狀Zn2018·全國卷Ⅰ·13CA、B鹽類水解2018·全國卷Ⅱ·12AB、C、D2018·全國卷Ⅲ·11AB、CD2017·全國卷Ⅱ·11A、BDC2017·全國卷Ⅲ·11A、DB石墨烯導電性總考查選項數46131
由統計表可直觀看出,電極反應式的書寫或物質判斷考查頻率最高,其后依次為離子和電子的移動方向、電極判斷和電化學計算。這些考點的來源也正是應對電化學題目的一般分析步驟:

考頻與試題難度及要求有關,電極判斷、離子和電子的移動方向相對較簡單,規律性強,學生容易掌握,故考頻相對較低;電極方程式的書寫是學生普遍覺得困難的考點,對學生能力要求也較高,有很好的區分度,故考查頻率很高;化學計算在工藝流程、化學反應原理、物質結構與性質部分都有涉及,所以電化學部分的選擇題對計算的考查就弱化了很多。
二、真題剖析
【例1】(2019·全國卷Ⅰ·12)利用生物燃料電池原理研究室溫下氨的合成,電池工作時MV2+/MV+在電極與酶之間傳遞電子,示意圖如圖所示。下列說法錯誤的是
( )
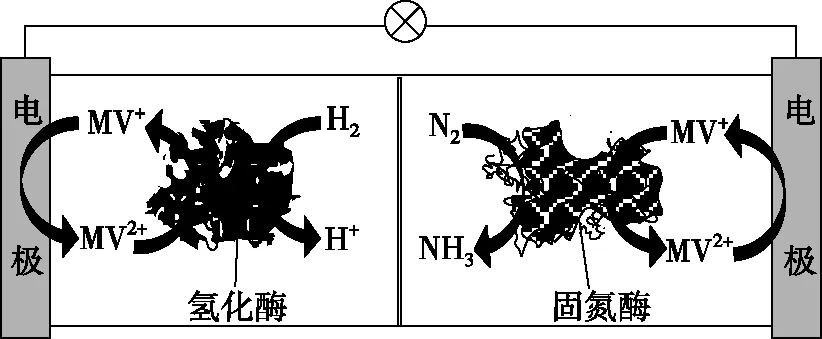
A.相比現有工業合成氨,該方法條件溫和,同時還可提供電能

C.正極區,固氮酶為催化劑,N2發生還原反應生成NH3
D.電池工作時質子通過交換膜由負極區向正極區移動
【答案】B
【分析】(1)電極判斷:此題判斷電池電極的依據為發生反應的類型,生物燃料左室電極發生的反應為MV+失電子發生氧化反應生成MV2+,故左室為燃料電池的負極;右室電極MV2+得電子發生還原反應生成MV+,故右室為燃料電池的正極。
(2)電池中電子和離子的移動方向:電子從負極流出經外電路流入正極,原電池內部陽離子移向正極,陰離子移向負極。


【小結】此題通過反應類型可判斷電池的正負極,電極方程式相對較容易寫出,質子的移動方向也容易判斷,此題較為常規,難度不大,考點也都是較為常見的考點。
【例2】(2018·全國卷Ⅲ·11)一種可充電鋰-空氣電池如圖所示。當電池放電時,O2與Li+在多孔碳材料電極處生成Li2O2-x(x=0或1)。下列說法正確的是
( )
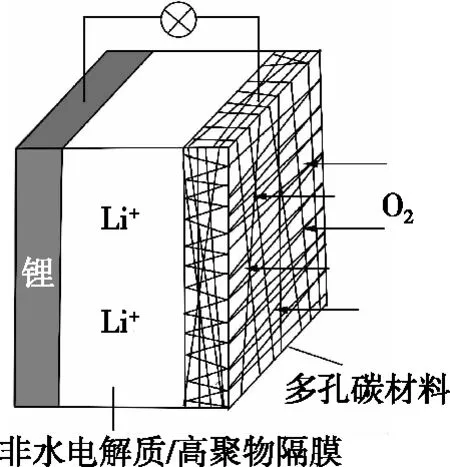
A.放電時,多孔碳材料電極為負極
B.放電時,外電路電子由多孔碳材料電極流向鋰電極
C.充電時,電解質溶液中Li+向多孔碳材料區遷移
【答案】D
【分析】(1)電極判斷:由題干信息“O2與Li+在多孔碳材料電極處生成Li2O2-x(x=0或1)”可知,O2得到電子,故多孔碳材料電極為正極;同時可得出信息Li+移向多孔碳電極,也可判斷其為正極。
(2)電子和離子的移動方向:放電時電子從負極流出經外電路流入正極,陽離子移向正極,陰離子移向負極;充電時,電子由電源負極流向陰極,再由陽極流向正極,陽離子向陰極移動,陰離子向陽極移動。
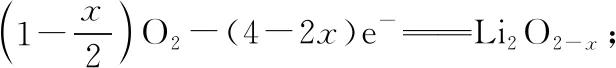
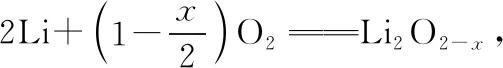
【小結】本題是比較典型的可充電電池問題。對于此類問題,可以直接判斷反應中的氧化劑和還原劑,進而判斷出電池的正負極。由題干信息可知是空氣中的氧氣得電子,所以通入氧氣的電極為正極,單質鋰電極就一定為負極。放電時的電池反應,逆向反應就是充電時的電池反應,放電時的負極充電時應該為陰極,放電時的正極充電時應該為陽極。

( )
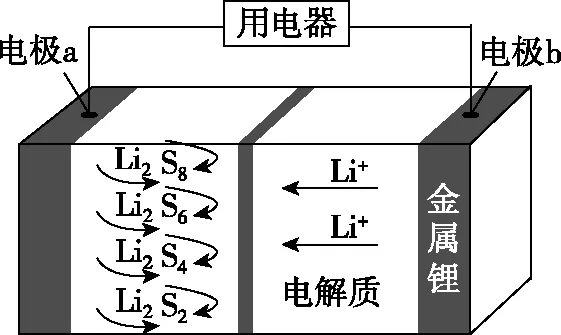

B.電池工作時,外電路中流過0.02 mol電子,負極材料減重0.14 g
C.石墨烯的作用主要是提高電極a的導電性
D.電池充電時間越長,電池中Li2S2的量越多
【答案】D
【分析】(1)電極判斷:根據題干總反應可得Li失去電子、化合價升高、發生氧化反應,即鋰電極為負極;根據裝置圖中Li+移向電極a,則a極為正極,金屬鋰電極為負極。
(2)電子和離子的移動方向:電子由b極流出經用電器流入a極,體系中Li+向正極移動。


【小結】本題考查二次電池的使用,涉及原電池工作原理,原電池工作時負極發生氧化反應,正極發生還原反應;而電池充電時,原來電池的負極連接外接電源的負極為電解池的陰極,發生還原反應,而原來電池的正極連接外接電源的正極為電解池的陽極發生氧化反應,解題時通過結合反應原理,根據元素化合價的變化,判斷放電時正負極發生的反應,再結合電解質書寫電極反應方程式。
三、規律小結
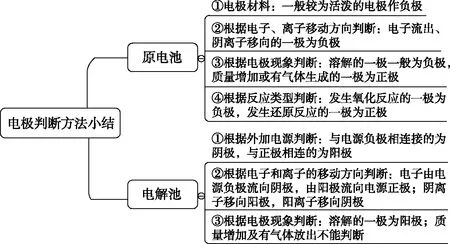
1.電極判斷方法小結(含電子和離子的移動規律)
2.電極方程式的書寫規律
電極方程式的書寫步驟如下:
3.電化學計算技巧
電化學的計算都是建立在電極方程式或總反應式基礎之上,因此寫好電極反應式是計算的關鍵,而針對于電化學部分計算只需要把握住兩點即可:
(1)守恒:正負極、陰陽極和得失電子守恒是計算的橋梁,根據轉移電子的物質的量可以計算出電極反應物的消耗量和生成物的生成量。
(2)狀態:針對于有氣體體積的計算一定要注意標準狀況是否標注。
四、命題預測
作為高考考頻極高的電化學內容在2020年高考中自然不會缺席,而且題目設置一般為圖文結合、以圖片為主要呈現信息的形式,圖文是知識和能力考查的載體,考點不會發生明顯的變化,結合有關信息:“2019年諾貝爾化學獎授予美國科學家約翰·古迪納夫、斯坦利·惠廷厄姆和日本科學家吉野彰,以表彰他們在鋰離子電池研發領域作出的貢獻”,考查鋰電池的可能性極大,因此可積極查閱鋰電池相關材料,提前進行復習,有備無患。

( )
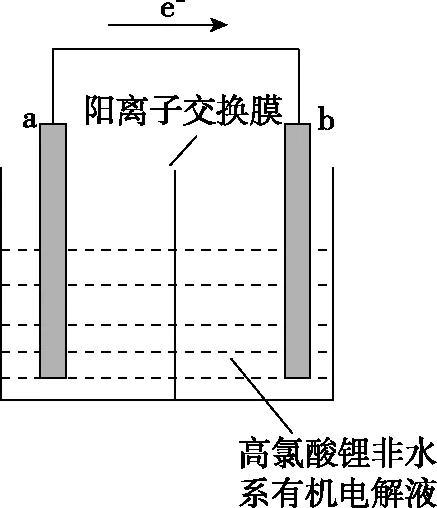
A.電解質可用氯化鋰溶液取代

C.電池放電時,Li+移向b極
D.電路中轉移0.1 mol電子時,b極質量減少0.7 g
【命題意圖】以一次鋰電池為載體考查電化學考點:①電極判斷;②電子和離子移動方向;③電極方程式的書寫;④電化學有關計算。
【答案】C
【分析】
(1)電極判斷:電子由a極流向b極,則a為負極,b為正極。
(2)電子和離子移動方向:電池放電時陽離子移向正極。



