化學鍵考點分析思維模型的構建與應用
廣東 劉漢國
原子結構、元素周期表和元素周期律為高考必考內容,考查的核心素養以宏觀辨識與微觀探析為主。試題往往以原子結構或元素化合物性質為突破口進行元素推斷,然后綜合考查元素周期律、化學鍵、各元素及其化合物的性質等。化學鍵相關考點是歷年高考熱點,多以選擇題和填空題的形式出現,所考查的知識主要包括:化學鍵類型的判斷、化合物類型的判斷、結構式和電子式的書寫及其判斷,該部分題目整體難度不大,主要易錯點在于非極性鍵的判斷和復雜化合物電子式的書寫。
2019年高考題首次出現從化學鍵的角度、以結構式的形式呈現信息來推斷元素的題目,該題目得分率較低,主要原因是學生無法從化學鍵的角度推斷元素。本文通過構建“共價分子或離子結構式書寫思維模型”、“共價分子或離子電子式書寫思維模型”及其“非極性鍵判斷思維模型”,突破考查化學鍵相關考點的難題,以供各位老師在教學時參考借鑒。
一、研究真題,構建模型
【例1】(2019·全國卷Ⅰ·13)科學家合成出了一種新化合物(如圖所示),其中W、X、Y、Z為同一短周期元素,Z核外最外層電子數是X核外電子數的一半。下列敘述正確的是
( )
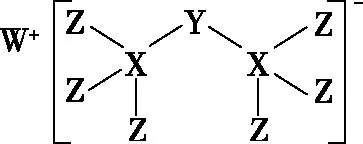
A.WZ的水溶液呈堿性
B.元素非金屬性的順序為X>Y>Z
C.Y的最高價氧化物的水化物是中強酸
D.該新化合物中Y不滿足8電子穩定結構
【答案】C
【評析】很多老師對該題目的解析也是非常模糊,例如解析為:由W、X、Y、Z為同一短周期元素,Z的核外最外層電子數是X核外電子數的一半可知,Z為Cl、X為Si,由化合價代數和為0可知,Y元素化合價為-3價,則Y為P元素;由W的電荷數可知,W為Na元素。這種解析不但無法得到學生的信服,更沒有形成解題模式。想要清晰、快速地解決此題目,關鍵是把結構式的書寫規則搞清楚。
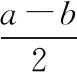

表1 常見原子需要滿足的價鍵數
【解析】根據離子結構式書寫思維模型,由離子的結構式可知,該離子需要的電子總數(用a表示)為8×9=72,根據總成鍵數為8,則所有原子的價電子總數(用b表示)為72-8×2-1=55。由離子的結構式可知,Z為1個價鍵,X為4個鍵價,W、X、Y、Z為同一短周期元素,Z的核外最外層電子數是X核外電子數的一半,根據表1常見原子需要滿足的價鍵數目推出,Z為Cl原子、X為Si原子,又根據所有原子的價電子總數(用b表示)為55,從而可以推出Y的最外層電子數為5,則Y為P原子;由W的電荷數可知,W為Na原子。氯化鈉為強酸強堿鹽,水溶液呈中性,故A錯誤;同周期元素從左到右,非金屬性依次增強,則非金屬性的強弱順序為Cl>S>P,故B錯誤;P元素的最高價氧化物對應水化物為磷酸,磷酸是三元中強酸,故C正確;新化合物中P元素化合價為-3價,滿足8電子穩定結構,故D錯誤。
【例2】(2019·海南卷·13節選)自門捷列夫發現元素周期律以來,人類對自然的認識程度逐步加深,元素周期表中的成員數目不斷增加。回答下列問題:
(2)Mc位于元素周期表中第ⅤA族,同族元素N的一種氫化物為NH2NH2,寫出該化合物分子的電子式________________,該分子內存在的共價鍵類型有________。
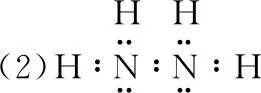
【評析】該題目表面是考查電子式的書寫,實則是對化學鍵的另外一種的考查形式。化合物電子式的書寫是一個易錯點,書寫時常見錯誤有:一是混淆離子化合物與共價化合物的電子式;二是漏寫未參與成鍵的電子對;三是錯寫共價鍵結合的原子順序;四是錯誤合并原子。書寫電子式的難點在于復雜陽離子、復雜陰離子及復雜共價化合物的電子式。那么如何解決該難點呢?我們可以先根據結構式書寫思維模型寫出結構式,然后根據單鍵共用一對電子、雙鍵共用兩對電子、叁建共用三對電子,把共價鍵改為共用電子,最后補滿8e-(H補滿2e-)。化合物電子式書寫思維模型見圖2所示。
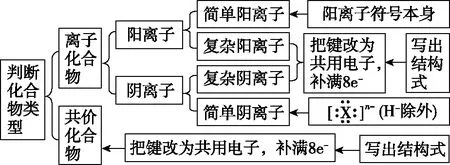
圖2 化合物電子式書寫思維模型
化學鍵類型的判斷難點主要在于非極性鍵的判斷,因為在化合物中不同的非金屬原子之間一定通過極性鍵作用,而相同的非金屬原子之間卻不一定存在非極性鍵。判斷相同的非金屬原子之間是否存在非極性鍵,首先標出該非金屬原子的化合價,找出其最外層電子數,若其化合價的絕對值與其最外層電子數之和小于8,則說明存在非極性鍵,具體的判斷方法見圖3所示。

圖3 非極性鍵判斷思維模型
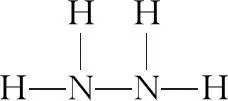
二、預測高考,遷移應用
【例3】(安徽省三人行名校聯盟2020屆高三聯考)2017年南京理工大學合成出如圖的離子化合物,該物質由兩種陽離子和兩種陰離子構成,其中有兩種10電子離子和一種18電子離子。X、Y、Z、M均為短周期元素,且均不在同一族。下列說法不正確的是
( )
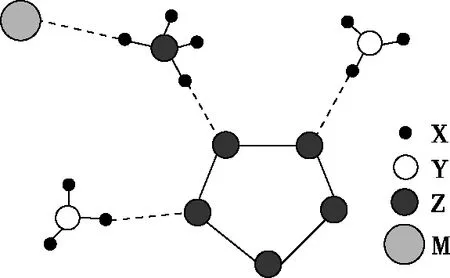
A.X與Y形成的化合物沸點高于Y同族元素與X形成的化合物
B.Z的最高價氧化物對應水化物的酸性比M的強
C.Y氣態氫化物的穩定性比Z的強
D.在該鹽中,存在極性共價鍵和非極性共價鍵
【答案】B
【評析】該題目信息的呈現方式是球棍模型,而結構式是球棍模型的基礎,所以該題的解決可以借助結構式的思維模型進行分析。
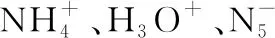
三、備考建議
1.把握方向,落實基礎
從近幾年的高考題中可以發現,題干給出的已知條件不再是單純的原子結構特征,而是添加了元素化合物的性質,并多以此為突破口。2020年高考備考重點關注:(1)利用“位、構、性”關系綜合考查元素及其化合物的性質;(2)元素特征結合化學反應原理的相關內容;(3)通過圖象、球棍模型等形式呈現信息。但是無論以怎樣的形式呈現信息,萬變不離其宗,抓好基礎是解題的關鍵。
2.辨析概念,回避陷阱
化學鍵的相關考點涉及的概念較多,學生對于概念的理解和辨析有一定的困難,這些概念是易錯點,往往又是考查的重點,所以復習時要重視概念的辨析。易錯點主要有:(1)不是所有物質中都有化學鍵,如稀有氣體內部無化學鍵;(2)化學鍵的類型與化合物的類型之間的關系;(3)金屬元素和非金屬元素間可能存在共價鍵,如AlCl3等;(4)氫鍵不是化學鍵。
3.構建模型,突破難點
近年來高考非常重視化學核心素養和思維能力的考查,如何提高學生的解題能力和提升學生的思維水平是復習的核心問題,而構建思維模型是解決該問題的有效途徑。在復習中,要善于對典型試題進行歸納整理,探尋規律,構建模型,從而達到突破難點,培養能力和素養的目的。


