基于網絡藥理學的地榆升白片對白細胞減少癥的作用機制研究△
劉金壘,但文超,2*,何慶勇,許博文,2,曲藝,2
1.中國中醫科學院 廣安門醫院,北京 100053;2.北京中醫藥大學,北京 100029
白細胞減少癥(leukopenia)是指外周血白細胞計數<4×109個/L[1]的一種常見血液病,其發病率可達12.36%[2]。其臨床病因復雜,最常見于腫瘤患者因放療、化療后造血干細胞損傷所致的骨髓抑制狀態[3],進而使自身外周血白細胞數量減少。臨床表現多為乏力、倦怠、精神萎靡不振、發熱、睡眠差、食欲下降,以致腫瘤患者機體抵抗力低下,易感染,甚至導致治療中斷。
目前治療白細胞減少癥的臨床一線藥物如利血生、重組人粒細胞刺激因子等,其升高白細胞療效不穩定,單獨用藥成本高昂,而且常伴隨多種并發癥,存在臨床安全評價不良的弊端[4]。因此白細胞減少癥的治療亟待尋求一種價格相對低廉,療效穩定的藥物。
伴隨著中醫藥現代化進程不斷加速,天然藥物的獨特優勢通過不同劑型得以發揮。地榆升白片治療白細胞減少癥的優勢不斷得以驗證[5-6]。地榆升白片的成分主要為地榆,輔料為蔗糖。基礎研究表明,地榆的主要成分為地榆皂苷、鞣質、大黃酚、胡蘿卜苷、β谷甾醇及兒茶素等[7],而鞣質和皂苷類成分被認為是地榆發揮其升白效果的主要活性成分。目前國內外對其分子活性的研究雖相對深入,但對其在機體內的代謝、轉運方式與途徑等方面研究尚待深入[8]。本研究借助中藥網絡藥理學的方法,系統地分析地榆的有效活性成分和潛在作用靶點,探討其發揮升白作用可能的作用機制,為今后的實驗研究提供借鑒。
1 資料與方法
1.1 地榆活性成分的篩選和靶點預測
檢索中藥系統藥理學數據庫和分析平臺[9](traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)、TCM-MESH數據庫[10]、ETCM數據庫(the encyclopedia of traditional Chinese medicine)[11]以獲取地榆的全部成分,將獲得的成分錄入TCMSP平臺以匹配信息,篩選活性成分條件為口服生物利用度(oral bioavailability,OB)≥30%、類藥性(drug-likeness,DL)≥0.18[12],根據已有文獻整理出地榆升高白細胞的成分并對預測結果進行補充。通過PubChem(https://pubchem. ncbi. nlm.nih.gov/)獲取活性成分sdf分子結構,并在SwissTargetPrediction平臺[13]預測其潛在靶點。
1.2 構建地榆升白片“活性成分-靶點”網絡
地榆“活性成分-靶點”網絡主要通過軟件Cytoscape 3.7.1[14]來構建與分析,其中用“節點”(node)表示成分或靶點,用“邊”(edge)表示兩者之間的關系;采用Cytoscape 3.7.1軟件內置的network analyzer分析工具分析網絡特征參數,包括連接度(degree)、介度(betweenness)及緊密度(closenesss)等,研究地榆中較為重要的成分和靶點及之間的關系。
1.3 白細胞減少癥相關靶點檢索
利用“leukopenia”為關鍵詞,在GeneCards數據庫[15]、OMIM數據庫[16]、DisGenet數據庫[17]、TTD數據[18]、DigSee數據庫[19]、DrugBank數據庫[20]等疾病基因數據庫進行檢索與篩選,將得到的靶點匯總并去除重復值,再根據文獻報道補充未預測到的有效成分的已知靶點,利用Uniprot數據庫將所得靶點標準化。
1.4 蛋白質相互作用(protein protein interaction,PPI)網絡構建及關鍵靶點篩選
通過BisoGenet構建PPI網絡。將地榆活性成分相關靶點與疾病靶點分別導入BisoGenet內,各自生成PPI網絡,通過Cytoscape中的Merge功能提取2個PPI網絡的交集網絡并運用CytoNCA[21]分析交集網絡中各個節點的屬性值。計算連接度的中位數k1并選出連接度大于2倍k1的所有節點,即“Hit hubs”。計算Hit hubs網絡各個節點的屬性,分別得到連接度中心性(degree centrality,DC)、緊密度中心性(closeness centrality,CC)、介度中心性(betweenness centrality,BC)、網絡中心性(network centrality,NC)和局部邊連通性(local average connectivity,LAC)的5個中位數k2、l2、m2、n2、o2,選出節點屬性同時滿足>k2、l2、m2、n2、o2的所有節點作為核心靶點。
1.5 通路富集分析
Metascape平臺(http://metascape.org)[22]可對靶點進行通路富集分析,該平臺整合了GO、KEGG、Uniprot等多個權威的功能數據庫,支持對批量基因或蛋白質進行注釋、富集分析及構建PPI網絡。將潛在作用靶點導入Metascape平臺進行GO及KEGG分析,保存其結果并通過R軟件對結果進行可視化。
2 結果
2.1 地榆活性成分及靶點獲取
從TCMSP數據庫獲取到41個地榆成分,根據OB和DL參數篩選初步獲得13個成分,剔除4個未查詢到靶點的成分,并根據文獻報道補充地榆皂苷Ⅰ與地榆皂苷Ⅱ[23-24],最終獲得11個活性成分。運用TCMSP靶點預測模型對上述11個成分作用靶點加以預測。若TCMSP未納入該成分靶點信息,則登入Pubchem網站下載該成分sdf結構信息,并通過Swiss Prediction網站進行靶點預測,將預測結果補充進上述靶點預測結果中。11個活性成分見圖1和表1。
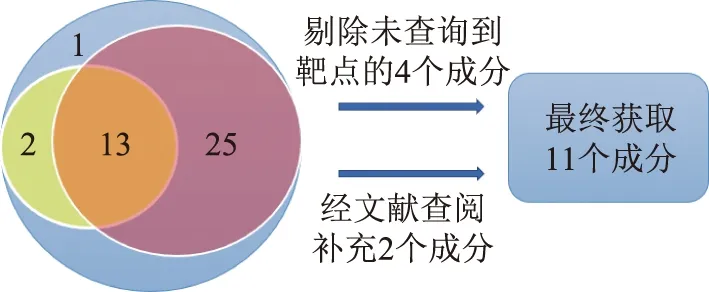
注:藍色圓代表全部41個成分;黃色圓代表OB篩選;紅色圓代表DL篩選。圖1 ADME篩選結果活性成分分布
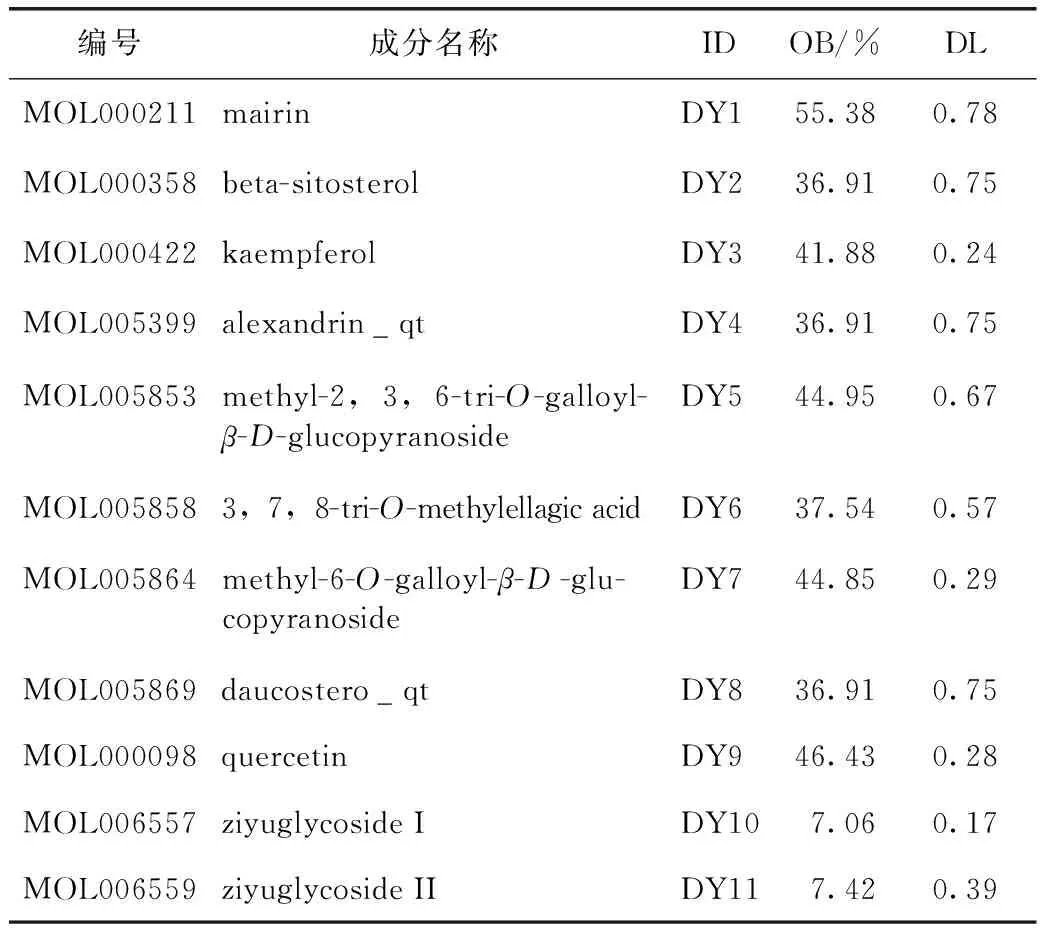
表1 地榆升白片中候選活性成分
2.2 地榆升白片“活性成分-靶點”網絡構建和分析
利用相關靶點預測技術對上述活性成分進行作用靶點預測,排除重復靶點,共獲得預測靶點109個。利用Cytoscape 3.7.1對地榆活性成分及其作用靶點的關系網絡進行繪制和分析,共獲得120個節點(包含109個靶點和11個活性成分)與161條關系,圖中節點的大小代表相應的度值,節點面積越大代表度值越大,表示涉及的生物功能越多,其生物學重要性越高,見圖2。
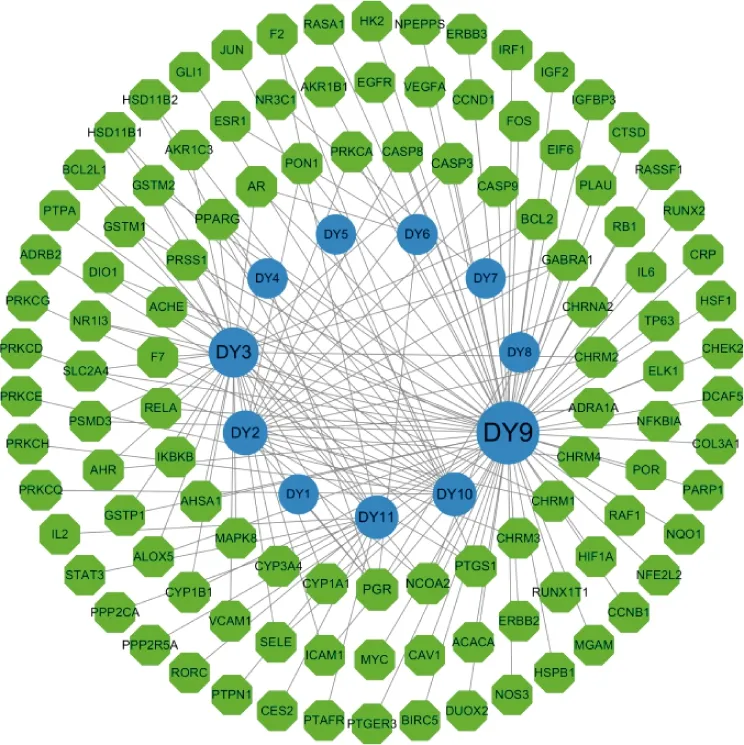
注:圖中綠色代表活性成分作用的靶點;藍色代表11個活性成分。圖2 地榆活性成分-靶點網絡
2.3 白細胞減少癥相關靶點檢索
檢索Genecards、OMIM、Disgenet、TTD、DigSee和DrugBank 6個疾病數據庫,分別得到靶點個數為1112、13、245、0、0和1。將得到的靶點匯總并去除重復靶點,最終得到1204個疾病靶點。
2.4 地榆治療白細胞減少癥的PPI網絡構建與關鍵靶點篩選
2.4.1地榆治療白細胞減少癥的PPI網絡構建 運用Cytoscape 3.7.1中的BisoGenet功能,分別構建地榆和白細胞減少癥的PPI網絡,發現地榆潛在靶點可與5178個靶點產生直接或間接作用,而這些靶點之間的相互關系可達130 414種。與此同時,對白細胞減少癥相關的靶點繪制PPI網絡,顯示與其直接或者間接相關的靶點可達10 818個,這些靶點之間的相互聯系可達224 920種,兩者交集網絡見圖3。
圖3 地榆升白片與白細胞減少癥的PPI網絡交集網絡
2.4.2地榆升白片治療白細胞減少癥關鍵靶點篩選 為獲取PPI網絡中更豐富的節點連接信息以及優化節點信息傳遞效率,充分明確在網絡中發揮重要作用的靶點,本研究計算了上述PPI交集網絡圖的網絡拓撲學特征屬性值。通過2次篩選,共獲得關鍵靶點167個,具體篩選策略見圖4,最終篩選得到的靶點互相作用關系見圖5。
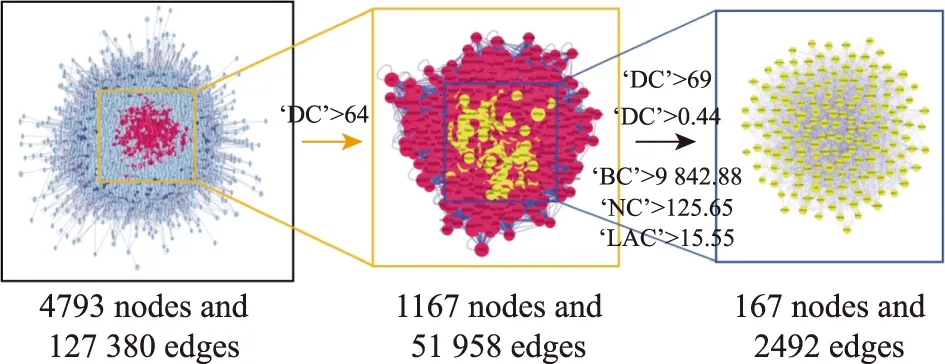
圖4 地榆升白片干預白細胞減少癥關鍵節點的篩選策略
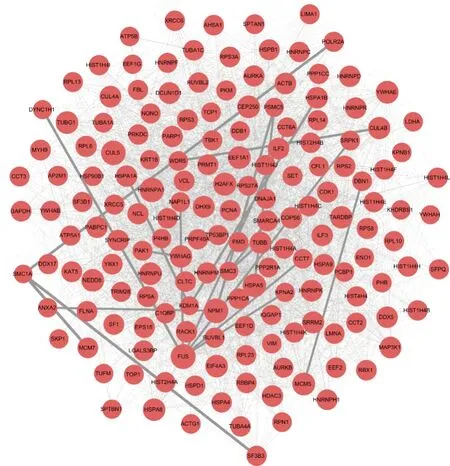
圖5 地榆升白片核心靶點PPI網絡
由于PPI網絡中蛋白的作用是相互的,所以通常歸為無向圖。PPI復雜網絡中存在部分密度較高的區域稱為community或module。module內部的網絡是PPI網絡的潛在子網,子網連線密度較高,區域部分連線少,因此module被認為是具有生物學意義的集合,該集合有2種含義,一為蛋白質復合體(protein complex),即多個蛋白質共同組成復合體而后發揮生物學作用;一為功能模塊(functional module),如位于同一通路的蛋白質,其相互作用更加密切。故為更精確地分析地榆升白片治療白細胞減少癥的作用機制,在得到核心PPI網絡后,有必要進一步識別其內在module。通過分子復合物檢測算法對相互作用關系進行分析,得到module,見圖6。根據P值,分別保留PPI網絡與module中3個最佳評分的生物學進程并對其進行功能描述,見表2。
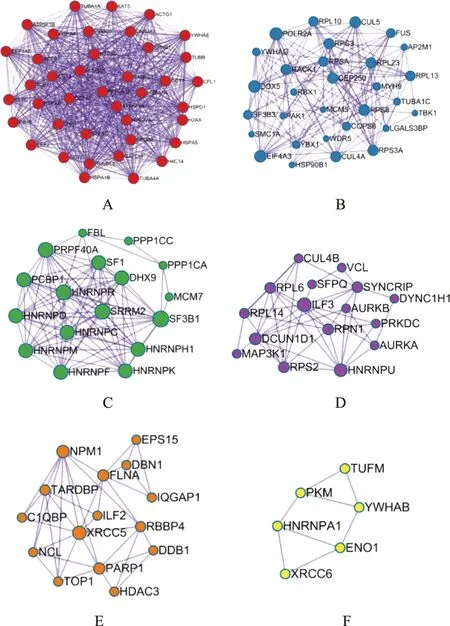
注:A~F為具有生物集合意義的6個功能團。圖6 地榆升白片治療白細胞減少癥核心PPI網絡內部潛在module網絡
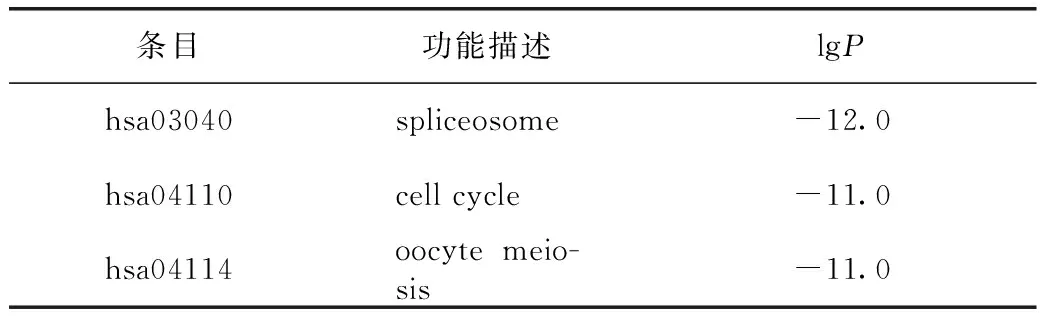
表2 地榆升白片治療白細胞減少癥的PPI網絡內部潛在module功能描述(前3位)
2.5 地榆升白片治療白細胞減少癥通路富集分析可視化
本研究使用Metascape平臺對上述167個關鍵靶點進行基因富集分析,包括GO的BP(biological process)、CC(cellular component)、MF(molecular function)以及KEGG通路,保存其結果并使用R語言繪制氣泡圖(bubble chart),結果見圖7。氣泡顏色由紅到紫代表lgP值從小到大,lgP值越小代表顯著性越強,氣泡越大代表該通路的基因計數(count值)越大,橫軸代表該通路基因所占總體輸入基因的比率(ratio)。
圖7A表明地榆調控白細胞減少癥主要涉及的生物學過程有DNA修復(DNA repair)、RNA剪接(RNA splicing)、翻譯(translation)、mRNA分解過程(mRNA catabolic process)、細胞周期過程的調控(regulation of cell cycle process)等。這些過程直接作為細胞修復和細胞增殖的環節,表明地榆對于白細胞的修復和產生具有直接的調控作用。
圖7D為KEGG通路富集結果,圖中顯示了排名前20的信號通路,包括剪接體通路(spliceosome)、肌動蛋白細胞骨架調控(regulation of actin cytoskeleton)、細胞周期通路(cell cycle)、細胞凋亡(apoptosis)通路等,此外還包括地榆與白細胞減少癥間接相關的信號通路諸如細胞間緊密連接(tight junction)、泛素介導的蛋白質水解(ubiquitin mediated proteolysis)等。
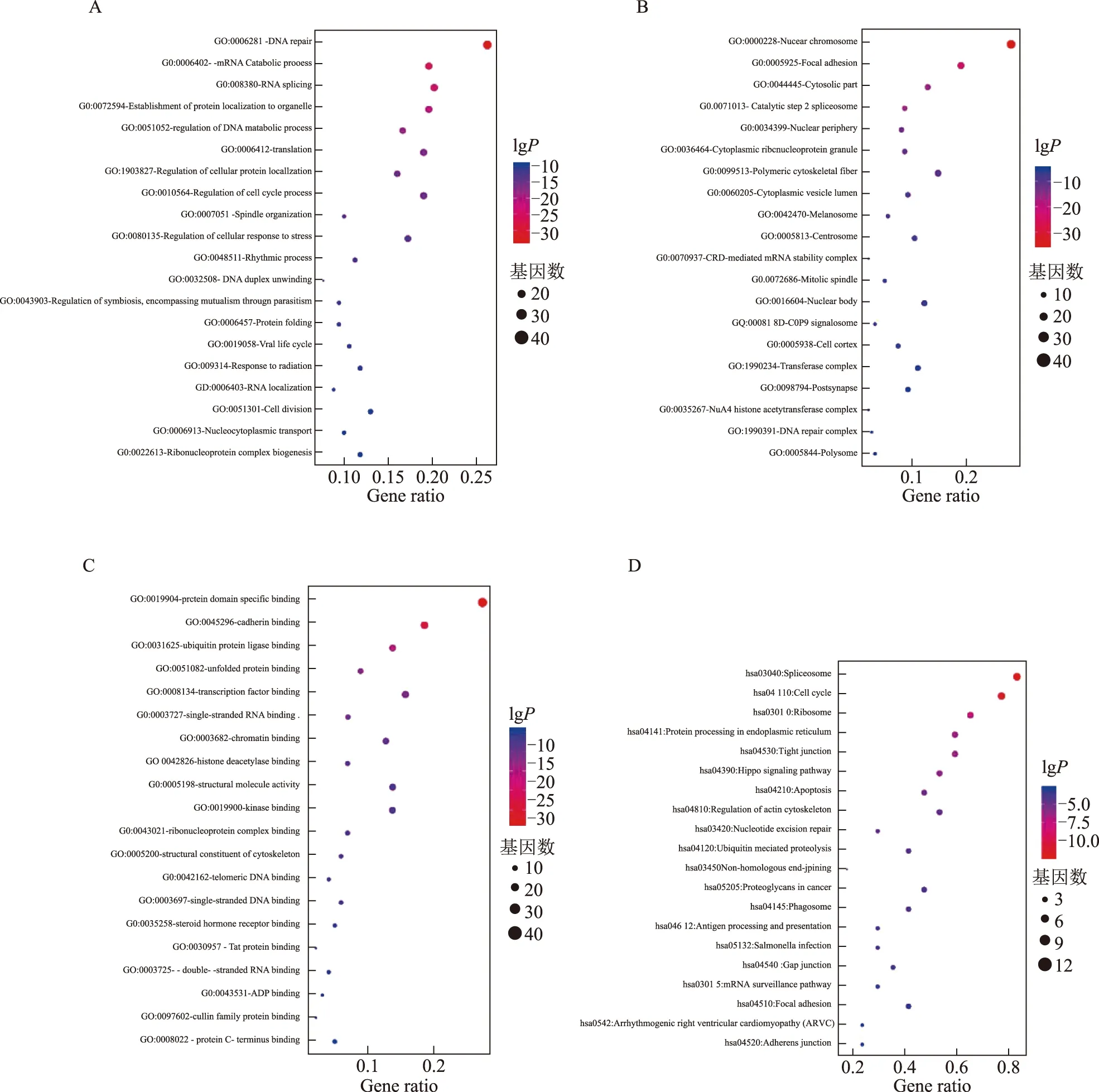
注:A. GO-BP分析;B. GO-CC分析;C. GO-MF分析;D. KEGG分析。圖7 地榆治療白細胞減少癥作用靶點富集氣泡圖
3 討論
中醫學并沒有與白細胞減少癥對應的病名,但其典型癥狀如乏力、頭暈、精神萎靡、食欲減退、面色蒼白或萎黃等與明·李梴所著《醫學入門》中的虛證記載“食少神昏,精不榮,筋骨酸痛”較為接近,故可將其歸于中醫學“虛勞”范疇[25]。由圖2可知,地榆升白片調治白細胞減少癥的主要成分可能為槲皮素、地榆皂苷、山柰酚等。其中地榆皂苷I可調控F2、JUN、GLI1、HSD11B2、HSD11B1、BCL2L1等靶點,而靶點如F2可與多個活性成分互相作用,這反映出地榆升白片治療白細胞減少癥的相互協調、共同調節的作用機制。細胞實驗表明,槲皮素可與HSP(70和90)、MAT2A和FOXM1相互作用來促進細胞周期阻滯和凋亡[26],山柰酚能以濃度依賴的方式促進細胞凋亡并抑制多藥耐藥性[27],實驗研究表明,地榆皂苷I可顯著升高骨髓抑制小鼠白細胞數量和中性粒細胞數量,激發其造血干細胞自噬的發生,并顯著上調造血干細胞中Atg5、Atg7和Beclin-1蛋白的表達水平[21],地榆皂苷II通過激活3大細胞凋亡通路來抑制腫瘤細胞的增殖,促進腫瘤細胞的凋亡,間接對白細胞減少癥起治療作用。
3.1 關鍵靶點結果分析
本研究按照篩選策略共得到167個潛在關鍵靶點。根據度值排名,其中較為重要的有FUS、CUL5、NPM1、HNRNPA1、HSPA5、H2AFX、TUBG1。基礎研究表明,FUS參與了轉錄調節、RNA剪接與轉運等多種細胞生命活動[28],其主導的DNA或RNA結合蛋白能在DNA雙鏈斷裂修復過程中促進D-環形成和同源重組,進而影響細胞生命活動[29]。CUL5具有結合泛素蛋白連接酶的功能[30],其參與的ERBB2信號轉導通路可參與激活核糖體RNA基因的轉錄來增強翻譯和細胞生長[31],這在固有凋亡信號通路中起調控作用[32]。NPM1能調節中心體復制,并通過抑制EIF2AK2/PKR自身磷酸化來抑制細胞凋亡[33],故推測地榆升白片可能通過抑制NPM1的功能來對抗白細胞減少癥。而γ-微管蛋白(TUBG1)是人類細胞中心體實現組裝功能所需的必要蛋白質,同時γ-微管蛋白還參與細胞胞質分裂的協調[34]。熱休克蛋白5(HSPA5)與內質網伴侶蛋白在內質網腔中的蛋白質折疊和質量控制中起關鍵作用[35-38],而組蛋白家族成員(H2AFX)在維持染色質結構和遺傳穩定性方面很重要[39]。以上研究表明,地榆升白片通過多靶點對白細胞減少癥起到調治作用。
3.2 通路與生物進程分析
地榆升白片調治白細胞減少癥涉及DNA修復、mRNA分解過程、RNA剪接、DNA代謝過程的調控、細胞分裂等多個生物學進程,這些進程是細胞修復和細胞增殖的直接環節。細胞應激反應(regulation of cellular response to stress)的下游信號通路聚集在TSC1/2,TSC1/2可抑制對細胞生長功能具有促進作用的雷帕霉素靶蛋白復合體1(mTORC1)。當給予細胞的刺激達到一定程度時,可使mTORC1失活[40]。這表明地榆升白片對細胞應激反應的干預有可能促進白細胞的修復與生成。此外,通過參與細胞對輻射的反應(response to radiation)通路,推測地榆升白片能夠間接對放療引起的白細胞減少癥產生調治作用。
從通路富集結果可知,地榆升白片可能主要干預細胞凋亡、細胞周期、細胞分裂等直接與細胞生命相關的通路,亦可通過抗腫瘤方面的作用間接調控白細胞減少癥。剪接體參與的前體信使RNA的剪接是所有真核生物從DNA到蛋白質的信息交流中必不可少的步驟,而其所包含的多效調控蛋白1(PLRG1)是細胞周期進程和凋亡的關鍵核調節因子[41]。細胞周期通路的破壞可導致細胞周期的停滯,相關研究表明,此通路與癌癥預后有關[42-43],故推測地榆升白片可通過干預細胞周期通路來調控白細胞前體細胞的分裂與再生,同時具有一定的抗腫瘤作用。核糖體生物發生的中斷會導致核仁應激,激活p53信號傳導途徑,進而導致細胞周期停滯和凋亡[44]。此外,當內質網中未折疊或錯誤折疊的蛋白質超過其折疊能力時,會誘導內質網自噬和與凋亡機制的串擾,以影響細胞存亡[45]。緊密連接(tight junction,TJ)包含細胞質銜接蛋白(ZO蛋白),與ZO蛋白相關的ZO-1相關核苷酸結合蛋白(ZONAB)可與增殖細胞核抗原(PCNA)、細胞周期蛋白D1直接相互作用來調節細胞周期[46]。河馬信號通路參與細胞增殖與程序性死亡,其失調將導致細胞異常生長和腫瘤生成[47]。此外,在血液系統惡性腫瘤中,細胞凋亡程序通常失調,進而導致惡性腫瘤細胞的積累[48],一定程度的積累則產生放、化療的治療需求。
綜上所述,地榆升白片治療白細胞減少癥的主要成分可能是槲皮素、地榆皂苷、山柰酚等,涉及到細胞周期、DNA修復、細胞凋亡、細胞應激反應調控、內質網中蛋白質加工、細胞分裂、細胞對輻射的反應等多個生物學過程及通路。這為后續進一步探討地榆升白片治療白細胞減少癥的機制以及實驗設計提供了依據。本課題組后續將設計完善相應的體內或體外實驗,構建白細胞減少癥相關模型,進一步分析地榆升白片治療白細胞減少癥的作用機制和分子機制,以驗證本研究的分析和結論。此外,目前對于具體藥物組分含量及比例因素的定量分析仍缺乏系統的研究模型。今后本課題組將持續跟進相關進展并做進一步研究。

