輕中度卵巢子宮內膜異位囊腫手術對IVF-ET結局的影響
劉夢瑤,曹陽,劉建新
(青島大學附屬醫院生殖中心,青島 266061)
卵巢子宮內膜異位癥(Overian endometriosis,OEM)囊腫是由于子宮內膜組織在卵巢皮質內生長而引起的疾病[1],在育齡期婦女中發病率可達10%~15%,在不孕癥患者中其發病率達40%~50%[2]。臨床上對于OEM合并不孕癥的治療主要有藥物、手術及體外受精-胚胎移植(IVF-ET)3種方式[3]。目前臨床上尚無特效藥物根治子宮內膜異位癥,促性腺激素釋放激素激動劑(GnRH-a)可通過使垂體達到去敏感狀態來抑制卵巢活性使異位灶萎縮,但GnRH-a亦可造成卵巢過度抑制狀態,其是否能改善卵母細胞質量及臨床妊娠結局仍存在爭議[4]。隨著腔鏡技術的推廣,腹腔鏡下囊腫剔除術已成為OEM囊腫的一線療法,其不僅可明確診斷分期,亦可清除異位病灶、恢復盆腔正常解剖結構。但研究表明,手術僅可提高自然妊娠的幾率,且術后異位囊腫存在復發的風險,手術操作亦可損傷正常的卵巢組織造成卵巢儲備功能減退[5]。歐洲生殖胚胎學會建議合并OEM的不孕患者進行輔助生殖技術(ART)助孕,特別是合并輸卵管因素、男方因素或其他治療方式失敗者[5]。但也有學者提出,IVF-ET對于OEM患者的卵泡發育、子宮內膜容受性等并無明顯改善作用,且異位囊腫的存在會增加取卵操作的困難及感染的風險[6]。對于合并OEM選擇IVF-ET助孕的患者,助孕前是否有必要行腹腔鏡下囊腫剝除術目前存在爭議。本研究收集335例OEM合并不孕癥行IVF-ET助孕患者的臨床資料,并以單純輸卵管因素行IVF-ET患者作為對照,探討OEM合并不孕癥患者助孕前手術與否對IVF-ET結局產生影響,旨在為臨床治療OEM導致的不孕癥提供參考。
資料與方法
一、研究對象
選取2016年l月至2019年8月在青島大學附屬醫院生殖中心因單側OEM導致不孕并接受IVF-ET助孕治療的335例患者為研究對象,根據助孕前是否行腹腔鏡下OEM囊腫剝除術分為手術組(n=144)與OEM組(n=191),同時納入同期因單純輸卵管因素在我院行IVF-ET助孕的276例患者作為對照組(n=276)。
具體納入標準:(1)手術組:既往行腹腔鏡下囊腫剝除術,術中腹腔鏡探查可見卵巢內膜異位病灶且術后經過病理證實。r-AFS分期法均為I~Ⅲ期;病灶完全切除且在術后未行輔助治療,1年內首次行IVF-ET術。(2)OEM組:OEM囊腫的診斷至少有兩次超聲記錄且至少間隔兩個月經周期,測量囊腫3條垂直徑線取平均值為囊腫直徑,且囊腫直徑大于10 mm。(3)對照組:術前輸卵管造影證實雙側輸卵管不通。
排除標準:(1)年齡≥40歲或基礎卵泡刺激素(FSH)水平>10 U/L;(2)同時合并有多囊卵巢綜合征(PCOS)、甲狀腺功能異常、腎上腺皮質腫瘤、高泌乳素血癥等其他明確不孕因素;(3)合并其他性質的卵巢腫瘤或卵巢手術史;(4)合并染色體異常或遺傳性疾病;(5)男性因素不育者;(6)存在宮腔粘連、子宮內膜息肉、粘膜下肌瘤等宮腔因素不孕者。
二、研究方法
1.促排卵治療和胚胎移植:所有患者于月經第2天清晨抽取靜脈血測量血清基礎性激素水平,包括基礎FSH、泌乳素(PRL)、黃體生成素(LH)、孕酮、睪酮(T)和雌二醇(E2),以及測量血清CA125,經陰道B超測量記錄基礎竇卵泡數(AFC)。根據患者年齡、基礎性激素水平及卵巢超聲特征等制定個性化促排卵方案,于月經周期第2~3天分別給予個體化促排卵,定期行陰道超聲及激素水平檢測監測卵泡發育,并根據卵泡發育情況調整促性腺激素(Gn)用量。當有2~3個優勢卵泡直徑≥18 mm時,于當晚21點肌肉注射人絨毛膜促性腺激素(HCG,珠海麗珠)6 000~8 000 U。注射HCG后34~36 h經陰道后穹隆超聲引導下穿刺取卵。取卵前測量血清E2水平,并記錄總Gn用量及天數。根據男方精液情況選擇常規IVF或卵胞漿內單精子注射(ICSI)授精。若出現未獲卵、卵巢過度刺激綜合征(OHSS)高風險、無可移植胚胎、累積胚胎或患者合并其他不適合移植的疾病等情況,則本周期取消新鮮胚胎移植,冷凍胚胎擇期行凍融胚胎移植(FET)。移植的新鮮胚胎均為優質胚胎。
2.妊娠判斷及統計指標:胚胎移植后第35天行B超檢查見宮內孕囊者定義為臨床妊娠,孕囊個數定義為著床個數。收集所有患者的基本資料,包括年齡、AFC、不孕年限、CA125、基礎體重指數(BMI),月經第2天血清基礎內分泌激素水平:包括FSH、PRL、T、P、LH和E2,比較3組患者的總Gn用量及天數、取卵前血清E2水平、獲卵總數、可移植胚胎數、優質胚胎數、受精率、優質胚胎率、囊胚形成率、鮮胚種植率、鮮胚臨床妊娠率、鮮胚移植早期流產率、鮮胚分娩率。
三、統計學方法
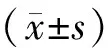
結 果
一、3組患者的基本情況
3組患者基礎資料比較,不孕年限、BMI及基礎LH、E2、T、P、PRL水平均無顯著性差異(F=0.198~2.811,P>0.05);對照組年齡、基礎FSH水平及CA125水平均顯著低于手術組與OEM組(t=3.527~4.930,P<0.05);3組間AFC比較存在顯著性差異(t=4.101~4.456,P<0.05)(表1)。
表1 三組患者基礎資料比較 (-±s)
二、3組患者促排情況及IVF-ET結局比較
統計結果顯示,總Gn用量對照組顯著低于手術組與OEM組(t=4.002~5.004,P<0.05);取卵前E2水平、獲卵總數、可移植胚胎數及優質胚胎數3組間比較均有顯著性差異(t=2.682~9.140,P<0.05);對照組卵裂率顯著高于其他兩組,手術組受精率及優質胚胎率顯著低于其他兩組(χ2=3.939~14.689,P<0.05);3組患者總Gn天數、囊胚形成率、移植鮮胚數及鮮胚種植率、臨床妊娠率、早期流產率、分娩率比較均無顯著性差異(F=0.902,χ2=0.016~3.264,P>0.05)(表2)。
表2 三組患者促排卵情況及IVF-ET結局比較[(-±s),%]
三、3組患者的單側卵巢AFC及獲卵數比較
OEM組及手術組健側卵巢AFC及獲卵數均顯著高于同組內患側/術側(t=3.014~4.335,P<0.05),OEM組患側卵巢AFC及獲卵數均顯著高于手術組術側(t=2.332 1、3.453,P<0.05);對照組單側卵巢AFC與手術及OEM組健側比較無顯著性差異(t=1.679、2.557,P>0.05),而獲卵數對照組單側顯著高于手術組健側(t=5.389,P<0.05),與OEM組健側比較無顯著性差異(t=2.322,P>0.05)(表3)。
四、手術組與OEM組各臨床因素對獲卵數的影響
納入年齡、OEM直徑、BMI、基礎FSH水平、取卵前E2水平、AFC、不孕年限、CA125水平共8項因素,采用多元線性回歸分析其對獲卵數的影響。結果顯示,OEM組取卵前E2水平為預測獲卵數的最佳指標,其次為年齡、AFC、基礎FSH水平(t=-4.340~7.743,P<0.05),OEM直徑、BMI、不孕年限及CA125水平對獲卵數無顯著影響(t=-2.255~0.745,P>0.05)(表4)。手術組獲卵數與取卵前E2水平及AFC顯著相關(t=7.932、3.329,P<0.05),其余指標對獲卵數無顯著影響(t=-1.553~1.611,P>0.05)(表5)。
表3 三組單側卵巢竇卵泡數及獲卵數比較(-±s)

表4 多元線性回歸分析影響OEM組獲卵數的相關因素

表5 多元線性回歸分析影響手術組獲卵數的相關因素
討 論
OEM作為一種雌激素依賴的炎性疾病,可從多方面影響女性生殖功能。由于其發病機制及病理生理過程復雜多變,異位囊腫的存在是否會影響IVF-ET結局及助孕前是否需手術剔除異位囊腫病灶一直存在爭議[7]。
OEM造成不孕癥的機制尚未明確,現研究認為與其損傷卵母細胞及胚胎質量、造成卵泡早期閉鎖、降低子宮內膜容受性、造成盆腔粘連等多因素有關[8]。本研究中,OEM組患者與對照組患者相比,其基礎FSH水平偏高,而AFC偏低,說明合并OEM患者的卵巢儲備明顯低于單純輸卵管因素患者。并且OEM組患者患側卵巢AFC明顯低于健側,進一步說明OEM的存在會對周圍卵巢組織造成損傷。目前認為與異位病灶侵襲性生長對正常卵巢組織及血液供應造成機械性損害及異位囊腫內大量的細胞損傷因子誘發病灶周圍卵巢組織反復炎性反應與纖維化形成有關。
腹腔鏡下異位病灶剔除術是當前臨床治療OEM的一線療法,亦是診斷OEM的金標準。2015年《子宮內膜異位癥的診治指南》建議OEM直徑≥4 cm時應行手術治療[9]。但研究表明術后患者僅自然受孕幾率增加[10],術后2年異位病灶的復發率高達24.6%,復發后將更進一步加重對卵巢的損害[11],故對于高齡或合并其他因素需行IVF-ET助孕的OEM患者,助孕前是否需手術剔除異位病灶仍存在爭議。本研究中納入手術組患者按 r-AFS 分期法分期均為Ⅰ~Ⅲ期即輕中度OEM患者,手術組與OEM組患者基本情況無顯著差異,但AFC、取卵前E2水平、獲卵數、可移植胚胎數、優質胚胎數、受精率及優質胚胎率手術組均顯著低于OEM組及對照組,且手術組術側AFC及獲卵數也顯著低于OEM組患側,提示對于輕中度OEM患者,助孕前手術剝除異位病灶并不能改善IVF-ET助孕結局,甚至增加卵巢儲備及卵子質量降低的風險,與 Laursen等[10]研究結果相符。還有研究表明腹腔鏡下OEM剝除術后,患者AFC及血清抗苗勒管激素(AMH)水平均較術前顯著降低[12],再次提示了手術對卵巢儲備的不良影響。手術的治療效果與囊腫大小及位置、囊腫與周圍組織的黏連程度及術者操作經驗等多種因素有關,術后卵巢儲備及反應的減退目前認為主要因手術操作時不可避免地剝離損傷正常卵巢組織造成卵泡丟失;同時電凝止血時對卵巢組織產生熱損傷;術后卵巢血運供應受損;術后卵巢局部產生炎癥反應及自身免疫反應對存留卵巢進一步損傷。本研究作為回顧性分析,未能將個體手術前后的卵巢儲備及卵母細胞質量進行對比,有待于后續進一步研究加以探討。
對于中重度內異癥、高齡(>35歲)、合并嚴重男方因素、卵巢功能減退或輸卵管異常的患者,現臨床建議首先考慮IVF-ET[9]。OEM的存在是否會影響IVF-ET結局目前仍無定論,Hamdan等[13]行Meta分析指出,r-AFS分期Ⅰ~Ⅱ期的子宮內膜異位癥患者IVF結局不受影響,但有學者提出OEM的存在會增加取卵操作的困難及感染的風險,同時存在囊腫扭轉甚至癌變的可能;且IVF-ET術后發生流產、子癇前期、早產等遠期產科并發癥的幾率明顯高于其他因素患者[14-16]。本研究中與單純輸卵管因素患者相比,OEM組患者總Gn用量偏高,而取卵前E2水平、獲卵數、卵裂率、可移植胚胎數及優質胚胎數均偏低,證明OEM的存在會降低周圍卵巢組織對促排卵藥物的反應性[17-18]。Op?ien等[19]研究提示輕中度OEM的存在雖然會影響IVF-ET中卵巢的反應,但可獲得與單純輸卵管因素IVF相近的妊娠結局。本研究中OEM組與對照組相比,受精率、囊胚形成率及鮮胚移植妊娠結局之間的差異無統計學意義,考慮與健側卵巢的代償作用、輔助生殖技術中ICSI彌補了OEM中卵母細胞透明帶硬化造成的受精率下降、胚胎移植技術彌補了盆腔炎癥微環境對胚胎的損害等原因有關。但本研究未能將單側卵巢所獲卵母細胞分別培養,也未進行囊胚及凍存胚胎移植結局統計,故對于輕中度OEM對子宮內膜容受性、IVF-ET總體妊娠結局及遠期并發癥的影響,需擴大樣本量進一步研究。
關于OEM影響IVF-ET結局的相關因素一直是關注的熱點,臨床進行大量研究以期找到合適指標為助孕前評估異位囊腫對妊娠結局的影響提供參考。本研究對可能影響手術組與OEM組獲卵數的因素進行多元線性回歸分析,結果發現,手術組獲卵數與取卵前E2水平及AFC明顯相關;OEM組取卵前E2水平為預測獲卵數的最佳指標,其次為年齡、AFC、基礎FSH水平,OEM直徑[20]、BMI、不孕年限及CA125水平對獲卵數無明顯影響。故而發現,無論是手術組還是OEM組,取卵前E2水平為預測獲卵數的最佳指標,血清中E2來源于發育中的卵泡并隨著卵泡發育水平升高,單個成熟卵泡取卵前血清E2水平可達1 100 pmol/L[21],但此指標僅適用于促排卵過程中的評估。對于輕中度OEM的不孕患者,卵巢儲備是決定助孕結局的主要因素,助孕前需著重考慮患者AFC、年齡及基礎FSH水平以綜合評估其卵巢儲備情況,從而評估手術的相對價值及必要性。若患者卵巢儲備減退或合并其他IVF-ET指征,建議避免手術對卵巢的進一步損傷直接行IVF-ET治療。
綜上所述,輕中度OEM的存在會降低卵巢儲備及卵巢對促排卵藥物的反應性,繼而影響IVF-ET結局。腹腔鏡下OEM剔除術并不能明顯改善輕中度OEM患者的助孕結局,反而可增加對卵巢儲備的損害。故助孕前需綜合評估患者年齡、卵巢儲備情況等因素以衡量手術相對價值。

