水熱預處理與Myceliophthora thermophila復合酶協同高效降解混合生物質的研究
錢玉霞,邱衛華,任 虹*
(1.北京工商大學輕工科學技術學院 食品質量與安全北京實驗室 中國輕工業清潔生產和資源綜合利用重點實驗室,北京 100048;2.中國科學院過程工程研究所 生化工程國家重點實驗室,北京 100190;3.中國科學院潔凈能源創新研究院,遼寧 大連 116023)
將低值化的木質纖維素轉變成制備高值化產品的原料,首先需要突破抵御生物和酶攻擊的天然屏障,構建高濃度的“糖平臺”[1-3]。預處理技術可以打破木質纖維素原料的致密結構,增大其表面孔徑和比表面積,從而提高原料的纖維素酶(Cel)水解效率及后續微生物的多糖利用率。水熱預處理(hot-water pretreatment,HWP)因無需添加任何化學試劑即可高效去除大量半纖維素和部分木質素等,被認為是一種低成本的綠色預處理方法[4-5]。然而,水熱預處理對原料中木質素的降解能力較弱。由于殘留的木質素可能會形成物理屏障,導致酶的非生產性吸附,從而影響后續的酶水解效率[6-7]。真菌,尤其是白腐菌,因具有獨特的半纖維素、木質素分解酶系,可選擇性降解木質素和半纖維素,并且具有能耗低、環境友好等優勢,真菌處理成為重要的木質纖維素生物預處理方法[8-10]。但是,真菌處理存在微生物生長周期長、發酵溫度多為常溫、發酵過程較難控制等缺點。嗜熱毀絲霉(Myceliophthorathermophila)是一種高效的木質纖維素天然降解劑,能夠有效利用植物生物質并將其水解產生單糖及其它小分子物質[11-12]。研究表明,該菌株的基因序列含有大量編碼木質纖維素分解酶的基因,可分泌大量熱穩定的碳水化合物分解酶和木質素降解酶,從而降解各種不同的生物質[13-15]。
傳統的以單一原料為主的生物質煉制技術存在原料供應易受地域、儲運成本限制等問題。相比而言,混合生物質原料具有供應更穩定、儲量更大、更易于收集等優勢。研究表明,混合生物質原料的充分利用可能提高生物乙醇的產量,并提高生物精煉廠的經濟可行性[16-17]。鑒于此,作者以甘蔗渣-棉桿-小麥秸稈 (4∶2∶1,質量比)混合生物質為研究對象,考察水熱預處理參數對混合生物質中各組分含量的影響;研究嗜熱毀絲霉復合酶(MTE)與Cel協同作用下,不同水熱預處理參數下制備的混合生物質的酶解效率;最后結合酶解液的UV變化及酶解渣的FTIR圖譜分析,解析MTE與水熱預處理協同作用提高混合生物質降解效率的機制。
1 實驗
1.1 材料、試劑與儀器
甘蔗渣(廣西)、棉桿(河北)、小麥秸稈(河北),在60 ℃真空干燥箱中烘干至恒重,并粉碎至60目。按質量比4∶2∶1將甘蔗渣、棉桿、小麥秸稈混合,制備混合生物質。采用美國可再生能源實驗室(NREL)標準檢測方法[18]分析混合生物質中主要組分的含量,其中酸不溶木質素、葡聚糖、木聚糖的含量分別為21.2%、36.5%、19.6%。
纖維素酶(Cel),諾維信公司;其它試劑未特殊標注均為分析純,北京奧博星生物技術有限責任公司、國藥集團化學試劑有限公司等。
H1650型臺式高速離心機、H2050R-1型高速冷凍離心機,湘儀離心機儀器有限公司;754PC型紫外可見分光光度計,上海菁華科技有限公司;LC-20A型二元高壓液相色譜儀,日本島津;Y92-ⅡN型超聲波破碎儀,寧波新芝生物科技有限公司;S-450型掃描電子顯微鏡,日立公司;System 2000型紅外光譜儀,美國Perkin-Elmer公司。
1.2 菌種
嗜熱毀絲霉(M.thermophilaDSM 1799),德國微生物和細胞培養物保藏中心(DSMZ)。
1.3 發酵液的制備
將嗜熱毀絲霉接種于土豆葡萄糖瓊脂培養基(PDA)中,28 ℃培養5 d后,保存于冰箱中,備用。
將嗜熱毀絲霉菌絲接種至土豆葡萄糖培養基 (PDB)中,于50 ℃、180 r·min-1振蕩培養3 d,得種子液;然后按5%的接種量將種子液接種至PDB培養基中,于50 ℃、180 r·min-1振蕩培養5~7 d,即得嗜熱毀絲霉發酵液。
1.4 嗜熱毀絲霉復合酶的制備
將嗜熱毀絲霉發酵液于8 000 r·min-1離心10 min,分離菌體和發酵液;將菌體細胞重懸于1/5~1/10發酵液體積的50 mmol·L-1pH值 7.4的Tris-HCl緩沖液中,冰浴下進行超聲破碎;將混合物于10 000 r·min-1離心10 min,收集上清液,即為嗜熱毀絲霉胞內酶液。
將嗜熱毀絲霉發酵液和胞內酶液合并后,加入硫酸銨至濃度為80%,4 ℃靜置,充分沉淀蛋白質,于10 000 r·min-1離心10 min,取沉淀溶于0.2 mol·L-1pH 值5.0 的PBS緩沖液后,裝入透析袋中,于4 ℃透析去除硫酸銨,即得MTE。以牛血清蛋白為標準品,采用考馬斯亮藍法[19]測得MTE的總蛋白含量為23.5 mg·mL-1。
1.5 混合生物質水熱預處理
將混合生物質加入高溫高壓反應釜反應罐中,并按固液比1∶10(g∶mL,下同)加入蒸餾水;反應釜密封后加熱至預設溫度,恒溫一定時間,迅速冷卻至室溫;泄壓,抽濾,收集生物質殘渣和水解液;記錄水解液的體積,生物質殘渣晾干后備用。按式(1)計算水熱預處理強度(PS)[20]:
(1)
式中:t1為反應器溫度達到100 ℃的時刻,min;t2為反應器溫度冷卻至100 ℃的時刻,min;T為反應器溫度,℃。
1.6 混合生物質的酶解
按以下3種方式進行水熱預處理生物質殘渣的酶解:(1)加入MTE處理24 h后,加入Cel進行酶解,記為MTE-Cel;(2) 同時加入MTE與Cel進行酶解,記為MTE+Cel; (3)僅加入Cel進行酶解,記為Cel。MTE加量為10 mg蛋白·(g底物)-1,Cel加量為40 U·(g底物)-1。
酶解操作為:取水熱預處理生物質殘渣1 g,加入酶,以0.02 mol·L-1pH 值4.8的醋酸-醋酸鈉緩沖液調節酶解體系的固液比為1∶20;攪拌均勻后,于50 ℃、180 r ·min-1振蕩酶解;真空抽濾進行固液分離,用20 mL蒸餾水洗滌酶解渣,洗滌液與酶解濾液合并得到酶解液,酶解渣晾干,備用。
按式(2)計算酶解總糖得率(ST,%):
(2)
式中:mge和mxe分別為酶解液中葡萄糖和木糖質量,g;mgb和mxb分別為酶解前原料中葡聚糖和木聚糖質量,g;0.9為葡萄糖和葡聚糖的轉化系數;0.88為木糖和木聚糖的轉化系數。
按式(3)計算MTE對Cel的協同酶解效率(SE,%):
(3)
式中:STMTE和STCel分別為MTE協同酶解方式下和Cel單獨酶解方式下得到的總糖得率,%。
1.7 分析方法
1.7.1 葡萄糖和木糖含量的測定
采用HPLC法測定葡萄糖、木糖的含量[21]。色譜條件:色譜柱為Aminex HPX-87H (300 mm×7.8 mm,Bio-Rad Laboratories Inc.),流動相為脫氣處理的5 mmol·L-1H2SO4,流速為0.6 mL· min-1,柱溫為65 ℃,示差檢測器溫度為40 ℃。
1.7.2 混合生物質組分分析
采用NREL的兩步酸水解法[18]分析混合生物質中主要組分。稱取0.3 g混合生物質,加入3 mL 72%濃硫酸,30 ℃保溫60 min后,再加入84 mL去離子水,于121 ℃水解60 min后,取出冷卻至室溫;抽濾分離生物質殘渣和水解液。取1 mL水解液,采用HPLC法測定葡萄糖和木糖含量;生物質殘渣經洗滌后,置于60 ℃烘箱中烘干至恒重,測定酸不溶性的木質素含量。按式(4)~(6)分別計算葡聚糖、木聚糖和木質素的降解率:
(4)
(5)
(6)
式中:V為水解液的體積,mL;cg、cx分別為水解液中葡萄糖含量、木糖含量,g·mL-1;mg、mx分別為水熱預處理混合生物質中葡聚糖、木聚糖的質量,g;m0、m1分別為水熱預處理前、后混合生物質中木質素的質量,g。
1.7.3 酶解液的UV分析
將酶解液以適量蒸餾水稀釋,在220~450 nm范圍內進行全波段掃描。
1.7.4 酶解渣的FTIR分析
分別取約1 mg混合生物質及酶解渣樣品,加入約200 mg干燥的溴化鉀,充分研磨后壓片,進行FTIR分析。掃描范圍為4 000~400 cm-1,分辨率為4 cm-1,掃描10次進行光譜累加,環境氣氛為空氣[22]。
2 結果與討論
2.1 水熱預處理參數對混合生物質中各組分含量的影響
水熱預處理溫度和時間對混合生物質中各組分含量的影響如圖1所示。

圖1 水熱預處理溫度和時間對混合生物質中各組分含量的影響
從圖1可以看出,總體來說,相對于未處理原料,水熱預處理使混合生物質中葡聚糖和木質素含量增加,而木聚糖含量顯著減少。
在140~170 ℃范圍內,混合生物質中葡聚糖含量變化不明顯;但是當溫度升高至180 ℃時,葡聚糖含量有所減少。
木聚糖含量隨著水熱預處理溫度升高而不斷減少。在維溫時間為10 min、溫度由140 ℃升至150 ℃和由170 ℃升至180 ℃時,混合生物質中木聚糖含量分別減少了5.08 %和41.1%。木聚糖降解率隨維溫時間延長而升高,且高溫區維溫時間對木聚糖降解率的影響更為顯著。在140 ℃下維溫時間由10 min延長至30 min時,木聚糖降解率僅提高11.74% (由9.69%升高至21.43%);而在180 ℃下維溫時間由5 min延長至10 min時,木聚糖降解率則提高了45.4%,達到81.6%。
木質素含量隨著水熱預處理溫度的升高和水熱預處理時間的延長呈增加的趨勢,最大含量達到32.6%。維溫時間為10 min、溫度從140 ℃升至150 ℃和從170 ℃升至180 ℃時,混合生物質中木質素含量分別增加了5.19%和22.1%。維溫時間對木質素降解率的影響也較大,在160 ℃維溫10 min和180 ℃維溫5 min,木質素含量分別增加了16.98%和38.68%。但是,在各溫度下,延長維溫時間對于木質素含量的增加影響并不明顯。
總體而言,水熱預處理對混合生物質中各組分含量的變化趨勢與已有報道[23-24]較為一致。木聚糖含量的變化主要是由半纖維素的降解引起的。通常,水熱預處理中半纖維素首先降解為木糖低聚物、葡萄糖醛酸和乙酸等。半纖維素的降解打破了原料致密的細胞壁結構,有利于提高后續酶解過程中酶的生物可及性[25-27]。但是過高的水熱預處理強度下,上述初級產物可被二次降解為木糖單體、糠醛、5-羥甲基糠醛、乙醇酸、甲酸等抑制物質,從而對酶解產生不利影響[23,28-29]。由于多糖類組分的降解,原料中木質素含量隨著水熱預處理強度的升高而增加。另一方面,多糖降解物以及水解液中的小分子物質之間發生再凝集反應生成酸不溶性的木質素類似物,這些物質會沉積在纖維素表面,也會造成水熱預處理后木質素含量增加[30-31]。而木質素對于后續混合生物質的酶解存在諸多不利影響,包括影響Cel活性和酶吸附、解吸效率等,進而影響酶解效率[32-35]。
相近水熱預處理強度下混合生物質中各組分含量變化如表1所示。
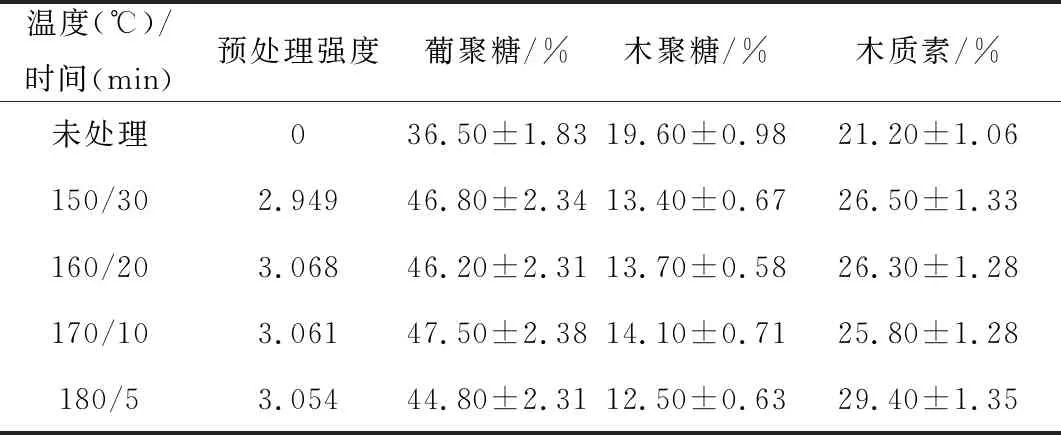
表1 相近水熱預處理強度下混合生物質中各組分含量變化
從表1可以看出,溫度是影響各組分含量變化的主要因素,150 ℃維溫30 min時,木質素含量為(26.50±1.33)%;而180 ℃維溫5 min時,木質素含量為(29.40±1.35)%。可見,高溫會導致葡聚糖降解及木質素含量增加,不利于后續混合生物質的酶解。
2.2 水熱預處理混合生物質多酶協同酶解
不同酶解方式下,不同水熱預處理混合生物質的總糖得率及協同酶解效率如圖2所示。
在不同酶解方式下,混合生物質的總糖得率均隨水熱預處理強度升高而升高。混合生物質的酶解總糖得率隨水熱預處理溫度升高而升高,維溫時間為20 min、溫度從140 ℃升至180 ℃時,混合生物質的Cel酶解總糖得率從36.51%升至79.21%,而MTE-Cel和MTE+Cel的總得糖率則均升至約85%(圖2a)。在140~170 ℃范圍內,隨著維溫時間的延長,混合生物質的酶解總糖得率也隨之升高;但是當水熱預處理溫度為180 ℃且維溫時間超過20 min時,酶解總糖得率降低(圖2b)。這可能是由于,一方面,長時間高溫水熱預處理得到的混合生物質中含有的糠醛、羥甲基糠醛、木質素降解物等物質對酶的活性具有抑制作用[4];另一方面,長時間高溫水熱預處理條件下,由于一些酸不溶性木質素類似物沉積在纖維素表面,限制了纖維素對酶的可及性,并且在酶促水解過程中造成Cel的無效吸附,從而影響水熱預處理混合生物質的酶解效率[31,36-37]。
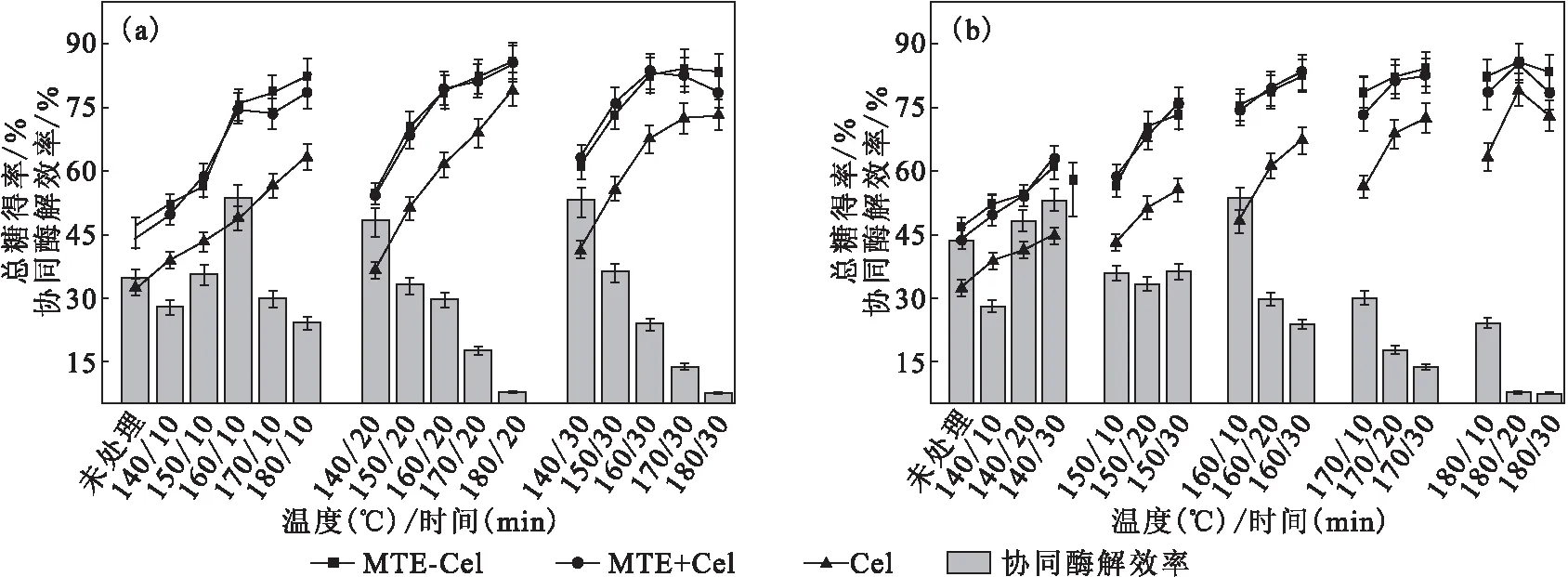
圖2 不同酶解方式下,不同水熱預處理混合生物質的總糖得率及協同酶解效率
MTE-Cel和MTE+Cel酶解方式均具有明顯的協同酶解效果。在MTE-Cel酶解方式下,混合生物質的總糖得率略高于MTE+Cel酶解方式。當維溫時間為10 min、溫度由140 ℃升至160 ℃時,MTE對Cel的協同酶解效率逐漸升高,并在160 ℃時達到最高,為53.6%,之后協同酶解效率迅速降低(圖2a)。而維溫時間在20 min和30 min時,MTE對Cel的協同酶解效率均隨溫度升高而快速降低,在180 ℃維溫20 min和30 min時,MTE對Cel的協同酶解效率分別為7.7%和7.4%。而水熱預處理時間對MTE協同Cel水解生物質的影響也存在較大的差異。在140 ℃分別維溫10 min、20 min和30 min的混合生物質,經MTE+Cel酶解的總糖得率較Cel單獨酶解分別提高了28.17%、48.21%和53.21%。而在150 ℃下維溫10 min,MTE對Cel的協同酶解效率為35.8%,之后延長預處理時間對協同酶解效率的影響不大。在160~180 ℃范圍內,協同酶解效率則隨維溫時間延長而快速降低 (圖2b)。這說明,MTE與Cel協同作用可以降低水熱預處理強度,從而達到減少能耗的目的。而當水熱預處理強度較高的情況下,MTE對Cel的協同酶解效果減弱。
MTE具有協同酶解作用主要是由于,在嗜熱毀絲霉的基因序列中含有大量編碼木質纖維素分解酶的基因,如木聚糖酶、內切葡聚糖酶(CMCase)、β-葡萄糖苷酶以及與木質素降解有關的漆酶基因等,這使得該菌可以將木質纖維素原料有效降解為單糖及其它小分子物質[13-15,38]。其中,漆酶及其介體催化體系是催化木質素降解的重要催化劑之一。而經水熱預處理的生物質會產生一定量的木質素衍生物,這些小分子物質一些已經被證實可以作為漆酶的介體,構成漆酶-介體催化體系催化木質素的降解[41],從而達到降低木質素含量,減少木質素引起的Cel無效吸附等。但是,高水熱預處理強度下,木質素的降解物濃度過高,會導致MTE酶活性的降低甚至失活。另外,一些具有低聚結構的降解物還會引起聚集體的形成,也會導致酶的失活。因此,確定以160 ℃維溫10 min對混合生物質進行水熱預處理,再以MTE+Cel協同酶解來實現混合生物質的高效生物降解。
2.3 酶解液的UV分析
生物質中具有紫外吸收的物質主要來自于木質素降解產物,160 ℃維溫10 min水熱預處理的混合生物質在不同酶解方式下酶解液的UV圖譜如圖3所示。
通常190 nm附近和270~300 nm范圍內的紫外吸收峰歸屬于含有羰基的飽和醛酮類化合物。而在α、β-不飽和醛酮中,羰基與乙烯基產生的π-π共軛作用使上述兩個譜帶紅移至220~260 nm和310~330 nm。從圖3可以看出,酶解前,溶液中由于水熱預處理殘留的木質素降解產物的存在,在280 nm附近具有較弱的紫外吸收;酶解后,酶解液在280 nm附近的吸收峰強度均有所升高。280 nm處是含有酚羥基物質的特征紫外吸收峰。Cel作用下,混合生物質中的纖維素被水解,從而使得吸附在混合生物質表面的木質素殘渣以及凝聚態假木質素等被釋放出來,引起紫外吸收強度的升高。而MTE與Cel協同作用的酶解液在330 nm處的吸收峰強度也明顯升高,尤其是MTE-Cel酶解方式下,酶解液在330 nm處的吸收峰強度顯著高于其它兩種方式。而對于木質素可溶性降解產物,330 nm處的吸收峰主要歸屬于具有強共軛體系的不飽和醛酮類物質,如黃酮、香豆素類等多酚類物質以及一些茋類化合物[42]。這說明,MTE的加入可以進一步催化木質素降解產生具有不飽和共軛結構的降解產物。
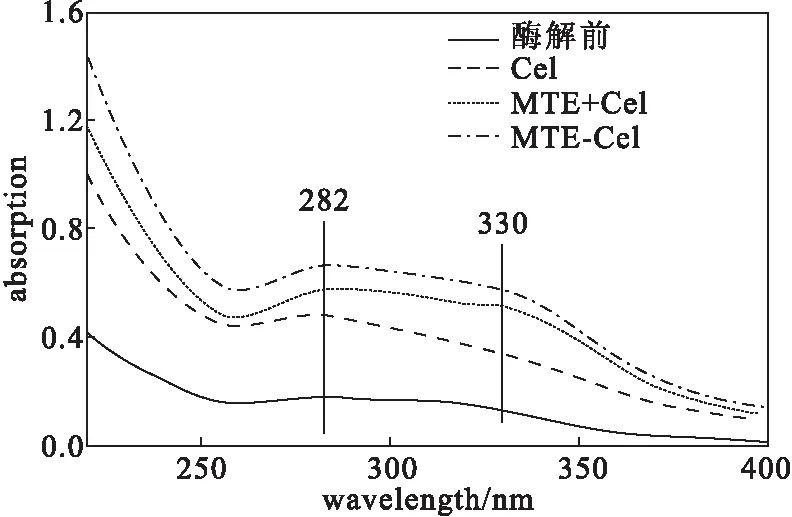
圖3 不同酶解方式下,水熱預處理混合生物質酶解液的UV圖譜
2.4 酶解渣的FTIR分析
不同酶解方式下,水熱預處理混合生物質酶解渣的FTIR圖譜如圖4所示。
從圖4可以看出,3 385 cm-1附近為酚羥基和脂羥基O-H伸縮振動,經過Cel單獨酶解或者經與MTE協同酶解后的相對吸收強度均有所升高,尤其是兩者協同作用下的吸收強度顯著升高;2 925 cm-1附近為甲基亞甲基C-H伸縮振動,經酶解后吸收強度都略有升高;1 645 cm-1處為木質素苯環結構中共軛羰基C=O伸縮振動,經MTE與Cel協同酶解后吸收強度顯著升高,而Cel單獨酶解升幅較小。1 608 cm-1處為芳香核及C=O伸縮振動、1 510 cm-1處為芳香核振動,在3種酶解方式下,1 608 cm-1、1 510 cm-1處吸收強度均有升高,但Cel酶解方式下的增幅明顯低于MTE+Cel和MTE-Cel。這可能是由于,經過酶解后,原料中主要組分是木質素,因此木質素的特征吸收峰均變得更加明顯,且吸收強度明顯升高。1 456 cm-1處為木質素芳香環上的C-H變形振動;1 421~1 423 cm-1處為纖維素-CH2和C-H伸縮振動及芳香環上C-H平面變型振動。1 370~1 380cm-1處為纖維素和木質素中C-H彎曲振動,吸收強度均降低,表明纖維素與木質素間相互作用已被破壞。可以推測,經不同方式酶解后,纖維素與木質素之間的連接均被破壞,從而造成Cel單獨酶解時,因原料中木質素的釋放而引起3 385 cm-1、1 608 cm-1、1 510 cm-1和1 370~1 380 cm-1處吸收強度升高。但是由于MTE中不僅含有木質纖維素分解酶而且還含有少量木質素氧化酶,因此MTE協同酶解時,不僅上述吸收強度會更明顯升高,而且1 645 cm-1處共軛羰基C=O吸收峰顯著升高。1 325~1 330 cm-1處為特有的紫丁香基吸收峰。1 241~1 245 cm-1處為愈創木基環伸縮振動及C=O伸縮振動。1 158~1 169 cm-1和1 034~1 038 cm-1處分別為纖維素和半纖維素的骨架結構中的C-O-C伸縮振動和C-O伸縮振動;895~898 cm-1處為纖維素中葡萄糖環的伸縮振動,經不同方式酶解后,這兩處的相對吸收強度均有不同程度的降低。說明經酶處理后,混合生物質中的纖維素含量降低。
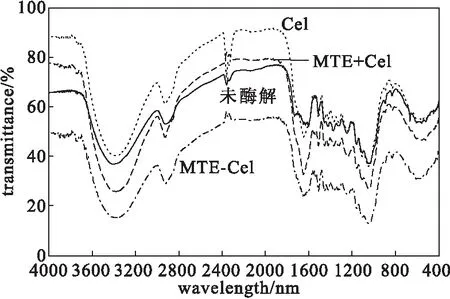
圖4 不同酶解方式下,水熱預處理混合生物質酶解渣的 FTIR圖譜
3 結論
以甘蔗渣-棉桿-小麥秸稈(4∶2∶1,質量比)混合生物質為研究對象,進行了水熱預處理與MTE生物處理協同高效降解的研究,得到以下結論:
(1)水熱預處理溫度是影響混合生物質中各組分含量變化的主要因素,在相近水熱預處理強度下,經150 ℃維溫30 min和180 ℃維溫5 min處理的混合生物質中木質素含量分別為(26.50±1.33)%和(29.40±1.35)%。高溫會導致葡聚糖降解及較高的木質素含量,從而不利于后續混合生物質的酶解。
(2)MTE對Cel具有明顯的協同作用,且受水熱預處理溫度的影響較大。MTE對經160 ℃維溫10 min處理的混合生物質的Cel酶解協同效率最高達(53.60±2.68)%,酶解總糖得率達(75.50±3.77)%。而繼續升高溫度或者延長維溫時間,雖然酶解總糖得率略有升高,但MTE的協同酶解效率快速降低。可見,MTE的協同作用可以降低水熱預處理強度。
(3)UV分析顯示,MTE協同酶解可使酶解液在280 nm和330 nm處的吸收強度顯著升高,結合酶解渣的FTIR光譜分析,推測MTE中豐富的木質纖維素分解酶和木質素氧化酶不僅可以破壞纖維素與木質素之間的連接,而且可直接降解木質素產生具有不飽和共軛結構的可溶性物質,達到減少木質素對Cel的無效吸附,并提高酶解效率的作用。

