鉤端螺旋體引起巨噬細胞炎癥反應的研究
郭卉 董瑤佳 張啟貴 曾令兵
摘要:目的? 研究鉤端螺旋體56601株、JDL03株和JDL10株刺激金黃地鼠腹腔巨噬細胞后炎癥因子的表達情況。方法? 分別采用鉤端螺旋體56601株、JDL03株與JDL10株感染金黃地鼠腹腔巨噬細胞后,取上清,采用ELISA法檢測3個細胞株中TNF-α、IL-1β和IL-6的表達水平。結果? 培養24 h后,感染56601株的金黃地鼠腹腔巨噬細胞中TNF-α、IL-1β和IL-6的表達水平高于感染JDL03株和JDL10株,差異有統計學意義(P<0.05)。結論? 鉤端螺旋體56601株能在巨噬細胞中引起較強的炎癥反應,而JDL03株和JDL10株引起的炎癥反應較輕,可用于后期篩選疫苗靶標。
關鍵詞:鉤端螺旋體;巨噬細胞;炎癥反應
中圖分類號:S855? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標識碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?DOI:10.3969/j.issn.1006-1959.2020.20.016
文章編號:1006-1959(2020)20-0057-03
Study on Leptospira-induced Inflammation of Macrophages
GUO Hui1,DONG Yao-jia2,ZHANG Qi-gui1,ZENG Ling-bing3
(1.Department of Laboratory Medicine,the First People's Hospital of Jiujiang City,Jiujiang 332000,Jiangxi,China;
2.Department of Laboratory Medicine,Jiujiang Maternal and Child Health Hospital,Jiujiang 332000, Jiangxi,China;
3.the First Affiliated Hospital of Nanchang University,Nanchang 330006,Jiangxi,China)
Abstract:Objective? To study the expression of inflammatory factors after Leptospira strain 56601, JDL03 strain and JDL10 strain stimulated the peritoneal macrophages of golden hamster.Methods? After infecting golden hamster peritoneal macrophages with Leptospira 56601, JDL03 and JDL10, the supernatant was taken and the expression of TNF-α, IL-1β and IL-6 in the three cell lines was detected by ELISA level.Results? After 24 h of culture, the expression levels of TNF-α, IL-1β and IL-6 in the peritoneal macrophages of golden hamster infected with 56601 were higher than those infected with JDL03 and JDL10,the difference was statistically significant (P<0.05).Conclusion? The Leptospira 56601 strain could cause a strong inflammatory response in macrophages, while the JDL03 and JDL10 strains cause a milder inflammatory response, which could be used for later screening of vaccine targets.
Key words:Leptospira;Macrophages;Inflammation response
鉤端螺旋體(leptospira)簡稱鉤體,菌體呈細長、螺旋狀,可分為非致病性鉤體(又稱為腐生型鉤體)和致病性鉤體兩大類[1]。生活在天然地表水和土壤中的腐生型鉤體不會導致疾病,而包括問號鉤端螺旋體在內的致病性鉤體能引起人及動物的鉤端螺旋體病[2,3],簡稱鉤體病,是一種全球性的人畜共患病,其在全世界各地都廣泛流行,同時在我國絕大多數地區也都有不同程度的流行,尤以降水量充足的長江中下游地區最為嚴重,是我國重點防治的傳染病之一[4]。鉤體病的臨床表現不盡相同,輕癥患者可只表現為感冒樣癥狀;而重癥患者則可出現肝、腎、肺等多臟器的出血性病變,甚至死亡[5]。目前,在致病性鉤體菌中已發現超過250種血清型,但對于鉤端螺旋體一直都缺乏有效的遺傳操作手段,導致鉤體病的關鍵致病因子還未完全闡明,本文通過研究鉤端螺旋體56601株[6]、JDL03株和JDL10株感染金黃地鼠巨噬細胞后產生的炎癥反應的差異,旨在為進一步探究機體對控制鉤體感染的作用機制及后期篩選疫苗靶標提供參考。
1材料與方法
1.1實驗材料? 問號鉤體56601株、JDL03株和JDL10株由上海交通大學病原生物學教研室提供;EMJH培養基購自美國Sigma公司;酶聯免疫吸附試驗試劑盒如TNF alpha Human ELISA Kit試劑盒、IL-1βHuman ELISA Kit試劑盒和IL-6 Human ELISA Kit試劑盒均購自美國Thermofisher旗下eBioscience公司;主要儀器包括細胞培養箱、科華320全自動酶標儀等。
1.2實驗細胞? 實驗細胞的提取:將清潔級金黃地鼠(小鼠6~8 周,雌性,購自上海生物制品所)脫頸椎處死,并浸入75%乙醇中10 s,取出小鼠并瀝干,將其仰臥于不銹鋼方盤上,用注射器吸6 ml生理鹽水注入腹腔中,輕揉小鼠腹部2 min,使液體在腹腔內充分流動,用眼科鑷提起小鼠下腹皮膚,使小鼠微傾向一側,剪開腹部皮膚后在肌肉層剪開一個小口,用膠頭滴管將腹腔液吸出轉入離心管中。每只吸出量約4~5 ml。
1.3實驗細胞的培養? 在4 ℃條件下,將收集的清潔級金黃地鼠腹腔灌洗液以1000 r/min離心10 min,去上清液,加入高糖DMEM細胞培養液用細胞板計數。顯微鏡下計數巨噬細胞,調整細胞濃度至所需,接種至細胞培養瓶,37 ℃培養箱孵育4 h,充分貼壁后棄上清液,除去非粘附細胞再加入高糖DMEM細胞培養液,放回培養箱中培養備用[6]。
1.4方法? 取鉤端螺旋體56601株、JDL03株和JDL10株接種于EMJH培養基中[7],28 ℃培養5~7 d后將處于對數生長期的鉤體于室溫下8000 r/min離心15 min,用無菌PBS液重懸后在暗視野顯微鏡下計數,調整細胞數量為1×108個/ml。雌性金黃地鼠腹腔注射1 ml 5%巰基乙酸鈉溶液,5 d后提取小鼠腹腔巨噬細胞。將小鼠腹腔巨噬細胞1×105個接種于96孔板中,過夜培養[8]。將處于對數生長期的鉤體以MOI=100:1感染細胞,同時另將無菌PBS液0.1 ml加入已接種小鼠腹腔巨噬細胞的96孔板中作為對照組,24 h后取上清,分別用ELISA試劑盒檢測上清中的TNF-α、IL-1β和IL-6水平[9],所有操作步驟均嚴格按照試劑盒說明書進行。
1.5統計學方法? 所有研究數據均采用SPSS 25.0統計分析軟件、GraphPad Prism 8統計分析和作圖軟件處理,計量數據采用(x±s)表示,行t檢驗,P<0.05表示差異有統計學意義。
2結果
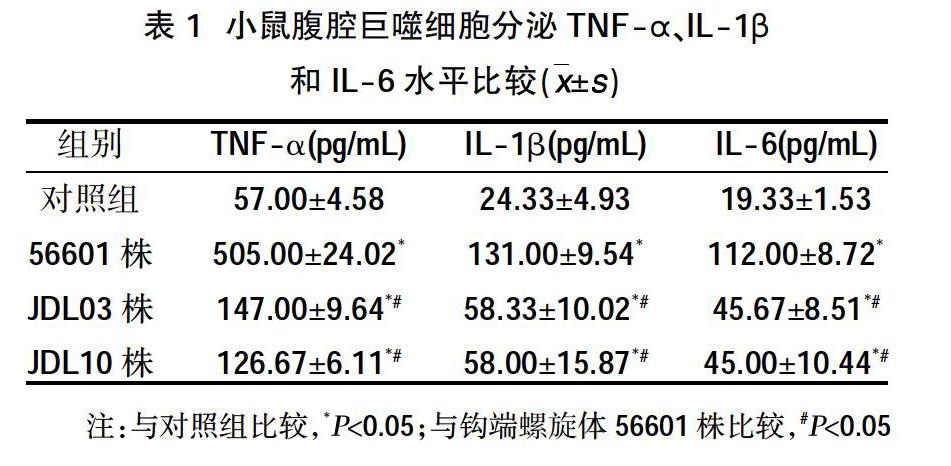
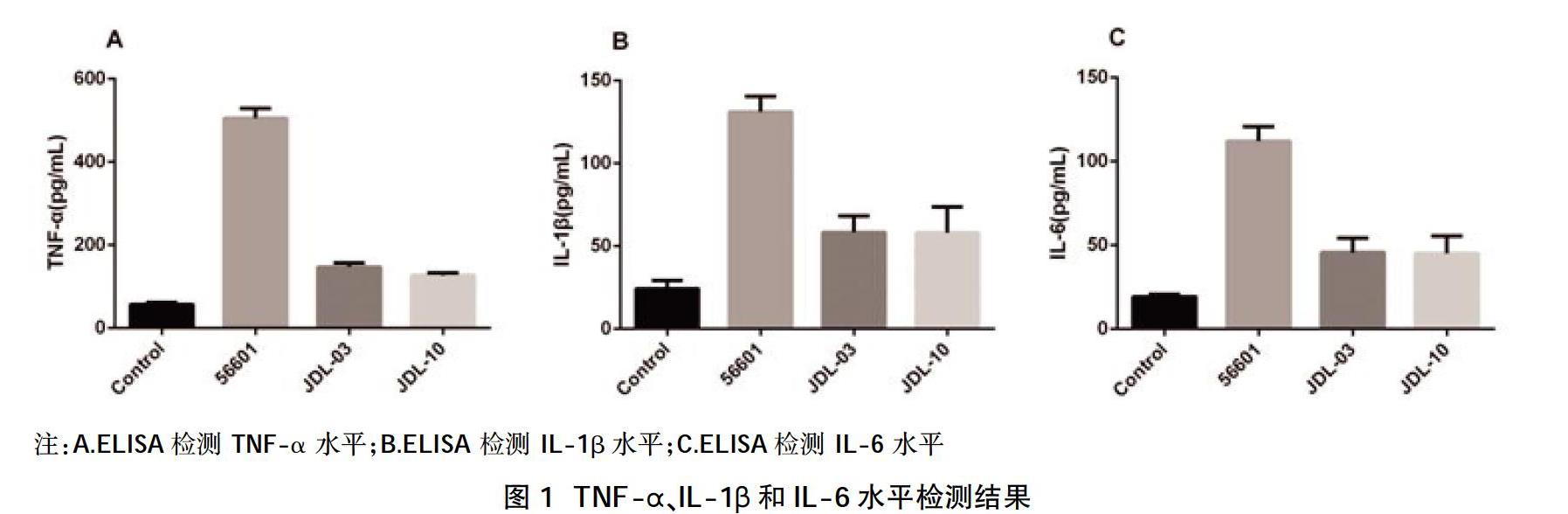
鉤端螺旋體56601株、JDL03株和JDL10株感染小鼠腹腔巨噬細胞24 h后TNF-α水平均高于對照組,差異有統計學意義(P<0.05);且56601株感染巨噬細胞分泌的TNF-α高于JDL03株和JDL10株,差異有統計學意義(P<0.05);各株螺旋體刺激巨噬細胞產生的IL-1β、IL-6水平高于對照組,且56601株誘導的IL-1β、IL-6水平高于JDL03株和JDL10株,差異均有統計學意義(P<0.05);另外,DL03株和JDL10株感染小鼠腹腔巨噬細胞24 h后TNF-α、IL-1β和IL-6水平比較,差異無統計學意義(P>0.05);見表1、圖1。
3討論
鉤端螺旋體病是由致病性鉤端螺旋體引起的威脅人類健康和畜牧業生產的常見人獸共患病。鉤體病在77 個國家和地區已經有過報道,尤以水稻種植為主的廣大發展中國家更為盛行。目前,鉤體病每年約有500000 例的病例報道,致死率約10%。鉤體病的臨床癥狀可表現為輕重緩急不一;輕癥患者可只表現為感冒樣癥狀,而重者可出現肝、腎、肺等多臟器功能衰竭,甚至死亡。我國也是鉤體病的高發地區之一,主要集中在降水量相對充足的長江中下游地區,如江西省、湖北省、四川省等省份[4]。自80年代后,我國鉤體病的發病率雖然處于逐年下降的趨勢,但是鉤體病疫區常常隨著洪水季節的到來而出現爆發疫點。世界衛生組(WHO)為此建立了一系列的鉤體研究組織,對鉤端螺旋體的致病機制、疫苗和診斷靶點的開發等進行更加深入的研究[10]。近年來關于鉤體和鉤體病的相關報道在逐年增加。然而,由于一系列技術上的局限性,鉤體的研究一直缺乏一套行之有效的遺傳操作手段;在其他致病菌中普遍的體內遺傳操作,都難以在致病性鉤體中實現,導致了鉤體病的致病機制到目前為止還未完全闡明,從而阻礙了鉤體病高效安全疫苗的開發和防治。
感染致病性鉤端螺旋體的人表現出從無癥狀到嚴重或致命疾病的多種臨床表現。盡管目前鉤端螺旋體可以用分子生物學技術分為不同的種類,但用血清學方法分類仍然是常用的方法[11,12]。目前已報道的致病性血清型超過250種,不同血清型是否能引起不同程度的疾病仍存在疑問,鉤端螺旋體引起不同程度癥狀的能力可能涉及多種因素,如生物體的毒性和數量以及宿主因素等。對于鉤端螺旋體也一直都缺乏有效的遺傳操作手段,導致鉤體病因尚未完全闡明,其診斷和疫苗也缺乏有效的免疫靶標[11]。巨噬細胞能夠參與機體的特異性和非特異性的免疫反應,當機體出現受損的組織或者細胞時,巨噬細胞能夠分泌多種細胞因子[13,14]。目前已有許多不同鉤端螺旋體毒株誘發巨噬細胞分泌細胞因子的相關研究[15]。
TNF-α是一種能夠調節細胞生長、分化、誘發炎癥并調控細胞凋亡的細胞因子,它是整個炎癥反應過程中最早產生的諸多細胞因子之一,其主要由激活的單核細胞和巨噬細胞產生,它的產生可以誘導和促進B淋巴細胞和T淋巴細胞產生抗體,進而引起炎癥反應。有許多的研究表明很多疾病的進展都和高水平的TNF-α生物活性相關[10]。IL-1β是一種由巨噬細胞產生的參與炎癥反應的重要介質,它是誘發炎癥反應的過程中一個主要環節,IL-1β有著極其重要的生物學功能,主要參與抗原呈遞、細胞生長、炎性反應等過程。局部低濃度的IL-1β可以促進T細胞的活化,誘導B細胞的增殖和抗體分泌[16]。IL-6是一種能夠廣泛參與機體免疫反應的細胞因子,其主要由纖維母細胞、單核/巨噬細胞、T淋巴細胞、B淋巴細胞、上皮細胞、角質細胞、以及多種瘤細胞所分泌產生,并且能夠刺激參與免疫反應的細胞增殖、分化并提高其功能[17]。本次研究結果顯示,對照組以及鉤端螺旋體56601株、JDL03株和JDL10株均能夠刺激小鼠腹腔巨噬細胞產生TNF-α、IL-1β和IL-6,其中對照組產生的TNF-α、IL-1β和IL-6的水平較低;感染56601株的巨噬細胞產生的TNF-α、IL-1β和IL-6的水平高于感染JDL03株和JDL10株以及對照組的水平,差異有統計學意義(P<0.05);而感染JDL03株和JDL10株的小鼠腹腔巨噬細胞所產生的TNF-α、IL-1β和IL-6的水平比較,差異無統計學意義(P>0.05);說明鉤端螺旋體56601株的毒力強于JDL03株和JDL10株,而鉤端螺旋體JDL03株與JDL10株之間的毒力差異不顯著。此結果為研究鉤端螺旋體56601株的表面暴露蛋白質組和后期篩選問號鉤端螺旋體保守的表面抗原,并對其進行相應的保護性驗證,以及為問號鉤體免疫靶標的篩選[18]提供一定的依據。
綜上所述,鉤端螺旋體56601株能在巨噬細胞中引起較強的炎癥反應,而JDL03株和JDL10株引起的炎癥反應較輕,可用于后期篩選疫苗靶標。
參考文獻:
[1]Adler B.History of Leptospirosis and Leptospira[J].Current Topics in Microbiology&Immunology,2015(387):1.
[2]Fernandes LG,Siqueira GH,Teixeira ARF,et al.Leptospira spp:Novel insights into host-pathogen interactions[J].Veterinary Immunology&Immunopathology,2015:S0165242715300271.
[3]Levett PN.Leptospirosis[J].Clinical Microbiology Reviews,2001,14(2):296.
[4]羅依惠,吳亦斐,Munyampundu JP.問號鉤端螺旋體過氧化物還原酶AhpC在氧化應激中的功能研究[J].中華微生物學和免疫學雜志,2018,38(3):193-198.
[5]聶志文,梁振山,曾令兵.問號鉤體56601株外分泌蛋白功能研究[J].實驗與檢驗醫學,2015(2):8-10,17.
[6]范仕郡,劉鑫,黃敏,等.小鼠腹腔巨噬細胞的快速提取及培養[J].局解手術學雜志,2015,24(2):8,130-131.
[7]潘敏楠,徐國英.鉤端螺旋體EMJH培養基實驗室應用[J].中國人獸共患病學報,2020(4):317-319.
[8]范霞,夏碧麗,呂霖,等.小鼠巨噬細胞對鉤端螺旋體56606v和56606a的吞噬及炎癥應答的比較研究[J].上海交通大學學報(醫學版),2019,39(1):26-30.
[9]Aurélie M,Djelouadji Z,Lattard V,et al.Overview of laboratory methods to diagnose Leptospirosis and to identify and to type leptospires[J].International Microbiology the Official Journal of the Spanish Society for Microbiology,2017,20(4):184.
[10]Garcia LE,de Araújo Junior EC,Melo LM,et al.Characterization of the microtranscriptome of macrophages infected with virulent,attenuated and saprophyte strains of Leptospira spp[J].Plos Neglected Tropical Diseases,2018,12(7):e0006621.
[11]Zeng LB,Zhuang XR,Huang LL,et al.Comparative subproteome analysis of three representative Leptospira interrogans vaccine strains reveals cross-reactive antigens and novel virulence determinants[J].J Proteomics,2015(112):27-37.
[12]Zeng L,Zhang Y,Zhu Y,et al.Extracellular proteome analysis of Leptospira interrogans serovar Lai[J].OMICS,2013,17(10):527-535.
[13]Cagliero J,Villanueva S,Matsui M.Leptospirosis Pathophysiology:Into the Storm of Cytokines[J].Front Cell Infect Microbiol,2018(8):204.
[14]Domingos RH,Pavanel EB,Nakajima E,et al.Resistance of mice to Leptospira infection and correlation with chemokine response[J].Immunobiology,2017,222(11):1004-1013.
[15]王銘,陳紅,劉英,等.問號鉤端螺旋體對THP-1和J774A.1細胞NLRP3炎癥小體活化的影響[J].中華微生物學和免疫學雜志,2016,36(12):894-899.
[16]Silva P,Lauretti-Ferreira F,Caldas DLM,et al.Phagocytosis of Leptospira by leukocytes from mice with different susceptibility to leptospirosis and possible role of chemokines[J].BMC Microbiol,2019,19(1):4.
[17]Hirano S,Zhou Q,Furuyama A,et al.Differential Regulation of IL-1beta and IL-6 Release in Murine Macrophages[J].Inflammation,2017,40(6):1933-1943.
[18]Nancy C,Emilia S,María FF,et al.Leptospira species promote a pro-inflammatory phenotype in human neutrophils[J].Cellular Microbiology,2019,21(2):e12990.
收稿日期:2020-05-26;修回日期:2020-06-08
編輯/錢洪飛

