胚源性IL-1β與人類胚胎發育及種植的關系
朱序理,趙志明,曹金鳳,杜元杰,周 亮,王 躍
(河北醫科大學第二醫院生殖醫學科,河北 石家莊 050000)
白細胞介素1β(interleukin-1β,IL-1β)細胞因子,具有多種細胞效應,包括促進生長、抑制生長和參與細胞分化及炎癥的發生。早在1996年,一些學者通過免疫組織化學方法證明了胚胎中存在IL-1系統[1],在小鼠體內,用IL-1受體拮抗劑(IL-1 receptor antagonist,IL-1ra)阻斷IL-1 I型受體(IL-1 receptor type I, IL-1RtI),可阻斷胚胎著床[2],且IL-1β可觸發子宮內膜產生IL-8,從而促進內膜造血細胞的增殖和存活[3]。本研究通過檢測卵裂期移植胚胎培養液中IL-1β水平,探討其是否能反映胚胎的生長發育及植入情況,并與胚胎形態學累積評分進行相關性研究,以提供更客觀和準確的分子標記物輔助形態學選擇胚胎進行移植。
1 資 料 與 方 法
1.1一般資料 選取2017年10—12月在河北醫科大學第二醫院生殖醫學科行卵胞漿內單精子顯微注射-胚胎移植(intracytoplasmic sperm injection-embryo transfer,ICSI-ET)手術的新鮮周期不孕患者80例,女方年齡均≤35歲,全部為首次移植,采用單液滴單胚胎培養,取卵受精后第3天移植,首選形態學評估最優質的胚胎移植,且同時移植2枚胚胎,卵裂期培養液為同一批號。
1.2分組 胚胎移植4周后,確認臨床妊娠,然后將根據每周期胚胎種植率分為A組43例、B組27例和C組10例,3組種植率分別為0%、50%和100%。
1.3儀器與耗材 培養箱為日本SANYO或美國Thermo CO2培養箱,胚胎培養體系為瑞典Vitrolife公司生產的G5系列培養液,人類IL-1β檢測試劑盒(Multisciences,中國杭州聯科生物公司生產),胚胎培養皿為美國B.D公司生產。
1.4實驗方法
1.4.1標本收集 常規授精(17±1)h后,將受精卵洗滌后分別轉移至新配制的卵裂期培養液(vitrolife,G1)培養皿中(培養皿制作,每微滴定量為30 μL,覆蓋礦物油,平衡>8 h),觀察同時記錄受精情況后,在37 ℃,6%CO2單氣培養箱內進行培養。受精后第3天,即胚胎在G1培養液中培養(51±1) h后采用倒置顯微鏡觀察,根據胚胎實驗室常規形態學標準,即按細胞數、均一度、碎片等挑選2枚形態學觀察較好的胚胎進行移植。可利用胚胎轉移后及時把培養皿放置常溫操作臺上,用巴斯德吸管去除液滴周圍礦物油后,液滴表面礦物油自由脫落,然后及時吸取移植胚胎的G1培養液滴,裝入0.2 mL EP管后混勻,離心(2 500 r/min,5 min)后取上清,編號,置于-80 ℃冷凍保存待測。空白對照組為在相同條件下未放置胚胎的G1培養液。
1.4.2臨床妊娠情況確認 在胚胎移植手術后14 d,檢測血清人絨毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)水平,呈陽性的患者可考慮成功植入,移植后4周通過超聲見到心血管搏動,確認為臨床妊娠,并根據妊娠孕囊數等確認種植數。種植率=種植數/移植胚胎數×100%。
1.4.3檢測方法 采用酶聯免疫吸附測定法檢測IL-1β在胚胎培養液中的水平。首先在酶標微孔板中加入倍比稀釋的標準品及IL-1β待測樣品,然后,將生物素標記抗體加入每孔中,室溫孵育;洗滌后,加入標記親和素工作液進行孵育;每孔加顯色底物避光孵育,后進行終止反應,用酶標儀進行雙波長測定,測定各孔在450 nm最大吸收波長下的OD值。最后根據標準品濃度和相應OD值繪制線性回歸曲線,通過曲線方程計算試樣濃度。
1.4.4記錄臨床相關參數 詳細記錄夫婦雙方年齡(歲)、不孕年限(年)、體重指數、促性腺激素(gonadotropin,Gn)時間(d)、Gn總量(U)、HCG日血雌二醇(estradiol,E2)水平(ng/L)、內膜厚度(mm)及臨床妊娠結局等資料。
1.4.5記錄胚胎實驗室相關資料 詳細記錄獲卵數、卵胞漿內單精子顯微注射(intracytoplasmic sperm injection,ICSI)卵數、雙原核(2 pro nucleus,2PN)數、2PN卵裂數、冷凍胚胎數、移植胚胎形態學評分等。
1.4.6移植前胚胎形態學評分標準[4]評分規則:①胚胎細胞數為基礎分值,大于8記8分;②碎片分Ⅰ、Ⅱ、Ⅲ、Ⅳ四級,Ⅰ級(0%~5%的碎片)減1分,Ⅱ級(6%~20%的碎片)減2分,Ⅲ級(21%~50%的碎片)減3分,Ⅳ級(>50%的碎片)減4分;③細胞大小相對均勻加0.4分;④胚胎細胞形狀正常加0.4分;⑤半融合或融合胚胎加0.4分;⑥胞質沒有異常加0.4分;⑦滿分為10分。
1.5統計學方法 應用SPSS 26.0統計軟件分析數據。計量資料比較采用單因素方差分析和SNK-q檢驗,計數資料比較采用χ2檢驗,相關性分析采用Person檢驗。P<0.05為差異有統計學意義。
2 結 果
入組80例患者中臨床妊娠37例,臨床妊娠率為46.3%,其中單胎妊娠27例,雙胎妊娠10例。
2.13組主要相關臨床資料比較 3組女方年齡、不孕年限、體重指數、Gn時間、Gn總量、HCG日血E2水平、內膜厚度差異均無統計學意義(P>0.05)。見表1。
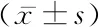
表1 3組臨床資料比較
2.23組實驗室資料比較 3組獲卵數、ICSI卵數、2PN率、2PN卵裂率、可移植胚胎數(移植數+冷凍胚數)、≥8細胞的胚胎數差異均無統計學意義(P>0.05)。見表2。
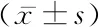
表2 3組實驗室資料比較
2.33組胚源性IL-1β水平、胚胎形態學累積評分比較 B組IL-1β水平高于A組,C組IL-1β水平高于A組和B組,差異有統計學意義(P<0.05);3組移植胚胎形態學累積評分差異無統計學意義(P>0.05)。見表3。
2.4胚胎培養液中內源性IL-1β水平與胚胎形態學累積評分的關系 胚胎培養液中IL-1β隨胚胎形態學累積評分的升高而增高,2個變量呈正相關(r=0.587,P<0.05)。
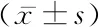
表3 3組IL-1β水平與胚胎形態學累積評分比較
3 討 論
目前,體外受精是治療不孕癥的主要方法,通過收集卵母細胞在體外與精子受精,受精后的胚胎移植前在小滴培養液中培養,然后根據形態學評估移植2~3個最優質的胚胎。然而,隨著體外培養技術的發展,臨床妊娠率不斷提高,多胎妊娠率也隨之增加,而多胎妊娠會增加產科并發癥等風險[5-6],因此,目前許多研究在探索施行單胚胎移植的可行性及最優方法[7-9]。2018年,專家一致認為,通過減少胚胎移植數量,將中國體外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)的多胎發生率降至20%以下[10]。因此,在保證臨床妊娠的同時,選擇最優質的胚胎進行移植,減少多胎的發生是各生殖中心面臨的挑戰。且在輔助生殖過程中有一個主要問題是為什么反復進行體外受精并移植明顯質量良好的胚胎而未發生妊娠,這一令人困惑的植入失敗是當前研究的一個方向。常規的胚胎形態學評分存在主觀因素不能充分反映胚胎的發育潛能。為了進一步鑒定胚胎發育,通過對胚胎培養液中胚源性物質的無創檢測來預測胚胎發育及植入潛能將是一種很有效的方法[11-13]。
在胚胎體外培養和植入過程中,多種細胞因子以自分泌和旁分泌的方式被分泌,這些細胞因子與其相應受體結合調控胚胎的增殖與分化,且參與信號傳導使胚胎與子宮內膜相互作用,從而影響胚胎移植的臨床結局[14-15]。胚胎的發育及著床和腫瘤生長浸潤有很大的相似性,目前IL-1系統在腫瘤基礎研究中有了更清楚的認識,而且在治療中得到了應用且日漸成熟[16-18],因此IL-1系統在生殖領域的研究可能有著重要的臨床價值。
IL-1β是IL-1系統中最具有生物活性的亞型之一,與生殖活動密切相關[19]。因胚胎植入對于母體屬半同種異體移植,以往認為主要處于免疫抑制,但近年研究發現成功的胚胎植入和隨后的妊娠進展需要在促炎和抗炎信號之間實現更為復雜的平衡[20]。Kreines等[21]研究發現,在持續妊娠和最后活產的婦女中,IL-1β的血清水平隨著時間的推移而升高,但對于隨后發生妊娠丟失的患者血清IL-1β水平并沒有升高;進行胚胎移植的婦女中發現IL-1β水平與成功妊娠具有正相關;在妊娠試驗陽性患者中,如果未檢測到血清IL-1β者和后續的妊娠丟失相關。因此,證實了在體外受精周期血清IL-1β與妊娠結局有明顯相關性,并可對預后進行預測。胚胎發育和植入的成功是一個相對復雜的事件,涉及到母體與胚胎之間的信號對話。
近年研究表明,在體外受精輔助生殖過程中,胚胎培養液IL-1β水平與妊娠率呈正相關[22-24]。在這些研究中,測定胚胎培養液IL-1β水平時,酶聯免疫吸附測定是主要的檢測方法;要求樣品體積至少為50 μL,這就是要有足夠的樣品體積;因此來自多個胚胎的所用培養液通常聚集起來用于測量細胞因子,而檢測的結果成為多個胚胎的平均值,而不是僅來自單個移植胚胎的培養液。因此,如何在微量的胚胎培養液中可靠地檢測細胞因子來預測胚胎發育潛力仍然是一個挑戰。
本研究采用單液滴單胚胎培養,微滴定量為30 μL,檢測2枚移植胚胎的培養液,能較好地反映移植胚胎的IL-1β水平。入組樣本來自行ICSI患者,相對減少了顆粒細胞,精子異源性物質的干擾。在收集過程中,培養皿中的礦物油首先被移除,從而微滴表面礦物油會自由下落,液滴完全暴露出來,并迅速收集,以減少礦物油對結果的影響。根據種植率分為3組,結果顯示,3組IL-1β水平有顯著差異,胚胎培養液中IL-1β的水平與胚胎形態學累積評分作相關分析,結果表明,IL-1β表達隨胚胎評分的升高而增高,2個變量呈正相關,這些共同提示胚胎培養液中胚源性IL-1β與胚胎發育及著床潛能密切相關。然而,由于酶聯免疫法檢測技術的有限性以及培養液微量的限制,本研究中共有5例未檢測到IL-1β,因此探索一種更有效的檢測微量IL-1β濃度的方法是一個重要的研究方向。
近年來,在胚胎體外培養過程中,胚胎內源性相關的細胞因子相繼被發現,其分泌量能夠客觀地反映胚胎發育情況[25-27]。通過胚胎培養液中分泌的細胞因子的測定,可全面、客觀、準確、無創地反映胚胎的發育植入潛能,比胚胎形態學觀察更全面、更準確地預測胚胎移植后的臨床結局。傳統的形態學只能反映某一時間的胚胎情況,而細胞因子可反映時間段的胚胎情況,更能預測胚胎走勢。因此,胚胎培養液中IL-1β水平能反映胚胎的發育潛能,可作為挑選優質胚胎的另一個重要參考指標。測定培養液中IL-1β水平與形態學觀察聯合應用,將有可能選擇出發育潛能最優的胚胎用于移植,為廣泛實行單胚胎移植提供技術支持,保證妊娠率的同時降低多胎風險,對輔助生殖臨床工作有重要的指導意義。但目前酶聯免疫法檢測IL-1β時間相對較長,且評估指標的敏感度和特異度需要進一步研究證實,因此,應用于臨床相對于形態學評分沒有明顯優勢,但隨著檢驗技術的不斷發展,如利用芯片微流控技術測細胞因子方法探索[28],質譜等技術平臺的完善,將實現快速準確地檢測胚胎培養液中IL-1β等細胞因子濃度,為胚胎評估提供新的參數,輔助形態學觀察。

