利用菊糖生產L-乳酸的菌株篩選鑒定和發酵工藝優化
黃玉龍,孫若詩,全婷,劉燕,慕鈺文,康三江,張輝元*
1(甘肅省農業科學院農產品貯藏加工研究所,甘肅省果蔬貯藏加工技術創新中心,甘肅 蘭州,730070) 2(西北師范大學 生命科學學院,甘肅特色植物有效成分制品工程技術研究中心,甘肅 蘭州,730070)
菊芋(HelianthustuberosusL.),從17世紀由歐洲傳入中國,又稱為洋姜、鬼子姜,菊科向日葵屬,為多年生宿根性草本植物。菊芋生長高度在1~3 m不等,秋季開花,花如菊,黃色。葉子橢圓形,多毛。根莖系統深埋于地下并且比較結實粗壯,葉子互生于莖的頂端,中央是花頭,多瘤的塊莖在地下不均勻生長,其顏色有淺褐色、白色、紅色等[1]。目前,國內已有對菊芋莖葉中活性成分、藥理機制的相關報道[2],大多關于菊芋的研究以菊糖的提取、酶解工藝為主[3-4]。菊芋作為一種潛在的生物資源,其酶解產物可作為生物基化合物如乙醇、丁醇、丁酸、2,3-丁二醇、檸檬酸、乳酸等的生產原料[5-6]。國內外對L-乳酸的需求日趨增加,我國人多地少,糧食資源匱乏,進行以廉價非糧原料生產L-乳酸的研究顯得尤為重要[7-8]。本文通過MRS改良培養基篩選產乳酸含量高的菌株,并對該菌株進行形態學及基因序列分析法鑒定[9],采用單因素和正交實驗對其產乳酸發酵基質和培養條件進行系統研究,得出以菊糖酶解液發酵L-乳酸的最優工藝條件,旨在為菊芋的高值化開發提供一定的技術支撐。
1 材料與方法
1.1 材料與試劑
新鮮菊芋,購于甘肅蘭州,紅皮,肉質塊莖。
菊糖酶解液:按液料比18∶1(mL∶g)于86 ℃下提取41 min的熱水浸提工藝制取菊芋汁,水提液過濾后得菊糖汁;在菊糖汁中添加酵母膏氮源1.0%(體積分數),NaCl 0.5%(體積分數),K2HPO40.3%(體積分數),菊糖汁定容,初始pH6,經黑曲霉(Aspergillusniger) A-15在30 ℃下搖瓶發酵6 d,即為菊糖酶解液。菊芋汁中還原糖質量濃度從酶解前的0.997 g/L提高到酶解后的24.22 g/L。
菌種來源:本實驗室保藏的菌種,編號依次為G、A2、A4、zh。
蛋白胨,上海中泰;牛肉浸膏,北京雙旋;酵母膏,北京奧博星;檸檬酸氫二銨,天津凱通;K2HPO4,天津市北辰方工試劑廠;MnSO4、成都化學試劑廠;MgSO4、CH3COONa,中國醫藥公司;Tween-80、TE緩沖液、Marker、ddH2O等,革蘭氏染色成套試劑,北京索萊寶。其他試劑均為市售分析純或生物試劑。
1.2 儀器與設備
9700聚合酶鏈式反應(polymerase chain reaction,PCR) System,GeneAmp;SBA-40D生物傳感分析儀,山東省科學院生物研究所;PHS-3C精密pH計,上海虹益儀器儀表有限公司;WZZ-2B自動旋光儀,上海精密科學儀器有限公司;Ultimate3000高效液相色譜儀,紫外檢測器,DIONEX。
1.3 培養基
種子培養基為MRS肉湯培養基。
溶鈣圈培養基:在MRS培養基中加入2%的CaCO3,1.5%(質量分數)的瓊脂粉,pH值自然。1×105Pa滅菌15 min。
發酵培養基:依實驗設計加入各成分,菊糖酶解液定容,調pH值。1×105Pa滅菌15 min。250 mL錐形瓶搖瓶厭氧發酵,裝量50 mL。
1.4 實驗方法
1.4.1 菌株的初篩
將本實驗室保藏的4株產乳酸菌株,接入到MRS基礎培養基中,以30 g/L果糖代替葡萄糖作為單一碳源進行發酵實驗,36 ℃,發酵96 h后測定發酵液中乳酸產量,選擇將果糖轉化為乳酸產率較高的菌株,計算如公式(1)所示:

(1)
1.4.2 菌株的鑒定
參考文獻[10-11]方法,根據篩選試驗所選菌株,通過菌落形態觀察和基因序列分析對菌株進行分類鑒定[12-13]。
(1)待鑒定菌株PCR的DNA模板的制備(反復凍融法):100 ℃煮沸5 min,-20 ℃下冷凍5 min,循環2次;上述樣品5 000 r/min條件下離心1 min,吸取8 μL上清液即為PCR擴增的DNA模板。
(2)待鑒定菌株16S rDNA的擴增:以提取的DNA為模板,使用細菌16S rDNA通用引物P1(1 492r)、P2(27F)進行擴增。
反應體系總體積50 μL:模板5 μL、Primer 1[1 μL(1 μmol/L)]、Primer 2[1 μL(1 μmol/L)]、Taq酶25 μL、ddH2O 18 μL;PCR擴增程序:95 ℃預變性5 min、94 ℃變性30 s、58 ℃退火1 min、72 ℃延伸 2 min,30個循環;72 ℃延伸 10 min;4 ℃ 保存。
(3)瓊脂糖凝膠電泳,點樣量3 μL。
1.4.3 乳酸含量的測定
發酵液離心后取上清液,蒸餾水適當稀釋,采用SBA-40D型生物傳感自動分析儀測定乳酸含量[14-15]。
1.4.4 產乳酸條件優化
利用微生物產乳酸的過程通常為厭氧發酵,影響乳酸產量較顯著的因素有K2HPO4、MnSO4、CH3COONa、接種量、培養時間、培養溫度、pH值和氮源種類等[16-17]。以乳酸產量為考察指標,對上述因素分別進行單因素實驗,并選取影響較顯著的因素,采用4因素3水平正交試驗,探究其對發酵培養基中乳酸產量的影響水平。
1.4.5 乳酸的粗制及旋光度的測定
成熟的乳酸發酵液,煮沸后用石灰乳調pH值為9.5~10,攪拌后55 ℃靜置4 h,沉降菌體等懸浮物;趁熱過濾得乳酸鈣溶液,減壓濃縮至25%,用50%(體積分數)的H2SO4在80 ℃條件下酸解乳酸鈣,中和完全后,靜置1~2 h;減壓抽濾除去CaSO4得粗乳酸[18]。
粗制乳酸旋光度的測定:測定溫度為20 ℃,測定管長度為10 cm,乳酸質量濃度7.5 g/L,在589.44 nm鈉單色光源下,測定樣品的旋光度[19]。
1.4.6L-乳酸和D-乳酸的測定
采用高效液相色譜法測定,色譜柱為Silversit C18,250 mm×4.6 mm×5 μm,流速0.5 mL/min,紫外檢測波長210 nm,進樣量20 μL,流動相為V(水)∶V(乙腈)=99.5∶0.5,柱溫30 ℃。
樣品預處理:取適量發酵液于50 mL離心管中,在4 ℃條件下8 000 r/min離心10 min,以除去CaCO3和菌體,取離心后的上清液,再加入等體積0.5 mol/L的H2SO4水溶液進行酸解,離心除去CaSO4,取1 mL上清液經適當稀釋后,再以0.45 μm的濾膜過濾即得待測液。乳酸標樣在上述色譜條件下經高效液相色譜分析。
2 結果與分析
2.1 可利用果糖的乳酸菌株的篩選
將4株產乳酸菌株以果糖為單一碳源,MRS培養基中發酵96 h測定發酵液的乳酸產量并計算果糖轉化率,結果如表1所示,編號為zh的菌株在4株菌中乳酸產量較高(41 mg/100mL),且在此過程中果糖的轉化率達到68.3%。因此選取zh菌株進行菌種鑒定和產乳酸條件優化。

表1 不同菌株對果糖的利用率Table 1 Utilization of fructose by different strains
2.2 菌株zh的鑒定及產乳酸條件優化
2.2.1 菌株zh的鑒定
通過菌落形態觀察(圖1-a)菌株zh在平板培養基上,菌落邊緣呈不規則雪花狀,中等大小,中間略有微小球狀突起,微黃色,邊緣濕潤,乳白色,直徑為(10±3) mm,菌落背面為乳黃色,實心菌落且生長旺盛。
對培養3 d的種子菌株zh進行革蘭氏染色,鏡檢結果圖1-b所示,顯示為紫色桿狀,革蘭氏染色呈陽性,故其為G+。
溶鈣圈實驗:在溶鈣圈固體培養基中接入菌株zh,36 ℃培養5 d后,結果如圖1-c所示,在菌落周圍有明顯的透明圈,判定菌株zh可能為乳酸菌。

a-菌落形態;b-革蘭氏染色;c-溶鈣圈圖1 菌株zh鑒定Fig.1 Strain zh identification
過氧化氫酶反應:反應無氣泡產生,結果呈陰性。
糖發酵試驗:反應結果如表2所示,菌株zh可發酵的糖類有乳糖苷、纖維二糖、山梨醇、葡萄糖和果糖。
綜合菌株zh上述生理生化鑒定結果,根據《伯杰細菌鑒定手冊》第9版,初步判定菌株zh為植物乳桿菌 (Lactobacillusplantarum)。

表2 菌株zh糖發酵試驗結果Table 2 Biochemical identification results of stain zh
分子鑒定:菌株zh的PCR擴增后電泳圖如圖2,對照用Marker條帶范圍是100~5 000 bp,菌株zh的條帶在1 300 bp左右。

圖2 菌株zh的PCR電泳圖Fig.2 PCR electrophoregram of zh
同樣的將PCR擴增產物委托華大基因(北京)測序后,得到序列在GenBank中登錄號為KY368099。將菌株zh的序列結果輸入到NCBI-BLAST數據庫進行比對分析,結果顯示此序列與L.plantarum菌株相似性較高。在NCBI上下載與所測序列有較高相似度(在96%以上)的序列,繪制的系統發育樹如圖3所示,菌株zh與L.plantarum在同一分支上,相似度>99%,最終確定菌株zh為植物乳桿菌(Lactobacillusplantarum)。
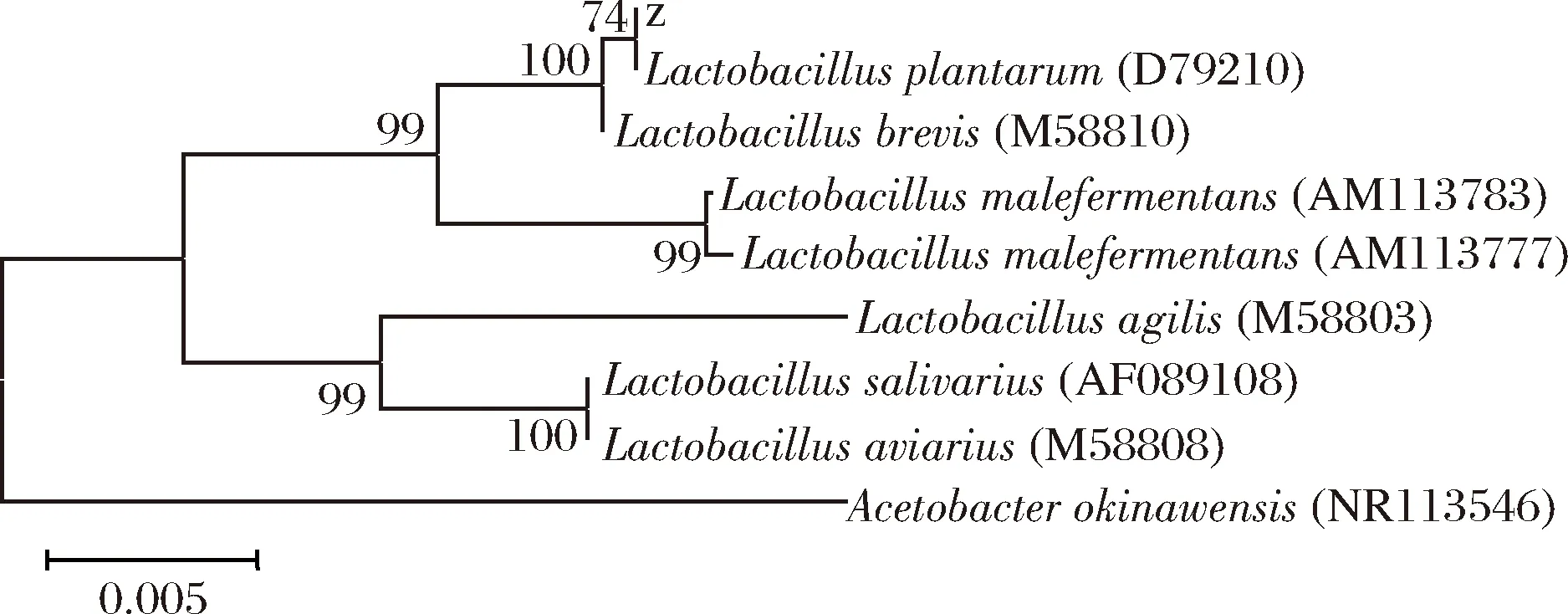
圖3 菌株zh系統發育樹Fig.3 Phylogenetic tree of the strain zh based on 16S rDNA sequences
2.2.2 菌株zh產乳酸條件優化結果與分析
在微生物生長代謝過程中,碳源、氮源、無機鹽、培養時間、溫度等外界因素均對代謝產物的積累產生較大的影響[20]。碳源和氮源為必需營養物質;鹽離子在發酵過程中起緩沖作用;金屬離子作為生長因子,對微生物的生長有促進或抑制作用,例如Mn2+是超氧陰離子和H2O2的清除劑,通過保護菌株免受活性氧的毒害而對菌株的生長產生積極作用;微生物生長依賴于最適溫度和pH值,選擇其生長的最適環境,對目標產物的積累起重要作用[21-22]。
分別以MnSO4、CH3COONa、接種量、培養溫度、pH值和氮源種類作為考察因素,單因素實驗結果如圖4所示。由圖4-a~圖4-d可知,對菌株zh產乳酸量影響較大的因素是MnSO4、CH3COONa、培養溫度和pH值。當這4個因素發生改變時,乳酸的積累量變化顯著,而接種量對其影響較穩定。氮源篩選結果(圖4-f)可知,zh菌株以酵母膏為氮源時,乳酸產量最高。因此在產乳酸條件優化實驗中,培養基的基礎成分以0.6%(質量分數)酵母膏為氮源、接種量2.0%、培養120 h,考察MnSO4、CH3COONa、培養溫度和pH值對乳酸產量的相互影響。
根據正交實驗設計原理,結合單因素實驗結果,選取MnSO4、CH3COONa、培養溫度和pH值這4個因素(表3),進行L9(34)正交實驗,結果見表4,方差分析結果見表5。

表3 菌株zh正交實驗因素水平表Table 3 Factors and levels of orthogonal tests
根據正交試驗結果,影響因素的排序為C>A>D>B,培養溫度對菌株zh產乳酸影響最大,其次是MnSO4添加量和pH值,CH3COONa添加量對其影響最小,優化后的理論工藝參數為A2B2C3D1;方差分析結果表明C影響極顯著,P<0.01;A影響顯著,P<0.05。確定的最優發酵條件為:最佳氮源為酵母膏,氮源質量分數0.6%、MnSO40.6 g/L、CH3COONa 7 g/L、pH 4、接種量2.0%、培養溫度34 ℃,搖瓶發酵120 h,此時菌株zh產乳酸的量可達到13.99 g/100g(菊芋干粉)。
為檢驗試驗結果的可行性,將優化工藝參數進行產乳酸驗證試驗,重復3次取平均值,實際的乳酸產量可達到14.37 g/100g(菊芋干粉),因此菌株zh產乳酸穩定且重復性好。

表4 L9(34)正交試驗結果Table 4 Result s of orthogonal experiment

表5 方差分析結果表Table 5 The results of variance analysis
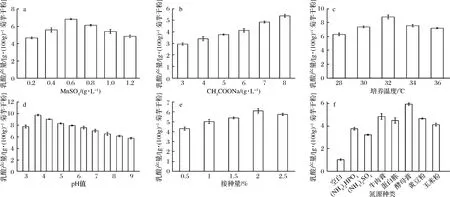
a-MnSO4添加量;b-CH3COONa添加量;c-培養溫度;d-pH值;e-接種量;f-氮源種類圖4 菌株zh產乳酸單因素圖Fig.4 Single factor diagram of lactic acid production by strain zh
2.2.3 旋光度的測定
將粗制所得的乳酸樣品稀釋至7.5 g/L,在589.44 nm鈉單色光源下測定其旋光度,其旋光度平均值為+0.153。L-乳酸旋光度為(+),D-乳酸旋光度為(-),乳酸標樣經高效液相色譜(high performance liquid chromatography,HPLC)進行分析后,其色譜圖如圖5所示,D-乳酸和L-乳酸保留時間分別為3.453 min和4.454 min。由所測樣品旋光度值可初步判斷,本研究中通過菊糖酶解液所得到乳酸為外消旋體[23]。
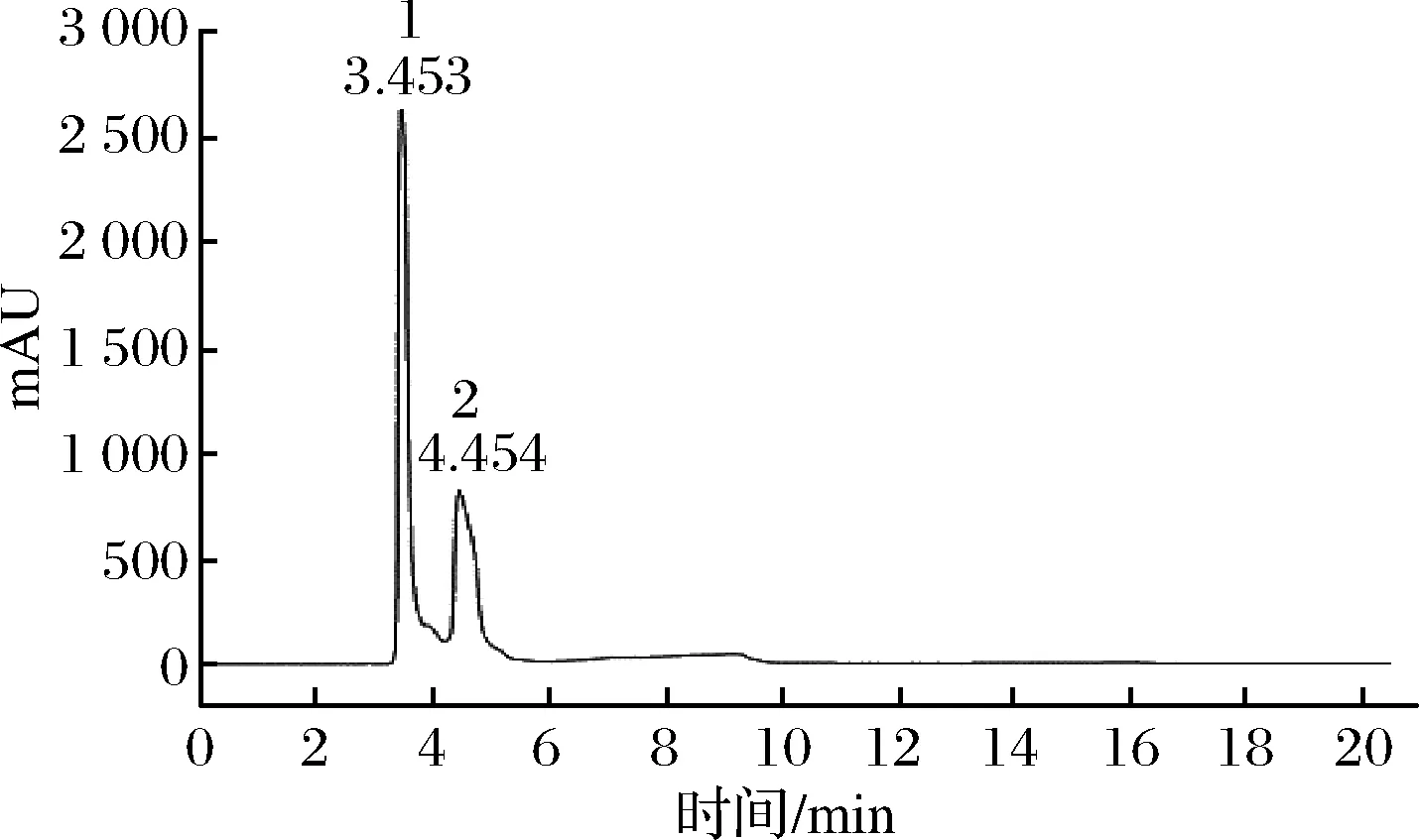
1-D-乳酸;2-L-乳酸圖5 乳酸標準樣品液相色譜圖Fig.5 The HPLC chromatogram of lactic acid standard
3 結論與展望
本實驗篩選出1株可發酵轉化菊糖酶解液的菌株zh,通過菌落形態觀察、生理生化及16S rDNA序列分析,確定該菌株為植物乳桿菌(L.plantarum)。通過單因素和正交實驗,優化了zh菌株發酵菊糖酶解液制備L-乳酸的工藝條件,其最佳培養條件為以酵母膏為氮源,氮源0.6%(質量分數),MnSO40.6 g/L、CH3COONa 7 g/L,菊芋酶解液定容,初始pH值4,接種量2.0%,培養溫度34 ℃,搖瓶發酵120 h。經3次平行驗證試驗表明,菌株zh實際產乳酸量達到14.37 g/100g菊芋干粉。對制備的乳酸粗品進行旋光性檢測,其平均旋光值為+0.153,初步判定試驗所得乳酸為外消旋體。綜上所述,該菌株產酸量可觀,營養需求簡單,生產成本較低,能夠為菊芋等非糧原料生產L-乳酸的菌株篩選和產酸條件優化提供一定借鑒。
隨著L-乳酸在食品、醫藥、化妝品等領域的廣泛應用,降低成本是L-乳酸發酵生產過程中的核心問題,而非糧原料或農林副產物已成為低成本發酵原料的重要糖源。菊芋作為重要的能源經濟作物,塊莖中菊糖含量約占干物質的80%(質量分數),是優質廉價的發酵原料之一。本試驗僅是在搖瓶培養條件下的結果,發酵罐放大試驗及工業化生產中運用時的工藝條件還有待進一步優化。可通過對生產菌株的誘變選育,并考慮同步糖化發酵的連續工藝,進一步提高L-乳酸的發酵生產水平。

