泰山黃精內生細菌的抗菌活性研究
郭曉平 劉興飛 李曉楠 呂雪茹 郤少梅 田園
(山東第一醫科大學(山東省醫學科學院)生命科學學院,泰安 271016)
近年來,化學農藥的濫用對人類生態環境產生了惡劣的影響,還導致了病蟲害抗性等問題[1]。生物農藥具有選擇性強、藥效高、對環境較友好、不易產生抗藥性等優點,這些特性不僅滿足當代人的需求,更滿足可持續發展的戰略目標,所以,發展生物農藥具有十分廣闊的前景,生物農藥必將成為最具發展潛力的農藥品種[2-3]。研發生物農藥有多種途徑,其中,分離篩選具有防病、殺蟲等生防作用的微生物成為一個新興的研究熱點[4-5]。植物內生菌廣泛存在于健康植物體內,在與植物長期進化過程中,形成了獨特的生理和代謝機制,可以提高植物抗逆能力;同時還能夠產生多種活性物質,具有促生、固氮、防治病蟲害等多種特性;是尚未被完全開發的微生物資源[6-7]。因此,從植物內生菌中挖掘生防菌具有廣闊前景,且對保護和開發稀有植物資源有著重要的現實意義。
泰山黃精(Polygonatum sibiricum Delar.ex Redoute)是泰山四大名藥之一,屬百合科多年生草本植物[8]。黃精是中國傳統的藥食同源的植物資源,現代化學成分研究證明,黃精中含有多糖、皂苷、黃酮、揮發油等多種化學成分,其中黃精多糖是黃精化學組成的一個重要部分,是黃精的主要生物活性成分之一[9];此外還含有多種人體所需的氨基酸和維生素等。藥理學研究證明,黃精多糖具有抗衰老、抗腫瘤、降血糖、降血脂、防動脈硬化、抗病毒、抗菌、抗炎、提高機體免疫力、提高和改善記憶等多種藥理作用[10],具有良好的開發利用價值。近年來關于泰山黃精內生菌的報道,僅見于對其內生真菌的研究[11-12],而未見對其內生細菌的研究。因此,本研究將對泰山黃精內生細菌進行分離,以期篩選出對植物病原菌有較強拮抗活性的生防菌,為泰山黃精內生細菌的開發利用提供理論基礎,同時也為拓展泰山野生黃精資源的保護和利用途徑提供科學依據。
1 材料與方法
1.1 材料
供試植物:泰山黃精(Polygonatum sibiricum Delar.ex Redoute)健康植株采自山東省泰山自然保護區海拔800 m處。
供試病原菌:尖孢鐮刀菌(Fusarium oxysporum)、串珠鐮刀菌(Fusarium moniliforme)、層生鐮刀菌(Fusarium solani)、白絹病菌(Sclerotium rolfsii),禾谷鐮刀菌(Fusarium graminearum),立枯絲核菌(Rhizoctonia solani),由山東農業大學農業微生物重點實驗室惠贈。
供試培養基:LB培養基[13](內生細菌用培養基):胰蛋白胨10 g,酵母浸膏5 g,氯化鈉10 g,蒸餾水1 000 mL,pH 7.0-7.2。PDA培養基(植物病原真菌用培養基):瓊脂條20 g,葡萄糖20 g,土豆200 g,水1 000 mL,自然pH。綠豆湯培養基(制備真菌孢子用培養基):將20 g綠豆清洗干凈,置于1 000 mL蒸餾水中加熱煮沸,至綠豆裂開,三層紗布過濾去除豆粒即得。
1.2 方法
1.2.1 內生菌的分離純化 采用組織塊培養法對黃精內生細菌進行分離與純化[13]:新鮮的黃精根莖,先用自來水將表面的泥沙雜質沖洗干凈,然后用5%(V/V)次氯酸鈉溶液處理5 min,無菌水漂洗4次后用無菌濾紙吸去殘留無菌水;再用75%乙醇溶液處理5 min,用無菌水漂洗4次后吸去殘留無菌水并干燥;最后將根莖切成直徑3 mm小塊,接種到固體LB培養基上。于30℃培養箱中培養2-3 d,將組織塊周圍生長的細菌菌斑用接種環挑取到LB培養基上,采用四區劃線法反復純化直至獲得純凈菌株。
1.2.2 內生菌的篩選 參照穆靜娟等[14]的方法對內生菌進行篩選。
初篩:采用平板對峙法,將PDA培養基上培養好的真菌病原菌,用打孔器打孔獲得直徑5 mm的病原菌餅,用無菌鑷子將菌餅接種于PDA培養基正中央,同時用接種環挑取分離得到的內生細菌單菌落均勻接種于真菌菌餅四周,距離菌餅外緣2 cm處,以只接種病原菌菌餅,不接種內生細菌的平板作為空白對照(CK),置于28℃真菌培養箱中培養4 d,觀察抑菌情況。
復篩:將初篩中抑菌效果最好的內生菌,均勻地分4點接種在病原真菌菌病四周,每個處理重復3次,以不接拮抗菌為空白對照,置于28℃真菌培養箱中培養4 d,計算抑菌率。抑菌率=(對照組菌落直徑平均值-處理組抑菌菌落直徑平均值)/對照組菌落直徑平均值×100%。
1.2.3 菌株鑒定 形態學鑒定:將篩選出的抑菌活性最強的菌株于LB平板上四區劃線接種,置于37℃培養1 d后,觀察菌落形態;并進行革蘭氏染色,在顯微鏡下觀察其菌體形態。
生理生化鑒定:參照文獻[15-16]對菌株進行生理生化鑒定。
分子生物學鑒定:利用16S rDNA測序對菌株進行分子學鑒定。將LB液體培養基中培養過夜的細菌菌液直接交給睿博興科(青島)測序部進行PCR及測序。將測定的16S rDNA序列與GenBank中已知核酸序列進行BLSAT分析,從中獲得與菌株同源的序列,利用MEGA7.0軟件構建系統發育樹。
1.2.4 揮發性物質對病原菌的抑制作用 參照穆靜娟等[14]的方法,將活性菌株按1%接種量接種到裝有100 mL LB液體培養基的250 mL三角瓶中,37℃200 r/min培養24 h,然后12 000 r/min離心去掉上清液,吸取50 μL濃縮菌液用涂布棒涂布于LB固體平板上,晾干菌液。打孔獲得5 mm植物病原真菌菌餅,并分別接種到PDA培養基中央,然后將上述涂過濃縮菌液的LB平板與接有病原真菌的PDA平板倒扣起來,接有內生細菌的一面朝上,兩個平板用封口膜密封,此為處理組;同時,以只接病原真菌,不接拮抗菌為對照組。每組重復3次,置于28℃培養箱,培養4 d觀察結果,測量真菌生長直徑,計算抑菌率(計算方法見1.2.2)。
1.2.5 發酵液對病原菌的抑制作用 取植物病原菌菌餅接種于100 mL綠豆培養基中,28℃ 150 r/min培養5 d。雙層無菌紗布過濾除去菌絲,用血球計數板進行孢子計數,并用無菌水調整孢子濃度為105個/mL。將調整好濃度的孢子液放置于4℃保存備用。
將活性菌株接種到LB液體培養基中,37℃ 200 r/min發酵培養,每隔24 h取1 mL菌液暫存于4℃冰箱,連續取樣4 d。然后將4次收集的菌液12 000 r/min離心5 min,上清以無菌濾膜過濾徹底除菌。取1 mL真菌孢子懸液與融化的PDA混合倒平板,并用打孔器在平板上打5個孔,分別加入4次的無菌上清液,并以LB培養基作空白對照。培養4 d觀察抑菌情況,確定抑菌物質產生時間。每組實驗重復3次。
2 結果
2.1 黃精內生細菌的分離純化
利用組織塊分離法對黃精內生細菌分離,并通過多次純化,共獲得12株黃精內生細菌命名為HJ-1-HJ-12,其中HJ-12的抑菌活性最好,用于后續研究。
2.2 內生拮抗菌HJ-12的抑菌率
如圖1所示,菌株HJ-12對白絹病菌、串珠鐮刀菌、禾谷鐮刀菌、尖孢鐮刀菌、立枯絲核菌、層生鐮刀菌6種植物病原菌均有不同程度的抑制作用。
從表1可見,株HJ-12對不同病原菌抑制程度不同,抑菌率為(18.57±0.25)%-(48.33±0.15)%。對立枯病菌抑制活性最強,抑菌率為(48.33±0.15)%,對白絹病菌抑制活性最弱,為(18.57±0.25)%。
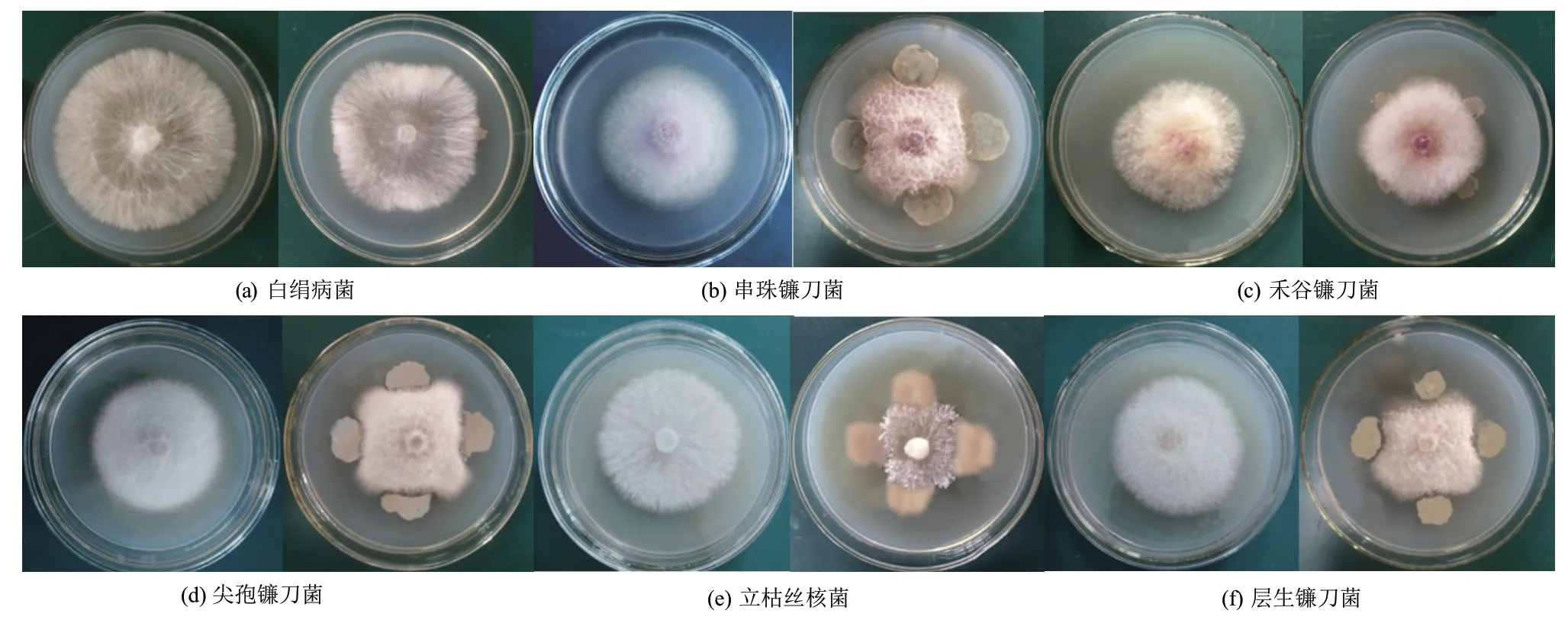
圖1 菌株HJ-12對不同病原真菌抑菌譜

表1 菌株HJ-12對6種植物病原真菌的抑菌率
2.3 內生菌的鑒定
2.3.1 形態學鑒定 菌株HJ-12在LB 平板上培養,培養初期可觀察到菌落光滑、飽滿、乳白色;培養后期表面粗糙,有曲折的溝槽樣外觀。顯微鏡下觀察到該菌株為革蘭氏陽性菌,細胞呈桿狀、單生、有芽孢、無莢膜(圖2)。

圖2 HJ-12菌株油鏡下的形態(100×10)
2.3.2 生理生化鑒定 HJ-12菌株為嚴格好氧菌株,VP實驗陰性,接觸酶陽性,可發酵葡萄糖、甘露醇,不能利用木糖、阿拉伯糖,能水解酪素、明膠、不能水解淀粉,能利用檸檬酸鹽,不能利用丙酸鹽,不產生吲哚和硫化氫,硝酸鹽還原實驗陽性。其生理生化特性與短短芽孢桿菌(Brevibacillus brevis)的特征吻合[15]。
2.3.3 分子生物學鑒定 為進一步確定菌株的分類學地位,測定其16S rDNA 基因序列,擴增目的基因序列長度為1 415 bp,GenBank號為MN883861。將該序列進行BLAST比對分析,結果發現其與Brevibacillus brevis同源性最高,相似度為99.72%。選出相關性較高的屬內相關菌株的序列,用MEGA7.0構建系統發育樹(圖3),HJ-12與Brevibacillus brevis DYJL44和Brevibacillus brevis GZDF3處于同一分支,結合菌落菌體形態及生理生化特征,將該菌株鑒定為Brevibacillus brevis HJ-12。
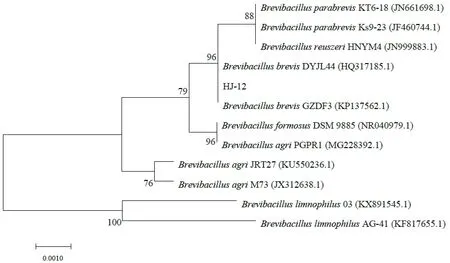
圖3 根據HJ-12菌株16s rDNA同源序列構建的系統發育樹
2.4 揮發性物質抑菌效果
由圖4可以看出HJ-12產生的揮發性物質同樣具有廣譜抑菌活性,且比細菌菌體對于病原真菌具有更加明顯的抑菌效果。
由表2可知,HJ-12產揮發性物質的抑菌率為(21.05±0.17)%-(83.53±0.19)%,對白絹病菌抑制效果最好為(83.53±0.19)%,對尖孢鐮刀菌抑制效果最低為(21.05±0.17)%。
2.5 發酵液抑菌活性及抑菌物質產生時間
由圖5可以看出HJ-12產生的發酵液上清同樣具有抑菌活性。在培養時間上,培養1 d的發酵液上清尚未產生抑菌效果,2 d以后,發酵液無細胞上清具有明顯抑菌圈,說明抑菌物質需要在培養2 d后才開始產生。

圖4 HJ-12產揮發性物質抑菌譜
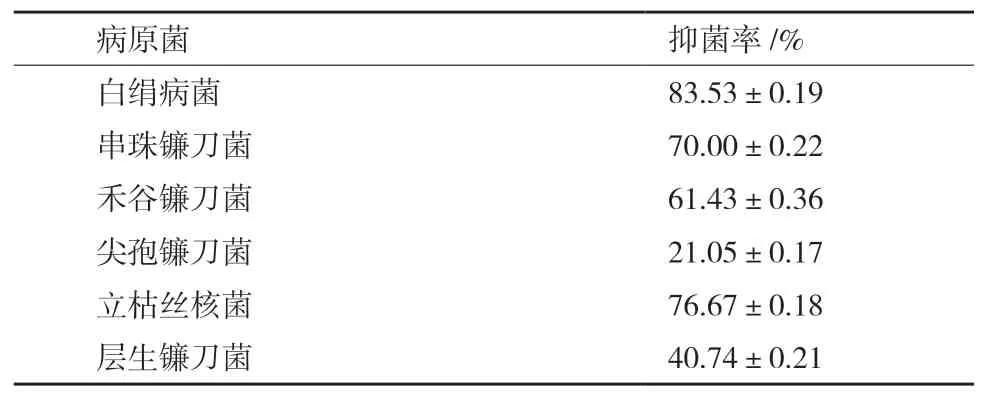
表2 HJ-12產揮發性物質對6種植物病原菌的抑菌率
3 討論
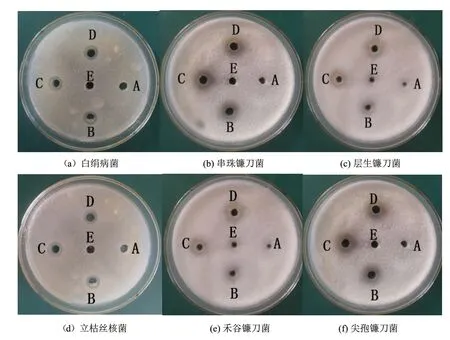
圖5 HJ-12發酵液活性
隨著植物病害對已有農藥的耐藥性加劇及新的病害的不斷出現,對新型生物源農藥的開發也越來越迫切。其中,利用生防菌防治植物病害在國內外已有較多的研究[17];在眾多生防菌來源中,植物內生菌對各種作物病害具有很好的防治效果[18]。本研究從泰山黃精中分離得到一株內生細菌HJ-12,對尖孢鐮刀菌、串珠鐮刀菌、層生鐮刀菌、白絹病菌、禾谷鐮刀菌、立枯絲核菌均具有不同程度的拮抗作用,這是首次關于泰山黃精內生細菌拮抗植物病原真菌的報道。其他地區黃精內生細菌也有類似的研究,遲惠榮等[19]獲得一株多花黃精內生貝萊斯芽胞桿菌,該菌株對尖孢鐮刀菌拮抗作用明顯,但并未研究該菌株對其他植物病原真菌的抑制活性。柏曉輝等[13]獲得一株黃山黃精內生細菌,對綠膿桿菌、鼠傷寒沙門氏菌和蘇云金芽孢桿菌3種細菌有良好的抑菌活性。以上結果表明,黃精中普遍存在芽孢桿菌屬內生菌,且該屬菌株產生的代謝物具有抑菌作用。
本研究獲得的菌株HJ-12,經形態學、生理生化反應及系統發育樹構建,鑒定為短短芽孢桿菌(Brevibacillus brevis)。短短芽孢桿菌廣泛分布于根際土壤及植物微生態系統中,王玉婷等[20]報道過一株對番茄早疫病菌菌絲和孢子均有致畸作用的內生短短芽孢桿菌011;祝學海等[21]從根際土壤中獲得了3株對半夏塊莖腐爛病致病菌有拮抗活性的細菌,經鑒定全部為短短芽孢桿菌;楊從軍[22]獲得的內生短短芽孢桿菌W4對番茄灰霉病菌具有良好的抑制活性,其優化后的發酵液稀釋25倍后對病原菌的抑制率可達92.8%。以上結果說明短短芽孢桿菌是一類理想的生防菌。
菌株Brevibacillus brevis HJ-12產生的揮發性物質與菌體相比具有更好的廣譜抑菌效果。利用揮發性物質對抗植物病原菌是芽孢桿菌發揮拮抗作用的重要機制[23],與非揮發性抗菌物質相比,揮發性抗菌物質更易于在土壤或空氣中滲透和擴散,能更有效地殺滅病原菌。另外,研究發現HJ-12的無細胞發酵液上清液具有抑菌活性,說明該菌的抑菌機制可能是幾種作用的結合。本研究所分離篩選的內生細菌是在體外條件下對病原菌進行的拮抗實驗,其在活體上生防效果還需進一步研究驗證。
4 結論
本研究從健康黃精根莖中分離得到1株對尖孢鐮刀菌、串珠鐮刀菌、層生鐮刀菌、禾谷鐮刀菌、白絹病菌、立枯絲核菌均具有不同程度拮抗作用的內生菌株HJ-12,根據菌體特征、生理生化特征及16SrDNA序列分析將其命名為Brevibacillus brevis HJ-12。HJ-12菌株所產生的揮發性物質以及無菌上清液對于各種病原菌也存在廣譜的抑制作用,且發酵液中抑菌物質的產生時間為液體培養2 d后。

