CRISPR系統轉化醫學研究進展
葉洲杰 王心睿
(1.福建省兒童醫院,福州 350011;2.福建醫科大學附屬福建省婦幼保健院醫學研究中心,福州 350001;3.福建省婦幼保健院福建省婦兒重大疾病研究重點實驗室,福州 350001;4.國家衛健委非人靈長類生育調節技術評價重點實驗室,福州 350013)
探究基因在信號通路中的功能與在人類疾病研究中的作用,仍然是基礎科學研究的重要內容。基因編輯技術作為后基因組學時代的重要研究工具,是研究基因功能的重要手段。人類從未停止在基因編輯技術上的探尋和革新,其研究歷程從鋅指核酸酶(Zinc-finger nucleases,ZFN)、轉錄激活因子樣效應因子核酸酶(Transcription activator-like effector nucleases,TALEN)到規律性成簇間隔的短回文重復序列簇技術(Clustered regularly interspaced short palindromic repeats/CRISPR-associated protein,CRISPR/Cas)有了飛速的發展[1]。CRISPR/Cas技術具有高效、便捷、成本低等優點,能夠在細胞或動物水平實現高效率的基因敲除,而受到廣泛的研究運用。
CRISPR/Cas系統是以細菌和古細菌的長期演化過程中形成的適應性天然防御機制為基礎發展成的一項新基因編輯技術[2],Ⅱ型CRISPR/cas系統在發揮基因編輯功能時只需要Cas9一種核酸酶參與作用,避免了其它類型CRISPR需要多蛋白相互作用的過程[3-4]。CRISPR/Cas9基因編輯技術憑借其簡單方便、操作性強等優勢,2013年被Science雜志列入十大科技研究進展之一,同時Nature雜志子刊方法學雜志將其列入2013年年度研究方法。運用CRISPR/Cas9技術在斑馬魚、小鼠、恒河猴、果蠅等動物的受精卵或胚胎進行基因敲除,構建基因敲除模型,在生長機制調控、腫瘤免疫治療、藥物靶點研究分析、耐藥機制研究等研究中起到重要作用。
1 CRISPR/Cas9系統介紹
CRISPR/Cas9系統主要兩部分組成(圖1):一部分由crRNA(CRISPR-derived RNA)含有20 nt序列能夠特異性結合不同靶標基因。crRNA與tracrRNA(trans-activating RNA)形成tracrRNA/crRNA 復合物作為Cas9蛋白結合結構域,招募Cas9蛋白到crRNA結合的基因序列處對目的基因進行切割[6-7];另一部分為具有Ruvc1和HNH核酸內切酶活性的Cas9蛋白[8],蛋白兩端攜帶了核定位信號NLS,確保Cas9蛋白能夠進入細胞核完成對目的基因序列的特異性切割[9]。為了保證Cas9蛋白的有效切割活性,sgRNA靶標目的基因序列的3'端要具有前間區序列鄰近基序(PAM,-NGG-)位點的存在[10]。
細胞對于損傷的DNA序列能夠通過非同源末端連接(Non-homologous end joining,NHEJ)和同源介導雙鏈DNA修復(Homology directed repair,HDR)對斷裂的DNA鏈進行修復,實現對DNA序列的特異性突變[11]。對于sgRNA有可能存在基因脫靶與非靶標基因配對而引入新的突變,導致實驗現象不準確出現誤差等一系列問題,一直存在爭議。2019年,宿兵團隊[12]使用與人類進化關系最為接近的獼猴,利用CRISPR/Cas9技術構建MCPH1基因缺失小頭癥獼猴模型,通過對多只MCPH1基因缺失獼猴與其野生型父母本獼猴進行二代測序分析,比對發現在MCPH1缺失獼猴基因組中并未出現大量新發突變,擴增子測序結果顯示在sgRNA對應基因切割區域也并未發現長片段的基因結構變異。研究結果表明在非人靈長類獼猴基因組中,CRISPR/Cas9不會導致較高的基因突變,具有一定的安全性。
2 CRISPR/Cas9生命科學研究應用
2011年,Bhaya等[13]將外源自發突變抗噬菌體感染嗜熱鏈球菌的CRISPR系統導入大腸桿菌中,大腸桿菌獲得了抗噬菌體感染能力。2013年,張峰團隊[14]將Ⅱ型CRISPR/Cas9系統導入哺乳動物細胞中,實現對于哺乳動物的基因編輯。這些研究結果證明CRISPR/Cas9系統能夠在不同物種間發揮相同的功能。至2013年以來,人們運用CRISPR/Cas9基因編輯技術在基礎科學中的研究成果澎涌而出。2017年,李曉江課題組[15]運用腺病毒侵染運送的方式敲除亨廷頓模型小鼠腦細胞中的mHTT基因,發現缺失mHTT基因表達后能夠恢復亨廷頓小鼠的運動能力。2019年,馮國平課題組[16]利用CRISPR基因編輯技術對恒河猴的SHANK3基因進行敲除,探究SHANK3在自閉癥的作用。研究發現,恒河猴在缺失SHANK3后睡眠質量降低且重復性動作增多。非人靈長類自閉癥模型對于了解人類腦神經環路異常以及自閉癥相關疾病具有重要的科學意義。
運用CRISPR/Cas9基因編輯技術不僅能夠運用于基礎科學研究中,其在臨床研究中也具有重要作用。CAR-T作為白血病治療的重要手段,對于血液癌癥與淋巴細胞癌具有明顯的治療效果,然而目前在T細胞中插入嵌合抗體片段主要還是通過慢病毒或轉座子隨機插入T細胞基因組中,隨機插入造成T細胞基因功能的破壞以及出現的風險是不可而預的[17]。2018年,Fraietta等[18]在T細胞的TET2基因中利用CRISPR/Cas9和同源重組的方式插入CD-19 CAR,電轉染方式在外源載體導入T細胞中,定點敲入外源表達閱讀框,從而實現了在T細胞中定點構建CAR-T細胞。2020年,李大力課題組[19]運用CRISPR單堿基突變技術,成功編輯HBG1/2啟動子上的BCL11A結合位點,誘導β地中海貧血患者中的γ珠蛋白的表達,明顯改善了患者體內紅細胞的成熟程度,運用基因編輯技術有望成為治愈β地中海貧血的治療手段。
現今對于CRISPR/Cas9基因編輯技術的研究以及運用已經逐漸成熟,該技術已經成功被運用到小鼠、獼猴、擬南芥、線蟲、果蠅等動植物基因研究中[20]。CRISPR技術除了用于基因功能研究之外,CRISPR系統延伸應用對于在后基因組學時代高通量篩選人類疾病調控基因、腫瘤耐藥機制研究、遺傳性疾病與病原微生物感染疾病診斷同樣具有重要研究意義,有效推動了人類臨床醫學研究發展。
3 CRISPR系統轉化醫學應用擴展
3.1 CRISPR診斷技術
CRISPR/Cas9基因編輯系統的運用風靡全球時,張峰、Doudna等多位研究者對除Cas9蛋白以外的CRISPR相關蛋白(Cas蛋白)研究逐漸深入,研究發現自然界中存在著多種功能結構不同的Cas蛋白[22-23]。通過Cas蛋白的切割活性,利用CRISPR系統作為體外分子診斷,將CRISPR技術應有推向了一個新高度[21]。CRISPR診斷技術能夠在體外方便快捷地識別診斷病原體基因序列,在對靶標序列切割時釋放信號達到對疾病的快速診斷,其在新生兒產前篩查、遺傳病診斷、病毒感染檢測等方面具有強大的優勢,與常規RT-PCR的基因檢測鑒定技術相比具有靈敏度強,方便,快速等特點,能適用于偏遠山區醫療設施條件差的地區,甚至能夠做到即時檢測。
2015年,張峰等研究發現另一II型CRISPR系統的核酸內切酶Cas12a蛋白,其同樣具有在sgRNA引導下對雙鏈DNA進行特異性切割的活性[22]。隨后Doundna等發現,當Cas12a蛋白對雙鏈DNA進行切割后,它能對周圍的單鏈DNA進行極高活性的隨機切割[23]。利用這個特性,Doundna團隊研發了DETECTR(DNA Endonuclease Targeted CRISPR Trans Reporter)診斷系統,在DETECTR系統中包含了CRISPR-Cas12a、特異性針對靶標sg-RNA、熒光報告分子(圖2)。Doundna運用RPA(Recom-binase polymerase amplification)等溫擴增系統,在37℃ RPA能對靶標基因實行快速擴增。Cas12a對靶標基因進行切割后能夠對周圍單鏈熒光報告分子進行切割,切割暴露后的熒光基團信號能夠被信號采集器收集,通過評估熒光強度,判斷樣本中是否存在sgRNA特異性結合的靶標基因序列。Cas12a被開發成高靈敏度的DNA分子檢測工具,Doundna博士運用該系統能夠準確檢測出含人乳頭瘤病毒(HPV)患者樣本中的HPV16和HPV18這兩個高風險類型[24]。CRISPR-Cas12a對于腫瘤和傳染性疾病等的DNA分子檢測,這也暗示了運用CRISPR系統作為臨床診斷技術具有巨大的應用潛力。
CRISPR診斷技術同樣能夠適用于RNA分子診斷,2016年,張峰等發現Cas13a蛋白在切割靶標RNA序列后仍能保持切割活性對周圍RNA進行切割[26],人們將這一現象稱為“collateral cleavage”。根據這一特性Doundna將Cas13a蛋白運用于RNA診斷中[27],將Cas13a蛋白的“collateral cleavage”特性運用于RNA檢測(圖3)。然而最初Cas13a用于RNA檢測技術的靈敏度有待提高,這使CRISPR RNA診斷技術的發展受到了局限。2017年,張峰等對CRISPR/Cas13a診斷平臺進行了優化,SHERLOCK(Specific High-sensitivity Enzymatic Reporter unLOCKing)系統將診斷靈敏度提升百萬倍,能夠檢測出每微升體積中只含1個拷貝的寨卡病毒或登革熱病毒[28]。2018年,Science雜志中連發4篇關于CRISPR/Cas13a 技術在臨床診斷中的應用,張峰等開發的HUDSON(heating unextracted diagnostic samples to obliterate nucleases)技術在常溫下結合SHERLOCK系統能夠在2 h內快速完成對患者體內登革熱病毒檢測[29-30]。CRISPR診斷技術的簡便快捷和高靈敏度等特點與傳統臨床醫學檢驗技術相比不需要復雜的檢測儀器設備,張峰等將檢測信號以檢測試紙的方式展現在人們面前[30],在高靈敏度檢出效率的的同時,避免了攜帶儀器設備不便以及高成本檢測等問題,其作為臨床轉化研究應用對于人類健康安全具有重要作用。
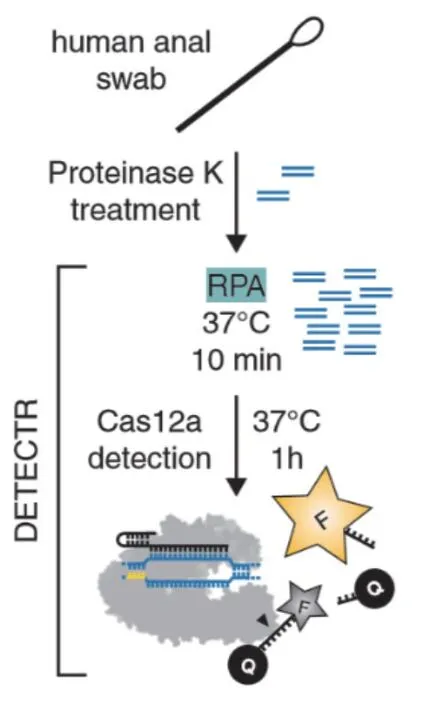
圖2 CRISPR/Cas12a體外診斷圖示[23]
2019年中國爆發新型冠狀病毒(SARS-CoV-2)造成全國數萬人感染,由于能夠在人群中接觸傳播,造成了高傳染性與高致死性,SARS-CoV-2的死亡率為2%[31],已經對生命安全與正常工作活動產生嚴重危害。SARS-CoV-2病毒具有14-20 d不等的潛伏期,常規的real-time PCR和膠體金病毒檢測法由于靈敏度不高且對病毒檢出拷貝數有要求,導致不能夠及時檢測病毒的存在,使得病毒攜帶者能夠在人群中廣泛傳播。2020年2月,張峰等向全球公布了使用基于CRISPR/Cas13的SHERLOCK技術檢測新型冠狀病毒的詳細操作流程文檔,SHERLOCK技術檢測新冠病毒高靈敏性,可以檢測出每微升僅10-100個拷貝的病毒。由于該方法操作簡單,只需純化的核酸分子樣本,1 h即可完成檢測,減少了常規核酸提取等實驗操作過程,能夠快速方便地準確檢測患者體內是否存在新型冠狀病毒。
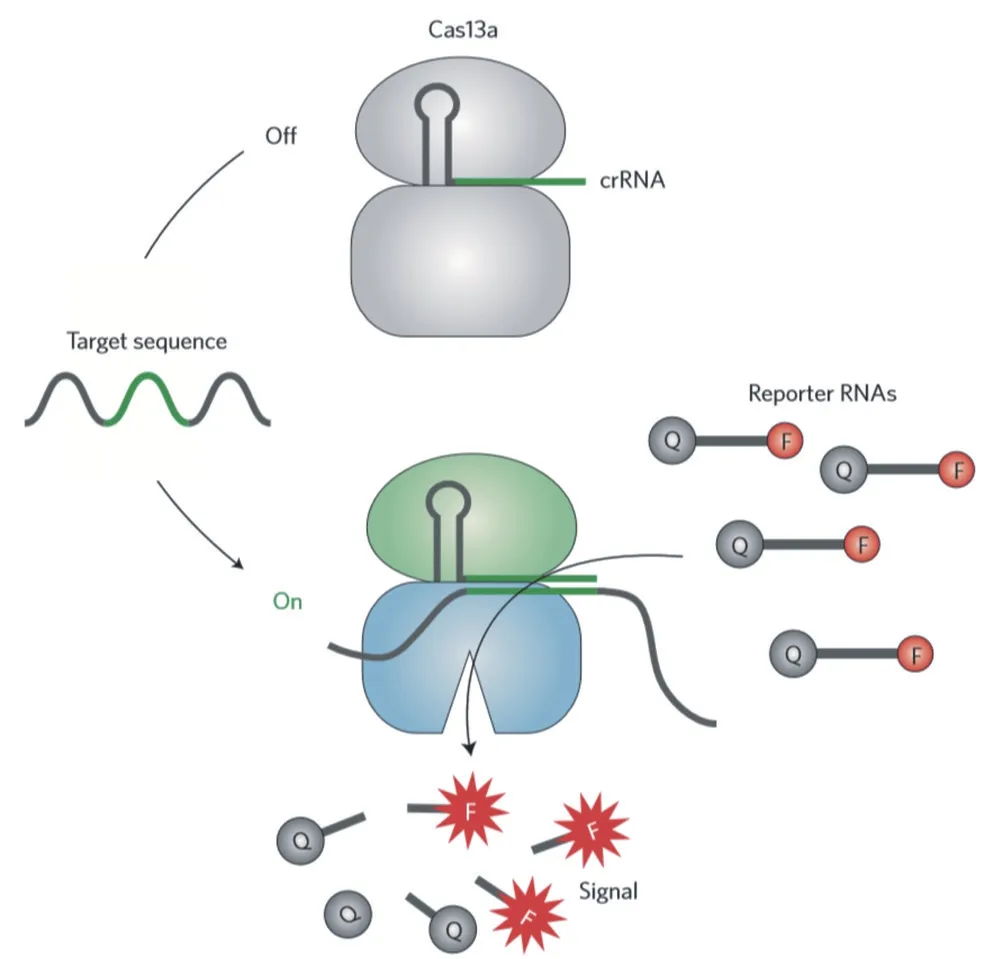
圖3 CRISPR/Cas13a分子診斷示意圖[25]
張峰團隊利用Cas13核酸酶的酶切活性研發出高靈敏度的人類體內RNA病毒,細菌或其他靶標存在的RNA分子診斷技術后,對核酸分子診斷技術的發展具有推進性的作用。2019年。張峰等將Cas13蛋白的分子診斷能力與抗病毒活性整合在一起,研發 出CARVER(Cas13-Assisted Restriction of Viral Expression and Readout,Cas13)系統[32],該系統在識別診斷靶標RNA的同時能夠治療病毒的感染,研究者通過確定數百種可能潛在感染人類的ssRNA病毒物種中的數千個潛在Cas13 crRNA靶位點,首先將Cas13蛋白表達載體與工程化的crRNA導入細胞中,24 h后將淋巴細胞性脈絡叢腦膜炎病毒(LCMV)、甲型流感病毒(IAV)和水泡性口炎病毒(VSV)3種不同RNA病毒分別侵染宿主細胞,研究發現在感染24 h后,宿主細胞中的病毒RNA水平顯著降低40多倍,而在IAV病毒侵染宿主細胞8h后,檢測發現IAV病毒的侵染能力降低了300多倍。運用CARVER系統在檢出靶標病毒存在的同時能夠有效清除人體內的RNA病毒,其對于針對已知或新發現的人類病原體感染時,作為快速診斷和抗病毒藥物研發中具有巨大的潛力。2020年,面對突發性新型冠狀病毒感染肺炎爆發,哈佛醫學院Nguyen等[33]以腺相關病毒為載體將CRISPR/Cas13d系統與多個靶向SARS-CoV-2病毒多肽編碼區的guide RNA輸入新冠肺炎患者體內。Cas13d的核酸酶活性切割SARS-CoV-2病毒RNA序列,從而避免了病毒的復制增殖導致對人體的傷害,運用“病毒殺傷病毒”的研究治療方法,避免了由于病毒容易突變而導致對抗病毒藥物耐藥性問題的出現,對于高效、方便、高靈活性的快速治療預防RNA病毒,以及對于已經產生耐藥性的突變RNA病毒治療提供一種新的臨床治療手段。然而在進入臨床研究之前需在非人靈長類等動物模型中對其診斷SARS-CoV-2或其它RNA病毒的安全性與高效性評估。
運用CRISPR體外診斷檢測平臺能夠對新型冠狀病毒、寨卡病毒、登革熱病毒等烈性病毒進行快速準確的判定,及時有效對患者進行準確診斷治療隔離,減少病毒傳播。CRISPR在醫療設施條件薄弱地區能夠起到強大檢測作用的同時,還能夠針對病毒對治療藥物產生耐藥性,作為一種新的病毒臨床治療手段;不同亞型的病毒檢測區分;臨床表型相似的RNA病毒區分;抗生素耐藥性基因檢測等方面具有眾多應用。CRISPR診斷技術同時推動了臨床即時檢驗技術(Point-of-care testing,POCT)的發展,在不需要專業臨床檢驗醫生存在的情況下,通過檢驗試紙等就能快速準確對傳染性疾病進行檢測,對于對癥及時救治提升患者生存率,減緩疾病的傳播具有重大意義。
3.2 CRISPR基因敲除文庫
人類及模式生物基因組計劃研究的初步完成,人們對于基因功能有了一定的認知,但對于基因在人類生理功能調控、基因參與的信號通路研究、基因與對于腫瘤治療藥物和抗病毒藥物等的耐藥性機制以及更多問題仍有待科學家們的探索。如何利用現有的科學實驗手段以及對基因功能的認知,解決疾病的發病過程和發生機制、通過尋找與人類疾病相關的功能性基因,為人類臨床疾病治療研究新的靶點與研究新的治療藥物具有重要意義。
高通量基因篩選技術的出現在全基因組范圍或部分基因組范圍內通過干擾基因表達篩選候選基因,成為功能性基因篩選的重要手段。CRISPR/Cas9技術的發展使得在多基因范圍甚至全基因組規模上構建基因敲除載體文庫成為了可能。使用CRISPR基因敲除文庫構建細胞敲除文庫在哺乳動物全基因組范圍內進行基因敲除并篩選候選基因開創了基因組研究的新時代[34]。前期使用cDNA文庫基因外源過表達系統篩選候選基因,但是由于細胞轉錄組比較復雜存在不同剪切體等情況,使得cDNA文庫不能覆蓋完整基因組[35]。RNAi干擾文庫也曾被用于基因功能缺失篩選[36],siRNA通過降解同源mRNA序列而降低基因表達,但是siRNA并不能完全抑制基因的表達[37],使得實驗觀測表型不明顯且存較高脫靶率[38]。CRISPR/Cas9敲除文庫由于特異性強,覆蓋性廣等特點能夠很好地彌補上述高通量篩選系統的不足而廣受青睞。2014,張峰等靶向人類基因組中18 080個基因構建人類全基因組CRISPR敲除慢病毒文庫,每個慢病毒載體中攜帶了靶定不同基因的sgRNA,利用該系統在黑色素瘤模型中篩選維羅非尼耐藥性基因,從中研究發現了NF2、CUL3、TADA1等基因參與了維羅非尼耐藥機制調控[39]。對于在腫瘤治療過程中出現的耐藥性問題,一直成為急需解決的臨床治療問題。利用CRISPR全基因組敲除文庫進行高通量耐藥基因篩選,為腫瘤臨床治療提供新的治療靶點和研究手段。
病毒感染造成的人類疾病往往由于其與宿主作用機制尚未明確,而造成巨大危害,如2019年底爆發的新型冠狀病毒造成人類肺炎感染。運用CRISPR/Cas9基因敲除文庫篩選病毒受體或宿主病毒依賴基因,有助于開發新的傳染性疾病預防和治療藥物。2018年,Han等[40]在人肺上皮細胞中利用全基因組敲除文庫構建了一個含1.9萬個不同基因打靶的肺上皮細胞敲除文庫,禽流感病毒H5N1侵染文庫細胞后,高通量測序分析發現,SLC35A1基因作為H5N1病毒細胞受體參與病毒結合,而CIC基因能夠調控宿主細胞的免疫調控應答,缺失CIC時肺上皮細胞能夠表現出良好抗病毒效果。
根據信號通路以及基因作用靶點合理設計敲除文庫大小,結合正向篩選系統或負向篩選系統,CRISPR基因敲除文庫能夠有效的用于藥物作用基因靶點篩選、癌癥驅動基因篩選、抗病毒感染基因與長鏈非編碼RNA等研究中。
3.3 CRISPR干擾
人們對Cas9蛋白結構解析發現Cas9蛋白具有識別sgRNA指導與靶標基因結合結構域外還存在兩個核酸酶切結構域,能夠在PAM位點前3個堿基處對雙鏈DNA進行切割,人們通過突變的方式“鈍化”Cas9蛋白的切割活性,保留在sgRNA引導下以相同精確度與靶基因結合能力,形成dCas9蛋白[41]。dCas9蛋白通過與轉錄激活或抑制因子等效應器結合,在啟動子、轉錄調控原件或CDS區等在不對DNA進行精準切割下對基因表達起到調控作用,這種調控作用既可以增強基因的表達也可以抑制基因表達。
2013年,Fujita等[42]將化膿性鏈球菌Cas9蛋白核酸酶結構域引入RuvC結構域D10A和HNH結構域H840A突變,突變后的Cas9蛋白稱為dCas9蛋白。dCas9失去對雙鏈DNA核酸酶切割活性,而保留了在guide RNA引導下與目的基因特異性結合能力。dCas9蛋白與Kox1蛋白轉錄阻遏結構域KARB形成融合蛋白,KARB通過招募多種組蛋白修飾因子通過形成異染色質從而抑制了基因表達[43]。dCas9-KARB系統在不破壞細胞基因組前提下,有效的抑制了基因的表達水平。2016年,Liu等[44]對人類6類轉化細胞和一種誘導多能干細胞中16 401個長鏈非編碼LncRNA作用位點篩選,利用CRISPR干擾技術抑制了這些非編碼轉錄本的轉錄,探究其作用位點參與細胞生長的調控。研究篩選發現了499個位點對于細胞穩定生長是必須的。CRISPRi技術適用于長鏈非編碼RNA的研究中,結合單細胞測序技術能夠很好的用于細胞生長分化通路研究。
CRISPR/dCas9系統除了dCas9蛋白與KARB等轉錄抑制因子形成融合蛋白,阻滯基因轉錄從而敲降基因表達水平外,還可以運用于表觀遺傳修飾參與基因表達調控的研究[45],如組蛋白乙酰化dCas9-P300修飾表觀遺傳激活系統;組蛋白去甲基化dCas9 LSD1表觀遺傳抑制系統;DNA甲基化dCas9-DNMT3A 修飾系統等研究中。利用sgRNA識別特異性的靶標基因,dCas9蛋白攜帶基因修飾因子準確定位靶基因,探究基因調控過程。
3.4 CRISPR/dCas9激活系統
經過改良的跨表觀遺傳調控CRISPR/Cas9系統激活基因表達,對于恢復沉默基因表達、彌補基因缺陷、改變細胞命運等有重大研究意義[46]。許多疾病的發生并非由于基因突變造成,而是由于表觀遺傳學修飾過度甲基化或乙酰基化等阻礙了基因表達[47]。研究表明表觀遺傳學與疾病發生具有密切的關系,在白血病與淋巴癌中過度甲基化導致腫瘤細胞的浸潤能力加強,在慢性淋巴白血病中也顯示出更高水平的甲基化異常[48]。CRISPR/dCas9系統揭示了一個基因跨表觀遺傳修飾表達技術平臺,酶切結構域失活的dCas9蛋白不具備核酸酶活性,在sgRNA牽引下dCas9蛋白特異性地與目的基因結合,dCas9蛋白能夠招募內源性轉錄復合物啟動基因的翻譯表達。
2013年,Maeder等[49]對CRISPR/Cas9系統進行了改造,研究者對Cas9蛋白的核酸酶活性進行破壞,而保留了在sgRNA引導下與靶基因特異性活性,稱為dCas9。研究者將dCas9與轉錄因子VP64構建融合蛋白,VP64是一種RNA結合蛋白,可以與轉錄因子的轉錄活化結構域結合,從而提高基因的表達水平[50]。在sgRNA的指導下dCas9-VP64融合蛋白特異性地結合在神經營養因子NTF3的啟動子序列上,特異性地激活NTF3基因的表達[51]。2017年,Liao等[52]在CRISPR/Cas9系統中引入轉錄激活復合物MS2-P65-HSF1(MPH)[53],并縮短了sgRNA的長度成為14 nt RNA的dgRNA,guide RNA長度的縮短能夠避免Cas9蛋白切割DNA序列。如圖4所示,研究者在Cas9模型小鼠中通過靶向激活基因成功修復急性腎損傷、I型糖尿病等疾病表型。運用CRISPR/dCas9激活系統,能夠提升細胞靶標基因表達,從而達到劑量補償效應。在人體基因中往往很多單基因拷貝的發生就能導致疾病的發生,2018年,Matharu等[54]構建SIM1單拷貝突變模型小鼠,小鼠缺失一個拷貝的SIM1基因表達后,能夠導致肥胖癥的發生。研究者在小鼠4周齡時通過AAV腺相關病毒將dCas9-VP64和靶標SIM1基因啟動子區域的sgRNA運送進小鼠腦部。研究發現接受CRISPRa(CRISPR activation)治療的老鼠SIM1基因表達水平能夠恢復至野生型小鼠水平,而且體重比對照小鼠減輕40%左右,身體也更加健康。運用CRISPRa系統恢復基因表達劑量從而治療基因單拷貝變異疾病提供了一個新的治療思路。

圖4 改進的CRISPR/Cas9激活系統圖示
某些疾病的發生或生理功能紊亂是由于基因沉默或表觀遺傳學修飾導致基因表達劑量不足造成。CRISPR/dCas9激活文庫在恢復沉默基因表達,對疾病、病毒感染等研究中顯示出了巨大潛力。2015年,張峰等運用CRISPR/dCas9系統針對人體2萬多個基因設計70 290個sgRNA,構成人全基因組CRISPR/dCas9激活文庫[55]。篩選促進黑色素瘤細胞抵抗BRAF抑制劑PLX-4720耐藥激活基因,研究者將CRISPR激活系統導入大量的黑色素瘤細胞中,在激活細胞文庫中進行PLX-4720耐藥激活基因篩選。實驗得到候選基因BCAR3與EGFR作為ERK信號通路下游和上游調控點參與耐藥機制[56-67]。2017年,Heaton 等[58]運用CRISPR/dCas9激活系統構建靶向人全基因組23 430個基因轉錄起始位點上游200 bp左右的sgRNA文庫[59],將融合蛋白dCas9-VP64與轉錄因子MS2-p65-HSF1導入肺腺癌上皮細胞A549細胞中,構建A549全基因組激活細胞文庫。使用甲型流感病毒(IVA)篩選過表達基因后能夠抵御IVA病毒的侵染,高通量測序結果發現在A549細胞中過表達B4GALNT2基因后能夠顯著抑制IVA病毒的侵染能力,其作為一個新型藥物治療靶點對于抵御甲型病毒流感具有重要意義。
4 結語
CRISPR基因編輯系統在后基因組時代對于基因功能研究、腫瘤耐藥基因篩選,沉默基因夸表觀遺傳調控,干擾基因表達以及病原微生物感染鑒定等用于轉化醫學研究有著巨大的研究潛力。CRISPR基因敲除文庫,CRISPR激活系統以及CRISPR干擾技術在藥物作用靶點,腫瘤驅動基因研究,長鏈非編碼RNA等研究中具有明顯的優勢[60]。以CRISPR系統研發的基因診斷技術減少儀器設備投入的同時,高效快速的能夠檢測出樣本中的目的基因,能夠在病人身邊隨時進行診斷檢測。CRISPR系統憑借其方便快捷的特點,被科學研究者們廣泛運用。然而科研工作者在醫學研究中必須謹慎使用CRISPR系統,避免“基因編輯嬰兒事件”再次發生。人們要謹慎使用CRISPR技術進行人體研究,合理運用CRISPR技術于臨床醫學轉化研究時,應遵循以下幾點原則:必須有支持臨床應用的證據基礎;通過倫理審查持有倫理辯護;實驗研究須透明公開等。在生命科學以及臨床醫學等研究中合理運用CRISPR系統,對于人類科學研究事業發展具有重要的推進作用。

