基于代謝組學的轉基因水稻生物安全評價方法研究
蘭青闊 趙新 沈曉玲 魏靜娜 劉雙 陳銳 檀建新 王永
(1.天津市農業(yè)科學院,天津 300381;2.河北農業(yè)大學,保定 071001)
截止到2018年,全球共有26個國家種植了1.917億公頃轉基因作物[1]。伴隨轉基因技術的發(fā)展和人們生活水平的提高,轉基因作物及其衍生食品的安全問題受到社會強烈關注和爭議[2-3]。世界各個國家、組織和地區(qū),都對轉基因作物的研發(fā)和應用規(guī)定了明確的政策和法規(guī)[2,4],對其開展嚴格的生物安全評價。
轉基因生物安全評價是基于對轉基因產品和同類非轉基因產品的詳細比較分析。1993年,經濟合作與發(fā)展組織(OECD)提出“實質等同性原則”作為轉基因食品安全性評價的基本原則[5]。在比較分析中,對象的選擇是整個安全評價過程中的關鍵。最初采用的評估方法是靶標性地檢測某一種或一類成分的差異;對象通常包括主要成分、次要成分、有毒物質、必需營養(yǎng)物質、抗營養(yǎng)因子(胰蛋自酶抑制劑)等[6-7]。近些年,多位研究人員提出當前的靶標分析方法過于具體,容易漏檢非預期效應[8-10],應該補充采用更加全面無偏向性的、非靶標輪廓分析的組學分析技術,包括轉錄組學[11]、蛋白質組學[12]和代謝組學技術[10-11]。這些組學技術能夠更好的挖掘轉基因作物與非轉基因受體之間差異的范圍和來源,發(fā)現(xiàn)非預期效應[13]。
代謝組學(Metabonomics或Metabolomics)屬于全局系統(tǒng)生物學研究方法,其分析靶標是細胞中相對分子質量在1 000 Da以內的小分子代謝物[14-15]。本研究以轉基因抗蟲水稻及其非轉基因受體為研究對象,采用基于UPLC-Q/TOF MS分析的轉基因作物代謝組評價技術流程,對代謝組提取方法、數(shù)據處理方法、數(shù)據分析軟件等技術進行了探索。本研究豐富了現(xiàn)有的轉基因生物安全評價的內容和方法,為轉基因生物安全評價與管理提供技術支撐。
1 材料與方法
1.1 材料
轉基因抗蟲水稻及其非轉基因受體水稻種子由本試驗室保存。轉基因抗蟲水稻含有P-Ubi、Cry1Ab、T-35S、T-nos等4個外源元件,單拷貝形式插入在水稻染色體中。
1.2 方法
1.2.1 水稻萌發(fā)與培養(yǎng) 將種子均勻鋪在培養(yǎng)皿中,放入光照培養(yǎng)箱(GXZ-450A,寧波江南,條件為16 h光培養(yǎng),光強80 mE·s-1·m-1,溫度28℃;8 h暗培養(yǎng),溫度為22℃);7 d后移至營養(yǎng)土中(16 h光培養(yǎng),光強80 mE·s-1·m-1,溫度32℃;8 h暗培養(yǎng),溫度為28℃)。轉基因及其受體樣本的生長環(huán)境包括營養(yǎng)基質、溫度、濕度和光照時間等均相同。
1.2.2 代謝組提取方法 取適量水稻葉片組織于2 mL預先放入鋼珠的離心管中,液氮中處理1 min,用冷凍研磨儀(MM400,德國萊馳)研磨成粉末;稱取100 mg粉碎樣品于新的2 mL的離心管中,加入提取溶劑(不同濃度的甲醇水溶液)1 mL,渦旋混勻,置于高速冷凍離心機(CR22GIII,日本日立)中,4℃ 下16 000 ×g離心15 min;上清液即為樣品提取液。轉基因及其受體各7株平行。
1.2.3 代謝組分析 本研究應用的液質平臺為ACQUITY UPLC H -CLASS串聯(lián)Xevo G2-XS Q/TOF質譜。
1.2.3.1 液相色譜條件 色譜柱為 BEH C18(1.7 μm,2.1×50 mm);流動相采用乙腈-水-甲酸系統(tǒng),其中(A)0.1%(V/V)甲酸超純水,(B)乙腈,優(yōu)化以后的梯度洗脫程序見表1;柱溫40℃,流速為0.40 mL/min;進樣量2 μL;進樣后洗針6 s;單個樣品運行時間18 min;樣品室溫度為4℃。
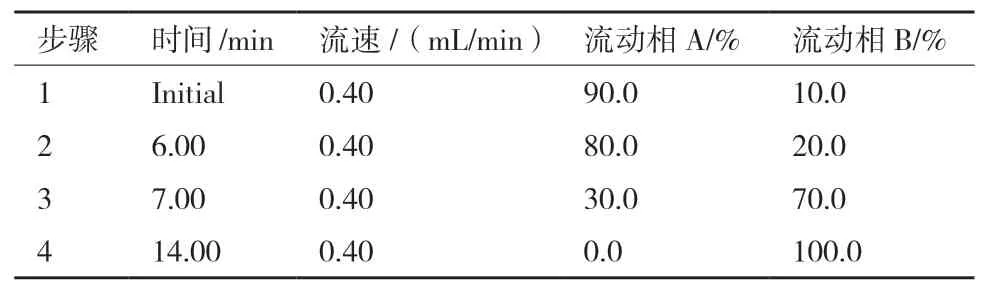
表1 UPLC流動相洗脫梯度
1.2.3.2 質譜條件 采用正、負兩種模式測定。
正離子模式:毛細管電壓(Capillary Voltage)1.5 kV;錐孔電壓(Sampling Cone Voltage)40 V;Source offient 80;離子源溫度(Source Temperature)120℃;脫溶劑氣溫度(Desolvation Temperature)400℃;掃描時間(Scan time)0.2 s;進樣錐孔氣體流量(Cone Gas Flow)50L/h;脫溶劑氣流速(Desolvation Gas Flow)800 L/h;質量數(shù)檢測范圍(Mass range)100-1 200 Da;實時質量校正(Lockmass)標準品為亮氨酸腦啡肽醋酸鹽(LE,[M+H]+=556.277 1,[M-H]-= 554.261 5)。
負離子模式:毛細管電壓(Capillary Voltage)1 kV;錐孔電壓(Sampling Cone Voltage)40 V;Source offient 80;離子源溫度(Source Temperature)120℃;脫溶劑氣溫度(Desolvation Temperature)450℃;掃描時間(Scan time)0.2 s;進樣錐孔氣體流量(Cone Gas Flow)50 L/h;脫溶劑氣流速(Desolvation Gas Flow)800 L/h;質量數(shù)檢測范圍(Mass range)50-1 200 Da;實時質量校正(Lockmass)標準品為亮氨酸腦啡肽醋酸鹽(LE,[M+H]+=556.277 1,[M-H]-= 554.261 5)。
1.2.3.3 代謝組學方法學考察 同一份樣品分別在放置0 h、5 h、10 h、20 h、30 h、40 h之后進行檢測,比較保留時間和峰面積的RSD,考察提取方法的穩(wěn)定性;同一份樣品連續(xù)進樣5次,比較色譜峰保留時間的一致性,考察方法的精密度;相同條件下提取7株轉基因抗蟲水稻的葉片并進行代謝組檢測,比較色譜峰相對保留時間的一致性;考察方法的重復性。
1.2.4 數(shù)據處理 首先使用MarkerLynx4.1軟件(Waters公司)對色譜圖進行初步分析處理,提取化合物的質量數(shù)、相對保留時間、峰強度和峰面積,導出數(shù)據;應用軟件Progenesis QI(Waters)和基于R語言的開源軟件MAIT[16](Metabolite Automatic Identification Toolkit)進行數(shù)據處理和代謝組差異化分組分析。
Progenesis QI軟件的主要參數(shù):加和離子選擇M+H,M+NH4,M+Na,M+K;抗蟲轉基因水稻樣本為一組,非轉基因受體樣本為一組;分析時間為0-18 min;質量數(shù)范圍為50-1 000 Da;軟件分析后,得到Score圖和Loading圖,選擇Loading圖中偏離遠點的點進行Transfer Loadings data,其中Anova P-value≤0.05,Max fold change≥2的化合物為差異代謝物[17-18]。
2 結果
2.1 水稻葉片代謝組提取方法優(yōu)化
以水稻苗期葉片為試驗對象,比較不同濃度的提取溶劑(100%甲醇、80%甲醇、50%甲醇、30%甲醇)對水稻代謝物提取的效果。結果(圖1)顯示,隨著甲醇濃度的增加,BPI譜圖中峰個數(shù)增多;在甲醇濃度為80%和100%時,峰個數(shù)基本保持一致,BPI譜圖中峰的數(shù)目較多,可覆蓋更多代謝物,提取效果較好。考慮到溶劑效應,流動相中含有一定比例的水更好,因此選擇80%甲醇濃度開展后續(xù)試驗。
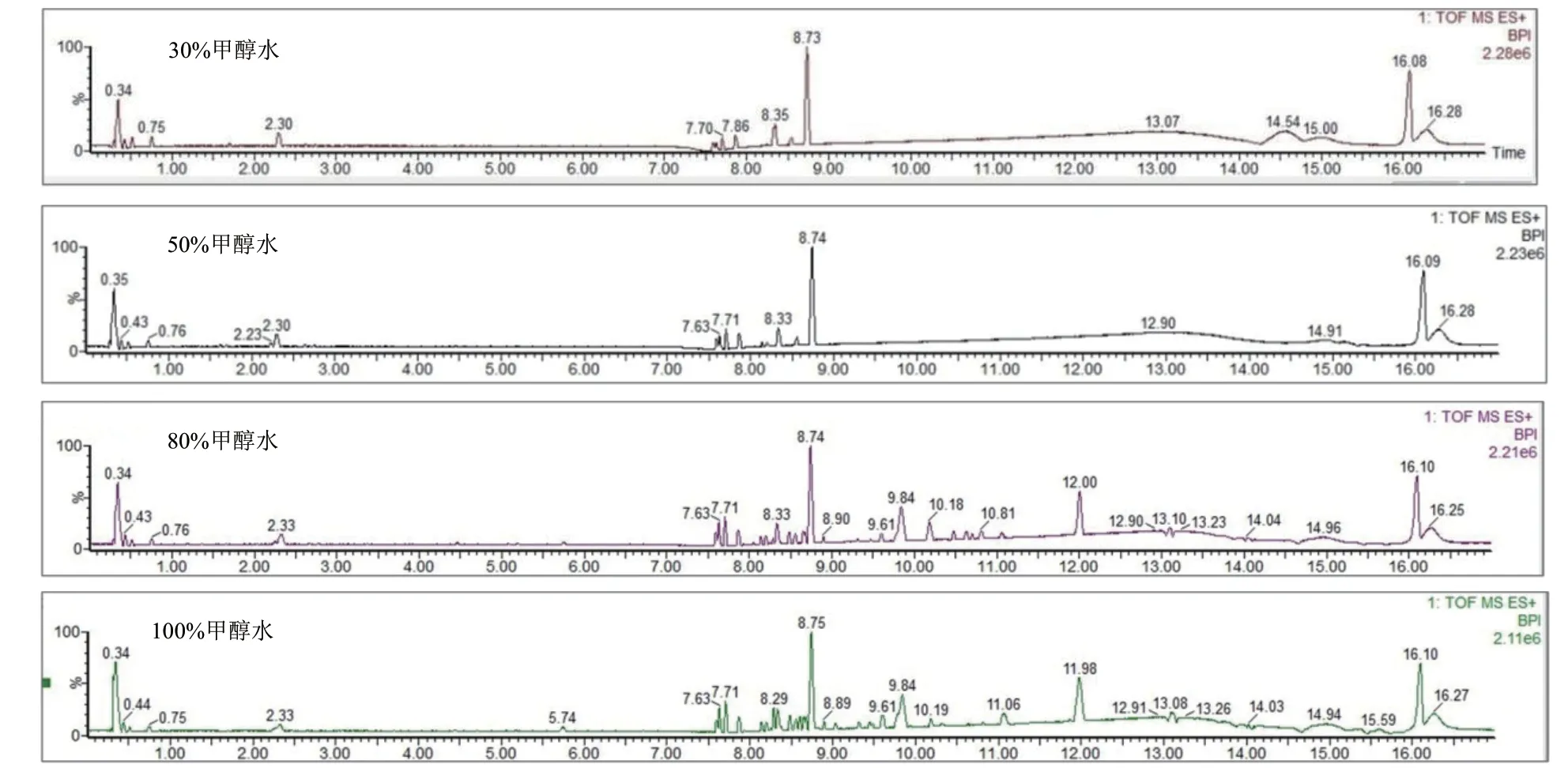
圖1 不同濃度提取溶劑下BPI圖
2.2 代謝組分析方法考察
對優(yōu)化的代謝組分析方法的穩(wěn)定性、精密度和重復性進行了考察。同一份樣品提取液分別放置0 h、5 h、10 h、20 h、30 h、40 h之后,進行UPLCQTOF分析,其相對保留時間的RSD<5%,主要共有峰面積的RSD≤7%,說明樣品提取溶液至少在40 h內基本保持穩(wěn)定;精密度考察中,同一份樣品連續(xù)進樣5次,其色譜峰相對保留時間的RSD<2%,表明方法精密度良好;重復性考察中,同一類型樣品、不同次數(shù)提取,其色譜峰相對保留時間的RSD<2%,表明方法重復性良好。
2.3 數(shù)據分析方法優(yōu)化
將苗期樣本按陽性(轉基因)和陰性(非轉基因)分成兩組,經UPLC-Q/TOF-MS上機后得到代謝組數(shù)據。將得到的代謝組數(shù)據進行PCA分析,正、負兩種離子采集模式下得到Score圖(圖2)。在正離子模式下,陽性和陰性組間距離較近,同組樣品距離較遠,且分布比較離散,兩組樣品沒有完全區(qū)分,分組效果不明顯,說明樣本之間存在微量差異,但分析獲得的差異不大。負離子模式下,陽性和陰性兩組樣品之間相互交錯,組間比較離散,沒有達到分組效果。因此,由PCA分析得到的結論是兩組樣本差異不太明顯,沒有完全區(qū)分開來。
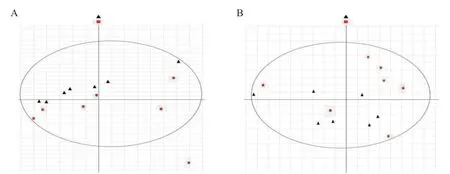
圖2 轉基因水稻及其受體苗期葉片的PCA分析圖
采用OPLS-DA分析模式對苗期的兩組樣本進行數(shù)據處理,得到Score圖(圖3)。在正離子模式下,陽性和陰性兩組樣品之間沒有出現(xiàn)交叉和重疊,且同組之間距離較近,組內樣品個體之間離散程度較小,達到很好的分組效果;在負離子采集模式下,兩組樣本雖然能夠區(qū)分開來,但是組間樣本離散程度較大,效果沒有陽離子模式好。說明OPLS-DA分析模式在兩組樣品間的區(qū)別能力比PCA分析模式較好,且在正離子采集模式下分組效果更好。
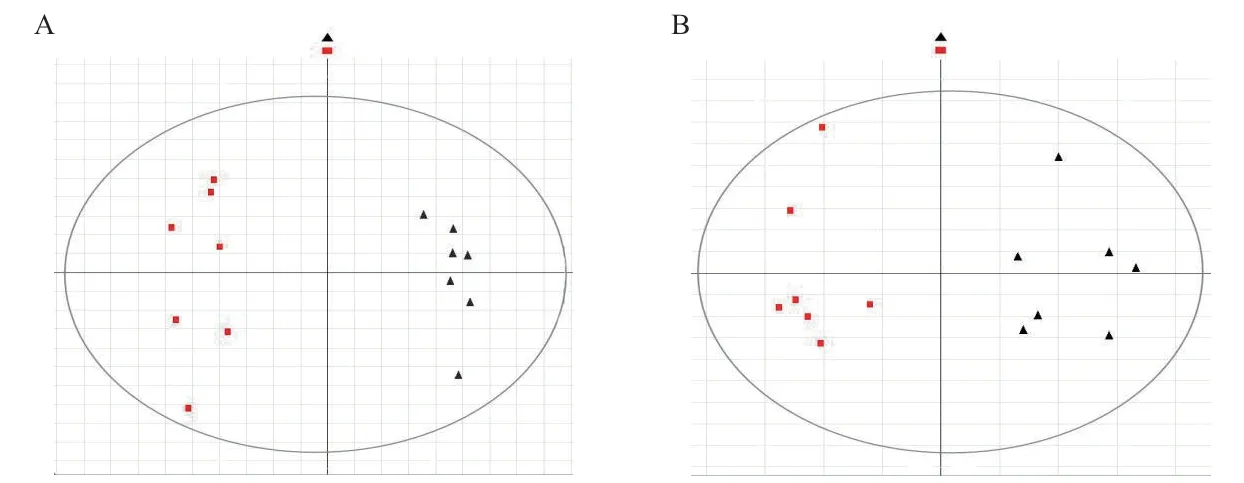
圖3 轉基因水稻及其受體苗期葉片的OPLS-DA分析圖
2.4 代謝組差異分析
應用Progenesis QI軟件進行分析,正離子模式下共檢測到6 459個化合物,負離子模式下共檢測到6 783個化合物。選擇VIP圖中≥1的點,根據P≤0.05、Max fold change≥2條件進行篩選,共篩選出49個差異性位點。導出所有代謝物Normal Abundance Profile圖(圖4),發(fā)現(xiàn)在正離子模式下,差異較明顯的是14.99 _782.5849 m/z代謝物,在同組樣本中分布不太均勻,總體上在陽性組的含量比陰性組較高;在負離子模式下,差異較明顯的是4.73_7491.1927 m/z代謝物。
應用基于R語言的軟件包MAIT對代謝組數(shù)據進行數(shù)據處理。該軟件的分析步驟包括peak detection、peak annotation、statistical analysis,具 備PCA、OPLS-DA、SVM、KNN等預測、統(tǒng)計分析功能。對苗期樣本進行、代謝組差異篩選、差異代謝物進行相關性分組(圖5)和歐式距離分組(圖6)分析。結果表明,隨著P值減小,陽性和陰性分組越明顯,也越能獲得差異較大、數(shù)據更穩(wěn)定的代謝物。
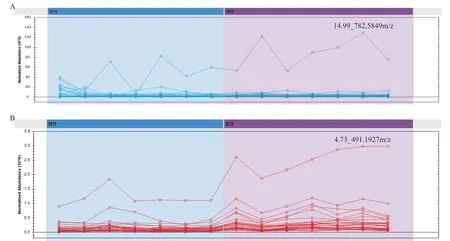
圖4 49個差異代謝物在兩組樣本中的分布情況
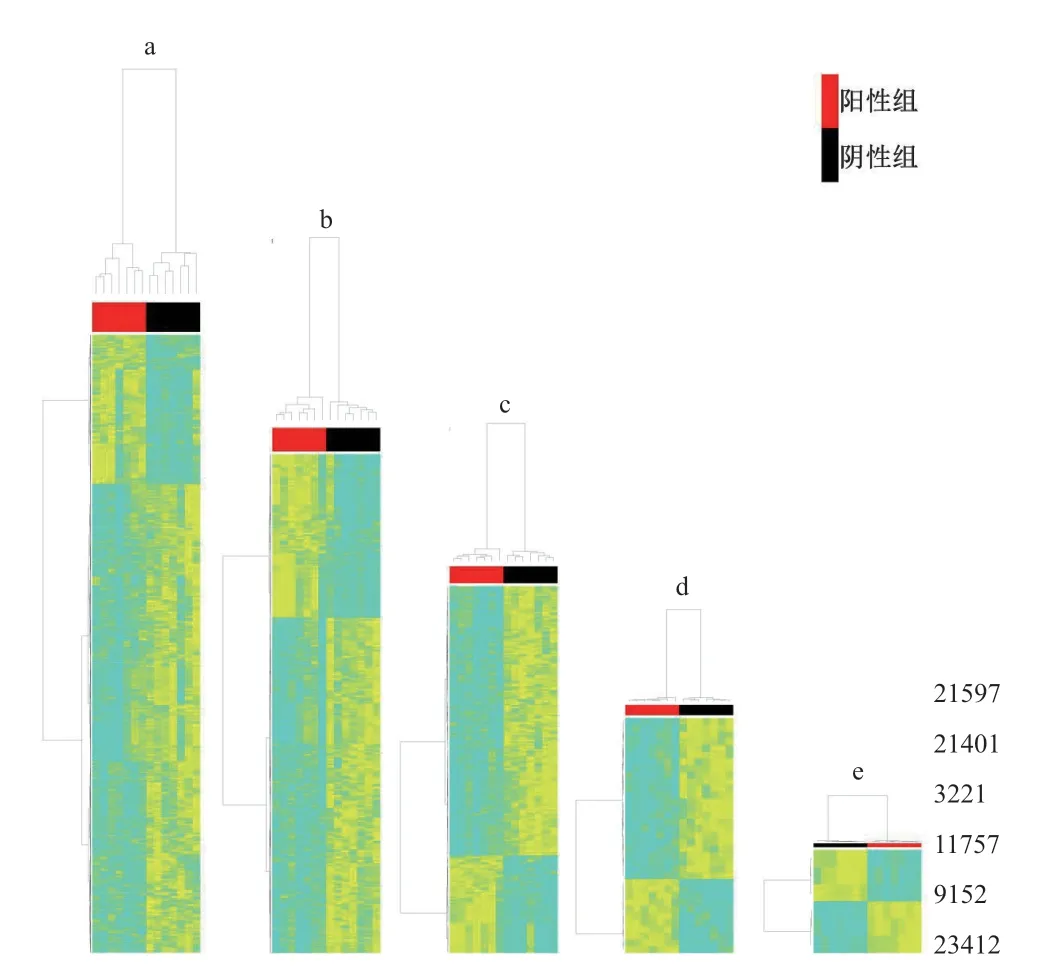
圖5 轉基因抗蟲水稻苗期葉片代謝物相關性分析
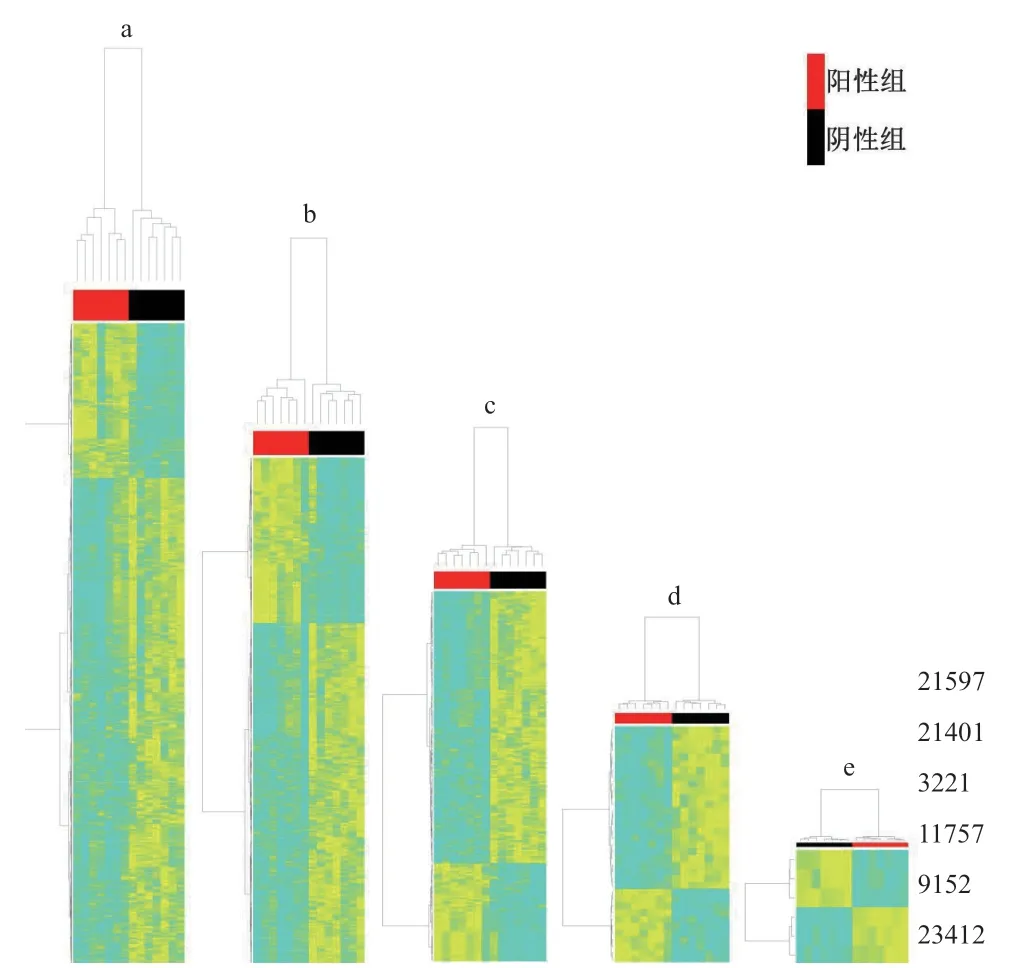
圖6 轉基因抗蟲水稻苗期葉片代謝物歐氏距離分析
通過相關性分組(圖5)和歐式距離分組(圖6),均獲得差異代謝物為21 597、21 401、3 221、11 767、9 152、23 412。其含量詳細信息見圖7。
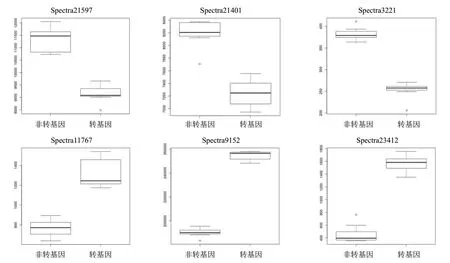
圖7 差異代謝物在兩組樣本中的分布情況
3 討論
3.1 基于代謝組學的轉基因生物安全評價實驗設計
轉基因生物安全評價是轉基因生物安全管理的重要支撐,包括分子特征分析、環(huán)境安全評價和食用安全評價。基于非靶向性的代謝組學分析,是對現(xiàn)有安全評價方法體系的完善和補充。在開展轉基因食用安全評價和環(huán)境安全評價的同時,開展代謝組生物安全評價,是一個較為合理的解決方案。食用安全和環(huán)境安全實驗中,環(huán)境和條件均控制在相對精準的條件下,技術方案設置了不同的處理水平(飼喂、接蟲、干旱等)和對照材料,可以在對實驗材料進行常規(guī)靶向性分析的同時,開展非靶向性的代謝組分析。Mesnage等[19]結合大鼠喂養(yǎng)試驗,以大鼠的肝臟和腎臟為檢測對象,開展轉錄組學和代謝組學分析,以觀測轉基因玉米可能的生理毒性。Peng等[18]以轉cry和epsps基因水稻灌漿期(開花后14 d和35 d)籽粒為檢測對象,為了解轉基因水稻與非轉基因受體在種子發(fā)育階段的代謝變化提供信息。
3.2 代謝組學分析平臺
本研究的目標為建立一套完整的轉基因水稻代謝組生物安全評價技術流程,包括外界脅迫處理、取樣節(jié)點和組織、樣品前處理、樣品代謝組分析、數(shù)據處理、代謝途徑和非預期效應分析等步驟。在代謝組分析過程中,常用的代謝組學分析技術有核磁共振(NMR)[20]、氣質聯(lián)用(GC-MS)[21-22]、液質聯(lián)用(LC-MS)[23]、傅里葉變換紅外光譜與質譜聯(lián)用(FT-ICR MS)[24]、毛細管電泳質譜聯(lián)用(CEMS)[25]等。近幾年出現(xiàn)的超高效液相色譜(UPLC)技術大大提高了分離速度,其與四級桿飛行時間質譜(Q/TOF)聯(lián)用組成超高效液相色譜-飛行時間質譜(UPLC-Q/TOF/MS),已廣泛應用于作物代謝組學研究[18,26]。Wang等[11]以從我國不同省份收集的復合性狀轉基因玉米12-5×IE034、12-5、IE034和常規(guī)品種為研究對象,應用UPLC-MS平臺對代謝組進行分析,發(fā)現(xiàn)與親本12-5和IE034相比,雜交品種12-5×IE034分別有15和112個不同的代謝物,其差異小于其他玉米品種之間的差異;Peng等[18]應用UHPLC-QTOF-MS分析平臺,在籽粒灌漿期和成熟期分別鑒定出161和138個差異代謝物。
4 結論
本研究以轉基因抗蟲水稻及其非轉基因受體為研究對象,建立了包括樣品培養(yǎng)、代謝物提取、UPLC-QTOF/MS分析、數(shù)據處理等步驟的轉基因作物代謝組評價技術流程,并對代謝組提取方法、數(shù)據處理方法、數(shù)據分析平臺等進行了優(yōu)化評估。結果表明,應用80%甲醇水能有效提取水稻苗期葉片中的代謝物;經UPLC分離、QTOF/MS分析、正交校正的偏最小二乘辨別分(OPLS-DA)等計算方法,能夠有效發(fā)現(xiàn)轉基因水稻及其受體之間的差異代謝物。

