機械激活性離子通道壓電蛋白Piezo1通過Notch信號通路介導牙周膜干細胞成骨分化作用機制研究
王林 王熙 季楠 李海梅 蔡世新
1.衡水市人民醫院口腔正畸修復科,衡水 053000;2.承德護理職業學院口腔教研室,承德 067000
牙齒發育不良是指患兒的上下牙齒對位不良,影響日常生活,通常采用正畸治療[1-2],主要通過牙齒矯形器,給予適當的、持續的力量,使牙位移動,從而達到矯正效果[3-4]。既往研究[5-6]主要集中于分析牙周膜的作用,即牙周膜組織在持續應力刺激下可以不斷的形成新的骨性結構,促進牙槽骨的改建,從而達到矯形的目的,但是具體的機制尚未明了。
近年來,隨著人牙周膜干細胞(human periodontal ligament stem cells,hPDLSC)的分離成功,研究的熱點主要集中于牙周膜干細胞的成骨分化方面[7-8]。本研究以hPDLSC為研究對象,構建體外機械牽張應力細胞模型,以新型機械激活性離子通道壓電蛋白Piezo1為切入點,構建Piezo1蛋白的過表達載體和siRNA干擾載體,從過表達Piezo1蛋白和抑制Piezo1蛋白兩個方向上探究Piezo1蛋白在hPDLSC向成骨細胞分化的作用機制。以成骨基因堿性磷酸酶(alkaline phosphatase,ALP)、Runt相關基因2(Runt-related transcription factor 2,Runx2)、骨鈣素(os teocalcin,OCN)和骨涎蛋白(bone sialoprotein,BSP)為成骨的標志物[9-12],探究Piezo1在促進hPDLSC成骨分化方面的作用。
1 材料和方法
1.1 hPDLSC的分離、培養
選取2016年1月1日—2018年1月1日就診于北京兒童醫院正畸科的8~14歲兒童因阻生而拔出的年輕恒牙的牙周膜組織為細胞來源,研究方案通過北京兒童醫院倫理委員會同意并通過,取得兒童直系監護人的知情同意授權書。納入標準:所有兒童均無活動性牙齒感染,細胞均來源于因阻生而拔出的恒牙牙周膜組織。排除標準:有明顯牙周炎或感染癥狀的患兒。
收集牙周膜組織后采用酶消化法提取hPDLSC。采用眼科剪和無菌刀片刮取牙周膜組織,用預熱的PBS溶液沖洗3次,加入Ⅰ型膠原蛋白酶消化處理50 min,置于37 ℃恒溫箱中,每5 min搖晃一次,使牙周膜組織與膠原蛋白酶充分混合,常溫離心機3 000 r·min-1離心5 min,棄掉上清液,加入含15%胎牛血清的DMEM培養基,制成細胞懸液,然后接種于25 cm×25 cm的Flask’s培養瓶中,放入37 ℃,15%CO2濃度細胞培養箱中進行原代干細胞培養。
1.2 hPDLSC的鑒定
本研究采用免疫組織化學染色法檢測角蛋白(pan-cytokeratin)、波形蛋白(vimentin)的表達。選取第3代hPDLSC作為實驗細胞,以2×104細胞量接種于預先鋪有無菌圓形玻璃板的24孔板中,加入含15%胎牛血清的DMEM培養基,37 ℃,15%CO2濃度細胞培養箱中孵育48 h,待細胞融合率達80%時,棄掉培養基,加入預熱的PBS溶液沖洗3次,加入4%多聚甲醛孵育20 min,PBS溶液沖洗3次,加入0.4%Triton X-100孵育5 min,PBS溶液沖洗3次,5%BSA封閉20 min,加入一抗(pan-cytokeratin,vimentin兔抗人一抗),4 ℃低溫水箱孵育過夜,PBS溶液沖洗3次,加入二抗(山羊抗兔CY3二抗)孵育10 min,使用DAB工作液進行染色。
采用流式細胞術對hPDLSC的標志物CD146和STRO-1進行鑒定,收集第3代hPDLSC細胞,加入無血清的DMEM培養基,制備細胞懸液,細胞密度控制在每毫升3×107個;加入5支EP管,每管100 μL,加入一抗體系:STRO-1兔抗人一抗,CD146兔抗人一抗,STRO-1和CD146的同型對照單抗以及PBS空白對照,加入到5支EP管中,4 ℃低溫避光孵育20 min,PBS漂洗,采用流式細胞儀檢測表面蛋白CD146和STRO-1。
1.3 siRNA-Piezo1干擾載體的構建
siRNA-Piezo1干擾載體的構建和篩選由上海吉凱公司完成。首先通過Pubmed Genebank查詢人源Piezo1蛋白的基因序列以及ORF序列和3’-UTR序列。根據siRNA靶點設計原理,構建siRNA-Piezo1的干擾序列。設計3種干擾序列,具體如下。siRNA-Piezo1-homo-3299:GCGTCATCATCGTGTGTAAGA;siRNA-Piezo1-homo-5762:GCCTCAAGTACTTCATC ATCAACT;siRNA-Piezo1-homo-1875:GCGTCT TCCTTAGCCATTACT。選取上海吉凱公司提供的hU6-MCS-CMV-EGFP慢病毒載體作為酶切對象,加入siRNA-Piezo1干擾序列后,轉染人胚腎293T細胞,進行克隆測定,然后進行質粒的抽提、慢病毒的包裝以備用。
1.4 Piezo1過表達載體的構建
Piezo1基因過表達載體的構建和篩選由上海吉凱公司完成。首先對目的基因進行過表達引物設計,Piezo1(4589-11)序列為:ACGGGACTAAGCGCATTGCAATTTCC。然后逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction,RTPCR)擴增目的基因序列,將目的基因擴增序列加入線性化表達載體,選取上海吉凱公司提供的hU6-MCS-CMV-EGFP慢病毒載體作為酶切對象,加入Piezo1基因過表達載體序列后,轉染人胚腎293T細胞,進行克隆測定,然后進行質粒的抽提,慢病毒的包裝以備用。
1.5 應用Flexcell 4000T機械牽張應力儀器構建體外牽張力學hPDLSC細胞模型和細胞分組
將hPDLSC接種于Flexcell公司的BIO膜性六孔板中,加入含15%胎牛血清的DMEM培養基,待細胞融合率達50%時,加入無血清的DMEM培養基進行“同位化”處理,孵育過夜后,加入含15%胎牛血清的DMEM培養基,將膜性六孔板加載Flexcell 4000T機械牽張應力儀器,根據預實驗結果,即牽張應力作用時間為12 h對細胞的牽張應力作用最明顯,所以選取12 h牽張應力進行后續試驗。同時設置六孔板形變量為15%,每分鐘6個循環。
本實驗分成5組:空白對照組:不加載機械牽張應力;牽張應力組:加載12 h機械牽張應力;陰性對照組:加載12 h機械牽張應力,并且轉染空白無序序列的慢病毒轉染hPDLSC(不含有功能質粒的慢病毒);siRNA干擾組:加載12 h機械牽張應力,并且轉染siRNA-Piezo1干擾序列的慢病毒轉染hPDLSC;過表達組:加載12 h機械牽張應力,并且轉染Piezo1過表達序列的慢病毒轉染hPDLSC。
1.6 熒光定量聚合酶鏈反應(real time quantitative polymerase chain reaction,RT-qPCR)檢測Piezo1、Notch1和成骨基因的表達
利用胰蛋白酶收集上述各組細胞,經PBS溶液清洗3次,常溫離心機1 500 r·min-1離心5 min,取沉淀,加入1 mL Trizol溶劑,提取細胞總RNA,保證RNA純度范圍為1.8~2.1,然后利用TAKARA逆轉錄試劑盒的要求,采用20 μL反應體系逆轉錄為cDNA,-80 ℃保存,采用TAKARA熒光定量PCR試劑盒(SYBR Premix Ex TaqⅡ試劑盒)的要求,采用FTC-2000 RT-qPCR系統和50 μg反應體系對樣本DNA進行分析,溶解曲線確定Tm值為53.7 ℃,統計并記錄各組樣本的CT值,采用2-△△CT法對Piezo1基因和成骨基因OCN和BSP的表達進行統計。Piezo1、OCN、BSP和內參基因磷酸甘油醛脫氫酶(glyceraldehyde phosphate dehydrogenase,GAPDH)引物設計由上海生工公司設計并檢測合格(表1)。

表1 引物序列Tab 1 Primer sequences
1.7 Fluo-3 AM探針檢測細胞內鈣離子含量
利用胰蛋白酶收集上述各組細胞,經PBS溶液清洗3次,接種于預先鋪有細胞圓形玻璃爬片的24孔板,加入不含鈣離子的培養基,孵育24 h,采用Hank’s平衡鹽溶液清洗3次,加入預先1∶5稀釋的Fluo-3 AM工作液,避光孵育30 min,樹膠封片,倒置熒光顯微鏡觀察細胞內鈣離子含量。
1.8 Western blot檢測成骨標志蛋白ALP和Runx2的表達
預冷處理各組細胞,經PBS溶液清洗3次,加入1 mL RIPA細胞裂解液,冰上裂解30 min,收集入1.5 mL離心管中,4 ℃、5 000 r·min-1離心5 min(離心半徑為3 cm)后取上清,95 ℃煮沸后,收集蛋白備用。制備濃縮膠10 mL,分離膠20 mL。上樣后(每孔上樣量為20 μL)電泳分離,轉膜后用BSA封閉,封閉的時間為30 min,封閉后PBST溶液洗膜,重復3次,加入一抗(兔抗人)(ALP、Runx2、OCN和BSP)1∶10 000稀釋后加入樣本離子膜(孵育的溫度為4 ℃,時間為>12 h);第二天用PBST稀釋液洗膜3次,加用山羊抗兔IgG二抗(1∶1 000)稀釋后孵育1.5 h(孵育溫度為37 ℃),用PBST稀釋液洗膜3次,用DAB顯影液處理樣本。應用Image J軟件分析蛋白灰度,計算相對表達量。
1.9 統計學分析
采用SPSS 19.0軟件對數據進行統計學分析,定量資料采用均數±標準差表示,各組間Piezo1 mRNA的相對表達量、蛋白表達量、鈣離子含量等比較采用方差分析,組間比較采用q檢驗,認為P<0.05具有統計學差異。
2 結果
2.1 hPDLSC的鑒定結果
免疫組織化學染色結果顯示,hPDLSC波形蛋白染色陽性,角蛋白染色陰性。流式細胞術檢測hPDLSC標志物STRO-1表達陽性,CD146表達陽性(圖1、2)。
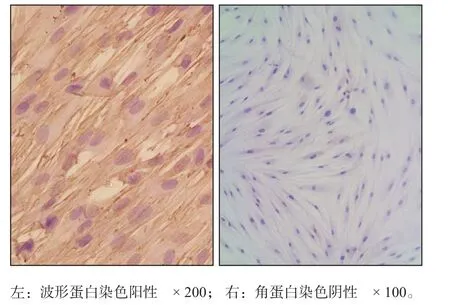
圖1 hPDLSC的鑒定 免疫組織化學染色Fig 1 Identi fication of hPDLSC immunohistochemical staining
2.2 RT-PCR篩選3種序列的Piezo1 mRNA表達結果
RT-PCR檢測結果顯示:陰性對照組中Piezo1 mRNA相對表達量為(1.25±0.02),siRNA-Piezo1-homo-3299序列,siRNA-Piezo1-homo-5762序列和siRNA-Piezo1-homo-1875序列中Piezo1 mRNA相對表達量分別為1.03±0.02、0.22±0.01、1.17±0.03,各組比較差異有統計學意義(F=12.009,P=0.000);并且siRNA-Piezo1-homo-5762與另外2組相比,Piezo1 mRNA相對表達量明顯減少,差異有統計學意義(q=3.021,3.548,P<0.05)。
2.3 siRNA-Piezo1干擾序列和Piezo1過表達載體序列轉染hPDLSC的結果
空病毒載體、siRNA-Piezo1干擾序列和Piezo1過表達載體序列均可以通過慢病毒轉染hPDLSC,而且轉染效率較高,均在90%(圖3)。
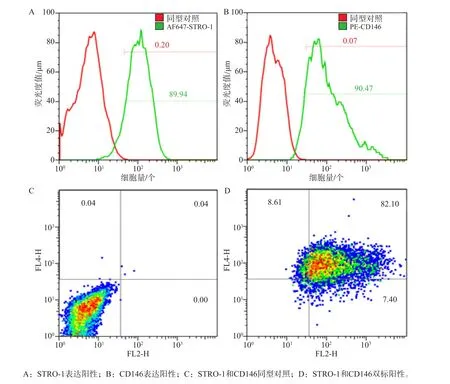
圖2 流式細胞儀檢測結果Fig 2 The results of the flow cytometry
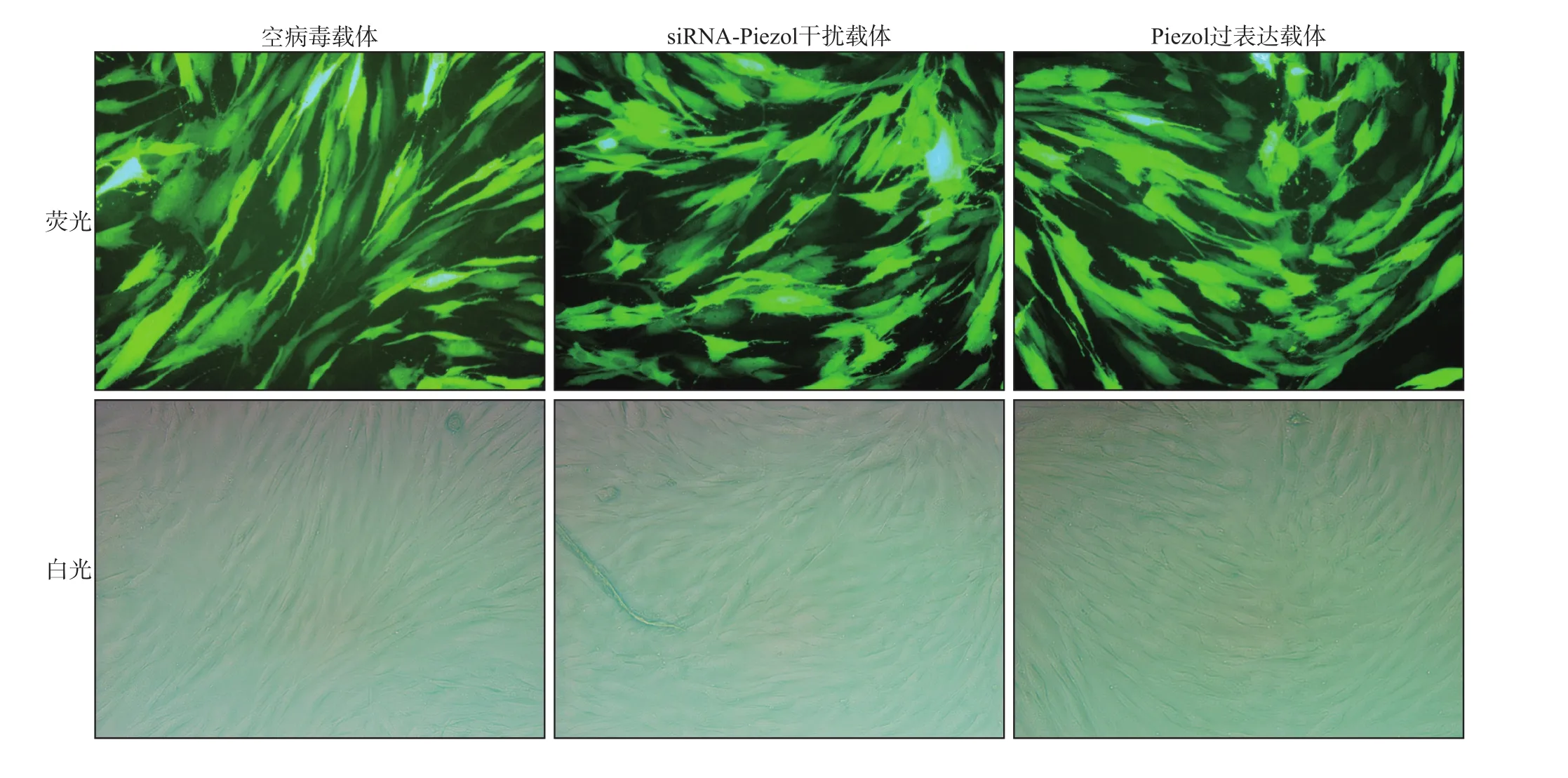
圖3 siRNA-Piezo1干擾序列和Piezo1過表達載體序列轉染hPDLSC 倒置熒光顯微鏡 × 400Fig 3 The siRNA-Piezo1 interference sequence and Piezo1 overexpression vector sequence were transfected into hPDLSC inverted fluorescence microscope × 400
2.4 RT-PCR檢測Piezo1、Notch1和成骨基因的表達
siRNA干擾組、過表達組、空白對照組、牽張應力組和陰性對照組Piezo1 mRNA的表達水平差異有統計學意義(F=9.573,P<0.05)。過表達組、空白對照組Piezo1 mRNA表達水平明顯高于siRNA干擾組,差異有統計學意義(q=3.893,P<0.05;q=2.113,P<0.05)。牽張應力組Piezo1 mRNA表達水平明顯高于空白對照組,差異有統計學意義(q=2.006,P<0.05),但是與陰性對照組比較,差異無統計學意義(q=0.208,P>0.05)(圖4A)。siRNA干擾組、過表達組、空白對照組、牽張應力組和陰性對照組Notch1 mRNA的表達水平差異有統計學意義(F=11.003,P<0.05)。過表達組、空白對照組Notch1 mRNA水平明顯高于siRNA干擾組,差異具有統計學意義(q=2.991,P<0.05;q=2.463,P<0.05)。牽張應力組Notch1 mRNA表達水平明顯高于空白對照組,差異有統計學意義(q=2.331,P<0.05),但是與陰性對照組比較,差異無統計學意義(q=0.188,P>0.05)(圖4B)。成骨基因ALP、Runx2、OCN和BSP的表達也有同樣的趨勢(圖4C~F)。
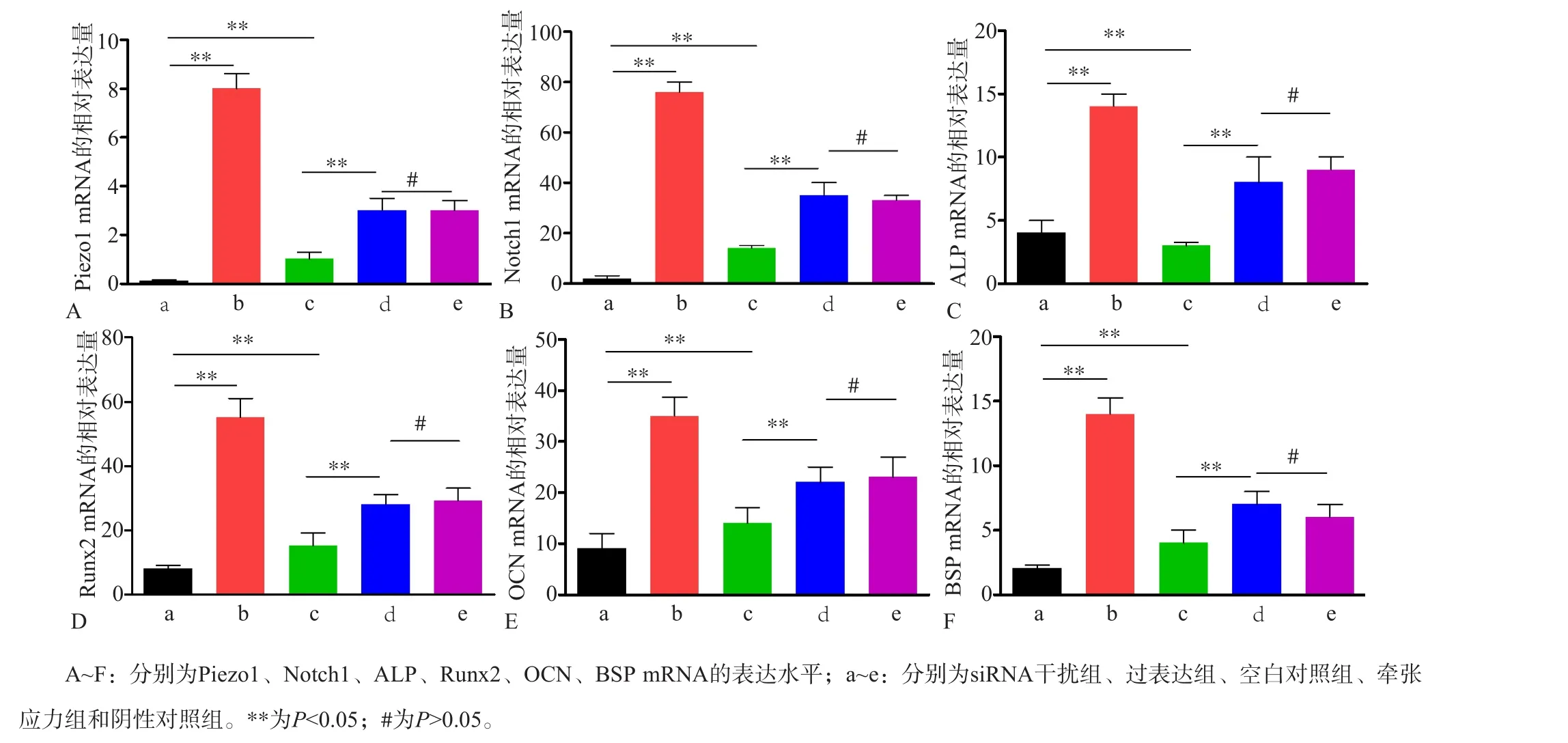
圖4 RT-qPCR檢測Piezo1、Notch1和成骨基因ALP、Runx2、OCN和BSP的表達結果Fig 4 The expression of piezo1, Notch1, ALP, Runx2, OCN and BSP were detected by RT-qPCR
2.5 Western blot檢測成骨標志蛋白ALP和Runx2的表達
Western blot檢測成骨標志蛋白ALP和Runx2的表達結果見圖5。siRNA干擾組、過表達組、空白對照組、牽張應力組和陰性對照組ALP蛋白差異有統計學意義(F=11.207,P<0.001);過表達組和空白對照組ALP蛋白表達水平明顯高于siRNA干擾組,差異有統計學意義(q=2.991,P<0.05;q=2.451,P<0.05);牽張應力組ALP蛋白表達水平明顯高于空白對照組,差異有統計學意義(q=3.007,P<0.05)。但是牽張應力組ALP蛋白表達水平與陰性對照組比較,差異無統計學意義(q=0.451,P>0.05)。
siRNA干擾組、過表達組、空白對照組、牽張應力組和陰性對照組Runx2蛋白差異有統計學意義(F=18.473,P<0.001);過表達組和空白對照組Runx2蛋白表達水平明顯高于siRNA干擾組,差異有統計學意義(q=3.499,P<0.05;q=3.568,P<0.05);牽張應力組Runx2蛋白表達水平明顯高于空白對照組,差異有統計學意義(q=2.661,P<0.05)。但是牽張應力組Runx2蛋白表達水平與陰性對照組比較,差異無統計學意義(q=0.328,P>0.05)。
2.6 細胞內鈣離子檢測結果
siRNA干擾組、過表達組、空白對照組、牽張應力組和陰性對照組細胞內鈣離子檢測結果見圖6。由圖6可見,過表達組、牽張應力組細胞內鈣離子熒光強度明顯高于siRNA干擾組。采用Image J軟件統計細胞內鈣離子熒光強度,結果顯示siRNA干擾組、過表達組、空白對照組、牽張應力組和陰性對照組鈣離子熒光強度分別為102.03 μm±15.02 μm、473.57 μm±34.37 μm、158.29 μm±10.55 μm、247.98 μm±11.45 μm、259.23 μm±10.24 μm,差異有統計學意義(F=10.009,P<0.05)。過表達組、空白對照組細胞內鈣離子熒光強度明顯高于siRNA干擾組,差異有統計學意義(q=2.571,P<0.05;q=2.336,P<0.05);牽張應力組細胞內鈣離子熒光強度明顯高于空白對照組,差異有統計學意義(q=3.124,P<0.05)。但是牽張應力組細胞內鈣離子熒光強度與陰性對照組比較,差異無統計學意義(q=0.995,P>0.05)。
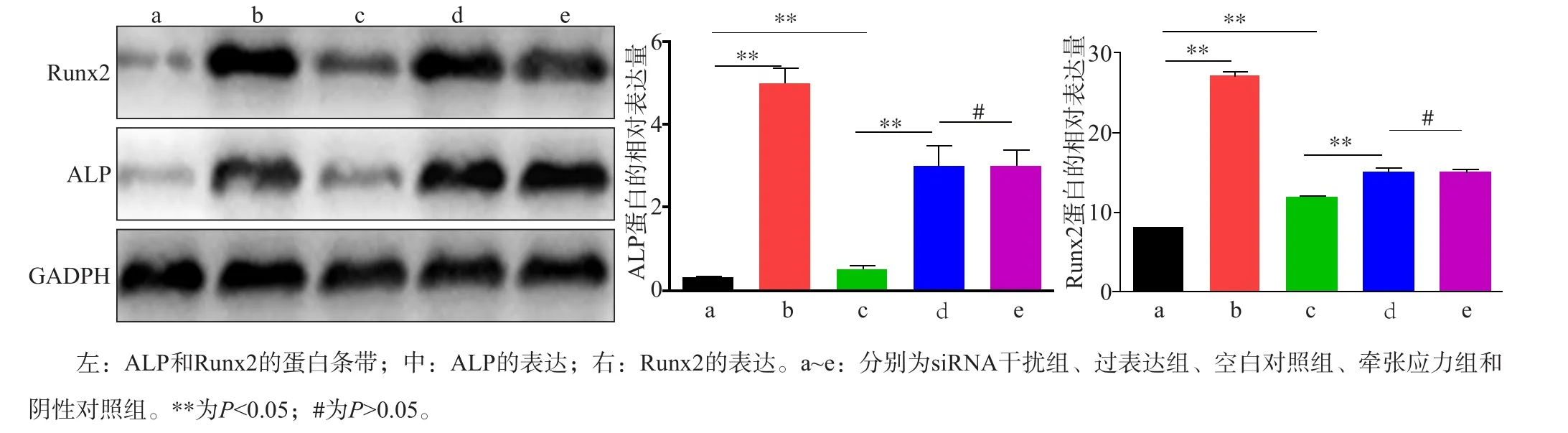
圖5 Western blot檢測ALP和Runx2的表達Fig 5 The expression of ALP and Runx2 was detected by Western blot
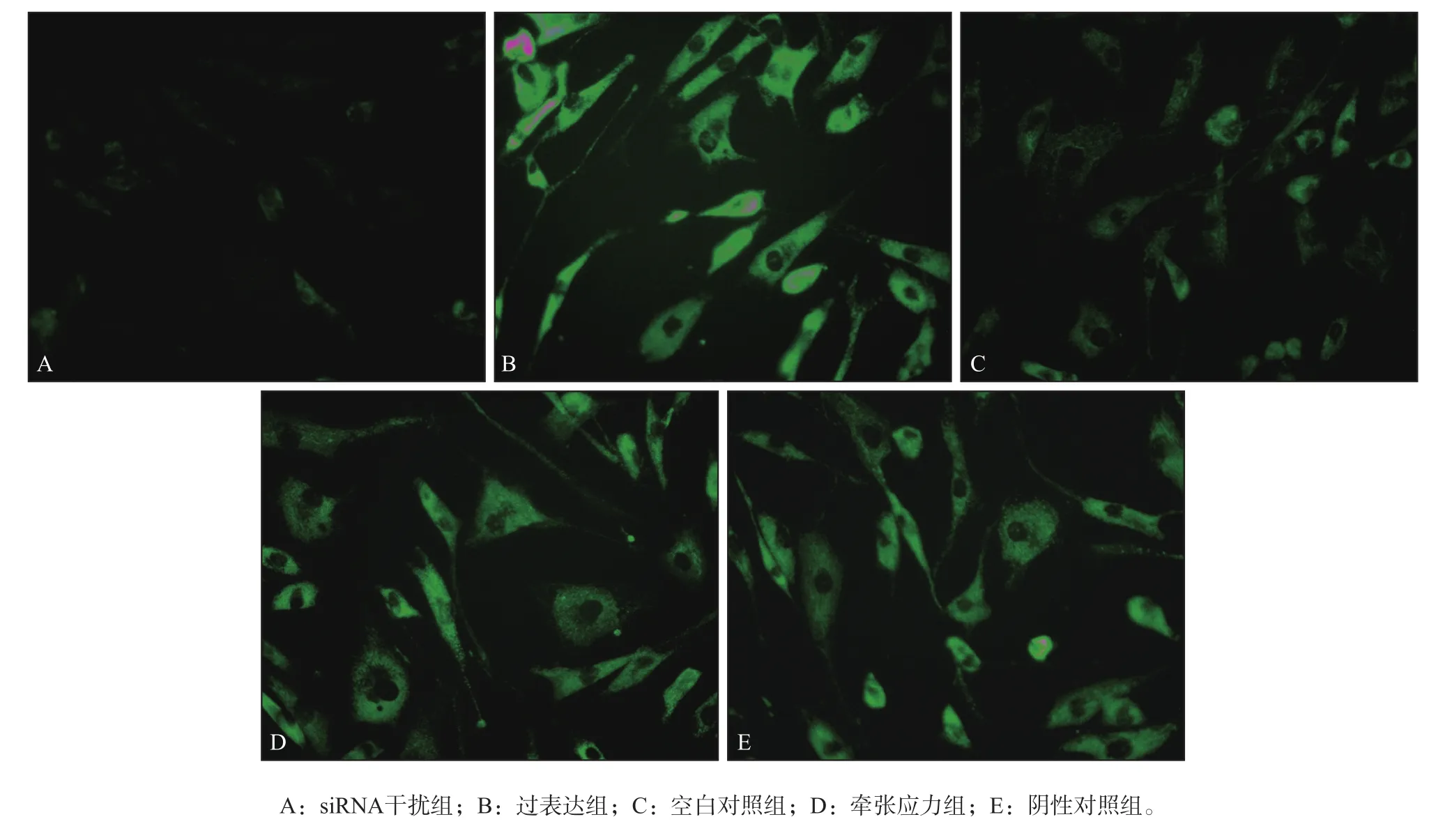
圖6 細胞內鈣離子檢測結果Fig 6 The result of the intracellular calcium
3 討論
既往有文獻[13]報道,在正畸科矯正口齒發育不良的過程中,機械應力刺激可以促進牙周骨組織的重建。適度機械牽張應力刺激對牙齒的正畸存在積極意義,但是具體的作用機制尚未明了。Song等[14]通過構建體外機械牽張應力模型,以成纖維細胞為對象,探究機械牽張應力對于口齒矯形的作用,結果表明,機械牽張應力可以通過內質網應激系統刺激成纖維細胞的增殖與凋亡,從而影響正畸效果。所以,本研究利用Flexcell 4000T機械牽張應力儀器構建體外牽張應力刺激下的細胞模型,以機械敏感性離子通道Piezo1為研究的切入點,以Ca2+為第二信使,傳遞機械信號,通過Notch1信號通路,激活成骨基因ALP、Runx2、OCN和BSP的表達,進而促進hPDLSC的成骨分化作用。
Piezo1蛋白離子通道是近年來新發現的一種機械敏感性離子通道,有學者[15-16]報道,Piezo1蛋白離子通道與骨性關節炎的軟骨細胞密切相關,而且可以被陽離子非特異性阻滯劑GsMT4所阻斷。另外,通過冰凍電子顯微鏡解析Piezo1蛋白的三維立體結構,發現Piezo1蛋白是一種7跨膜的三棱錐狀結構,Ca2+可通過Piezo1蛋白離子通道,從而發揮作用[17]。本研究中利用Fluo-3 AM探針檢測細胞內鈣離子含量,利用綠色熒光探針特異性結合細胞內的鈣離子,結果顯示,過表達組細胞內鈣離子熒光強度明顯高于siRNA干擾組,差異有統計學意義(P<0.05)。說明Piezo1蛋白離子通道表達量增多后,在機械應力刺激下,可以有更多的Ca2+涌入細胞內,發揮第二信使的作用。另外牽張應力組細胞內鈣離子熒光強度明顯高于空白對照組,差異有統計學意義(P<0.05),說明機械牽張應力刺激可以促進Piezo1蛋白的表達。另外本研究采用RT-PCR檢測Piezo1 mRNA水平的表達,結果證明機械應力的確可以促進Piezo1蛋白的表達。
RNA干擾技術是分子生物學領域常用的一種阻斷基因表達的方法[18-19]。本研究利用siRNA干擾技術,構建siRNA-Piezo1干擾質粒和Piezo1過表達質粒,并且通過慢病毒轉染hPDLSC細胞,利用RTPCR檢測目的基因Piezo1的表達。結果證明,過表達組Piezo1 mRNA的表達水平明顯高于siRNA干擾組(P<0.05),說明過表達組的Piezo1表達量要高于siRNA干擾組。另外,牽張應力組Piezo1 mRNA的表達水平明顯高于空白對照組(P<0.05),說明牽張應力可以促進Piezo1的表達。成骨基因ALP是成骨細胞表型最重要的生物標志物,是成骨細胞礦化的標志之一[20]。Runx2是骨形成的標志蛋白,反應了骨細胞的生物活性[21]。故此本研究采用成骨基因ALP、Runx2、OCN和BSP的表達作為檢測Piezo1在促進PDLSC成骨分化方面的作用。RT-PCR結果和Western blot結果表明,過表達組ALP、Runx2、OCN和BSP的mRNA和蛋白表達水平要明顯高于siRNA干擾組(P<0.05)。結果說明,過表達組hPDLSC的成骨能力高于siRNA干擾組。牽張應力組ALP、Runx2、OCN和BSP的mRNA和蛋白表達水平明顯高于空白對照組(P<0.05),結果說明牽張應力可以促進PDLSC成骨分化。
Notch1信號通路分子是與干細胞的分化密切相關的一類分子,邱申彩等[22]的研究表明,Notch1的過表達載體可以促進hPDLSC的分化和增殖。本研究RT-PCR結果表明,siRNA-Piezo1可以降低Notch1的表達,抑制成骨基因ALP、Runx2、OCN和BSP的表達,而Piezo1過表達質粒可以促進Notch1的表達,促進成骨基因ALP、Runx2、OCN和BSP的表達。與hPDLSC的成骨分化結果相結合,筆者認為,機械牽張應力可以促進hPDLSC成骨分化的作用是通過Notch1信號通路介導。
綜上所述,機械牽張應力可以促進Piezo1蛋白的表達,以Ca2+為第二信使,激活Notch1信號通路,激活ALP、Runx2、OCN和BSP的表達,促進hPDLSC成骨分化。而siRNA-Piezo1干擾質粒可以阻斷這一進程,反之,Piezo1的過表達質粒可以促進PDLSC成骨分化進程。
利益沖突聲明:作者聲明本文無利益沖突。

