ZAP蛋白在抗病毒天然免疫應答過程中的功能研究
陳納,張寶戈,洪艷,許李鋒,謝正露,陳吉龍,3,馬燕梅*
(1. 福建農林大學動物科學學院/蜂學學院,福建 福州 350002; 2. 福建農林大學金山學院,福建 福州 350002;3. 中國科學院微生物研究所/中國科學院病原微生物與免疫學重點實驗室,北京 100101)
機體免疫包括天然免疫和適應性免疫。天然免疫是機體在長期種系發育與進化過程中逐漸形成的一種先天性免疫防御功能,為宿主抵御病原微生物入侵的第一道防線,是當前免疫學前沿研究熱點之一。宿主細胞與病毒長期共存過程中進化出一些具有抗病毒作用的因子稱宿主限制因子,其可在病毒增殖的特定環節與病毒相互作用從而阻斷病毒的復制。近年來,新型宿主限制因子ZAP蛋白(zinc-finger antiviral protein,鋅指抗病毒蛋白)逐漸成為抗病毒天然免疫領域的研究熱點,人們發現該蛋白在天然免疫應答中發揮重要作用,可通過多種途徑直接或間接抑制病毒的復制,同時病毒也已進化出多種機制拮抗ZAP蛋白的抗病毒活性。本文對宿主ZAP蛋白與不同病毒互作機制進行綜述,有助于從不同角度拓展人們對宿主抗病毒天然免疫與病毒拮抗宿主天然免疫兩者的認識。
1 ZAP蛋白的發現及其結構特征
ZAP蛋白又稱為PARP13、ZC3HAV1,是一種RNA結合蛋白,可調節特定mRNA的合成、穩定性和翻譯[1]。2002年中國科學院Gao等[2]在篩選抗Moloney鼠白血病病毒(moloney murine leukemia virus,M-MLV)增殖的宿主因子時首次發現了ZAP蛋白,并將其鑒定為宿主限制性因子。人類ZAP蛋白主要存在兩種剪接變異體,分別為長鏈的ZAP(ZAPL)和短鏈ZAP(ZAPS),2019年研究又發現了超長鏈的ZAP(ZAPXL)和中鏈的ZAP(ZAPM)兩種新的存在形式[3-4]。ZAPL和ZAPS的N端包含4個與RNA結合的保守鋅指基序,每個基序都有半胱氨酸-組氨酸重復,呈cys-cys-cys-his(CCCH)構型[5]。ZAPL的C端含有多聚ADP核糖聚合酶(PARP)樣結構域,該結構域在ZAPS中,因此ZAPL與ZAPS的結構僅在C末端存在差異[6]。ZAP蛋白主要位于細胞質中,可通過核轉運信號蛋白1(CRM1)依賴的方式在細胞核和細胞質之間穿梭,進而發揮調節RNA穩定性等功能[6-7]。
2 ZAP蛋白在抗病毒天然免疫反應中的作用
自發現ZAP蛋白有抗M-MLV的增殖后,人們對其抗病毒功能的研究逐漸拓展到其他RNA病毒和一些DNA病毒。截止目前,已經證實ZAP蛋白的抗病毒譜包括豬繁殖與呼吸綜合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)和M-MLV在內的RNA病毒及鼠γ皰疹病毒68和乙型肝炎病毒在內的DNA病毒,該蛋白能夠結合靶病毒上的ZAP敏感元件(ZAP-responsive element,ZRE),并依賴不同機制抑制靶病毒的復制。研究發現,ZAP蛋白主要通過抑制病毒RNA合成、降解病毒mRNA或抑制病毒mRNA翻譯,介導病毒靶蛋白泛素化降解等多種途徑,在RNA水平和蛋白水平抑制病毒的復制從而起到抗病毒作用。
2.1 抑制病毒RNA合成
PRRSV是動脈炎病毒科的一種RNA病毒,Nsp9蛋白和N蛋白分別是其非結構蛋白和結構蛋白,Nsp9可與N蛋白相互作用以調節病毒RNA的生物合成。Zhao等[8]報道,Marc-145細胞中ZAP蛋白可以通過其鋅指基序與Nsp9的150至160位氨基酸殘基相互作用,阻礙病毒RNA的合成,最終抑制PRRSV的復制,并且僅在病毒復制早期階段起抑制作用。
2.2 降解病毒mRNA
2.2.1 ZAP蛋白與Moloney鼠白血病病毒(M-MLV)
M-MLV是逆轉錄病毒科的一種RNA病毒。Gao等[2]在篩選M-MLV宿主限制因子時,首次發現了ZAP蛋白的抗病毒功能。研究結果表明,ZAP蛋白能夠與病毒的3′長末端重復序列(3′-LTR)相互作用,并通過其鋅指基序介導3′-LTR序列的降解,最終抑制Rat2細胞中M-MLV的復制。
2.2.2 ZAP蛋白與辛德畢斯病毒(sindbis virus,SINV)
SINV是披膜病毒科的一種RNA病毒。Kozaki等[9]研究報道,ZAP蛋白通過其鋅指基序與病毒mRNA結合,誘導mRNA降解從而起到抗病毒作用。為了深入研究動物水平ZAP蛋白在SINV感染中的作用,Wang等[10]構建ZAP基因敲除小鼠模型,而后制備野生型小鼠和基因敲除小鼠的胚胎成纖維細胞(MEF),感染SINV后,ZAP基因敲除型小鼠比野生型小鼠的MEF細胞中存在更高的病毒載量,另外發現感染病毒后,10日齡的ZAP基因敲除小鼠比野生型小鼠有更高的死亡率。這些結果表明,ZAP蛋白有抗SINV的作用。
2.2.3 ZAP蛋白與埃博拉病毒(ebola virus,EBOV)和馬爾堡病毒(marburg virus,MARV)
EBOV和MARV同屬絲狀病毒科EBOV,L蛋白屬于它們的結構蛋白。Muller等[11]研究表明,ZAP蛋白在EBOV和MARV感染宿主Rat2細胞過程中起到重要的抗病毒作用,ZAP蛋白是通過其鋅指基序與EBOV和MARV的L基因的mRNA相互作用,最終抑制它們在Rat2細胞中的復制。
2.2.4 ZAP蛋白與鼠異嗜性鼠白血病病毒相關病毒(xenotropic murine leukemia virus-related virus,XMRV)
XMRV是逆轉錄病毒科的一種RNA病毒,Wang等[12]報道,ZAP蛋白可以抑制XMRV在293T細胞中的復制,其機制是ZAP蛋白能夠與病毒mRNA的3'UTR相互作用并介導其降解,最終抑制病毒在293T細胞中的復制。
2.2.5 ZAP蛋白與戊型肝炎病毒(hepatitis E virus,HEV)
HEV是戊型肝炎病毒科的一種RNA病毒。龍飛燕等[13]研究發現,ZAP蛋白在HIV感染A549細胞后顯著上調,過表達ZAP能夠有效抑制HIV的復制,相反,干擾ZAP后顯著促進HIV的復制,且研究表明,ZAP蛋白是通過特異性結合HIV的5′UTR,并介導其降解從而起到抗病毒作用。為了分析在BALB/c小鼠體內ZAP蛋白是否也能夠抑制HIV的復制,該團隊通過尾靜脈注射不同濃度的ZAP質粒后,再注射HIV進行定量分析。結果表明,小鼠體內過表達ZAP可以抑制HIV的復制,且抑制作用呈ZAP質粒濃度依賴性。
2.2.6 ZAP蛋白與柯薩奇病毒B3(coxsackie virus B3,CVB3)
CVB3是小RNA病毒科的一種RNA病毒。Li等[14]研究表明,感染CVB3的HeLa細胞中,ZAP的mRNA和蛋白質水平在24 h增加,并在48 h達到峰值,而后在72 h開始下降,并且HeLa細胞中ZAP蛋白可以通過靶向CVB3的3′和5′UTR的降解來抑制CVB3的復制。為深入研究ZAP蛋白在動物水平是否也具有抗CVB3的作用,該團隊進一步構建了BALB/c小鼠ZAP過表達模型,與對照組相比,ZAP過表達小鼠心臟病毒載量更低,心肌炎損傷程度較輕。以上結果說明,ZAP蛋白在小鼠體內可以抑制CVB3的復制。
2.2.7 ZAP蛋白與鼠γ皰疹病毒68(murine gammaherpes virus 68,MHV68)
MHV68是皰疹病毒科的一種DNA病毒,M2蛋白屬于其結構蛋白。Xuan等[15]首次將ZAP的抗病毒譜拓展至DNA病毒,研究報道稱,ZAP蛋白能夠通過與病毒M2基因mRNA的3′非翻譯區(3′UTR)相互作用并誘導其降解,從而抑制MHV68在293T細胞中的復制。
2.2.8 ZAP蛋白與乙型肝炎病毒(hepatitis B virus,HBV)
HBV是嗜肝DNA病毒科的一種DNA病毒,Mao等[16]研究表明,HepG2細胞中ZAP蛋白可以通過其鋅指基序與HBV RNA末端冗余序列相互作用,并介導其降解從而起到抗病毒作用。Chen等[17]構建ZAP過表達小鼠模型發現,感染病毒后ZAP過表達小鼠肝臟相比于對照組存在更低的病毒mRNA。以上結果說明,ZAP蛋白能夠抑制小鼠體內HBV的復制。
2.3 降解病毒mRNA和抑制病毒mRNA的翻譯協同作用
2.3.1 ZAP蛋白與人類免疫缺陷病毒(human immunodeficiency virus,HIV)
HIV是逆轉錄病毒科的一種RNA病毒,截止目前,在ZAP蛋白針對HIV起到重要抗病毒作用及其機制方面的研究較深入。試驗證明,ZAP蛋白主要通過誘導病毒mRNA降解或抑制病毒mRNA的翻譯兩個途徑起到抗HIV的作用。
第一,誘導病毒mRNA的降解。Zhu等[18-20]報道,ZAP蛋白是通過與HIV mRNA的5′UTR結合并誘導其降解從而起到抗病毒作用,具體作用機制包括以下兩個方面。一方面,ZAP蛋白與病毒mRNA的特異序列直接結合后,募集聚腺苷酸特異性核糖核酸酶(PARN)以去除3′poly(A)尾巴,而后進一步通過招募RNA外切酶加工復合體exosome從3′端介導病毒mRNA的降解;另一方面ZAP蛋白也可依賴其輔助因子p72(RNA解螺旋酶)募集脫帽復合體Dcp1/2以去除病毒mRNA的5'帽子結構,而后進一步通過5′外切酶Xrn1從5′端降解暴露的病毒mRNA。
第二,抑制病毒mRNA的翻譯。Zhu等[21]研究表明,ZAP蛋白能夠通過干擾翻譯起始因子eIF4A和eIF4G之間的相互作用來抑制HIV mRNA的翻譯。
2.3.2 ZAP蛋白與日本乙型腦炎病毒(Japanese encephalitis virus,JEV)
JEV是黃病毒科的一種RNA病毒,報道ZAP的過表達顯著抑制JEV在A549細胞中的復制,ZAP蛋白能夠通過其鋅指基序與病毒mRNA的3′UTR序列結合,并介導病毒mRNA的降解或干擾病毒mRNA的翻譯,從而抑制JEV在A549細胞中的復制[22]。
2.4 介導病毒靶蛋白泛素化降解和降低PB2 mRNA水平或抑制其翻譯協同作用
甲型流感病毒(influenza A virus,IAV)是正黏病毒科的一種RNA病毒,PA、PB2、NA屬于其結構蛋白。最初,報道ZAPL能夠通過其PARP結構域結合PA和PB2蛋白,介導它們泛素化進而被蛋白酶降解,最終抑制IAV在293T細胞中的復制[23]。而后的研究發現,盡管缺乏PARP結構域,HeLa細胞中ZAPS仍然可以通過降低PB2基因mRNA水平并干擾其翻譯,進而抑制IAV的復制,并且這種抑制作用局限于病毒復制的早期階段[24]。
2.5 ZAP蛋白與其他RNA病毒
塞姆利基森林病毒(semliki forest virus,SFV)、羅斯河病毒(ross river virus,RRV)、委內瑞拉馬腦炎病毒(venezuelan equine encephalitis virus,VEEV)同屬于披膜病毒科的RNA病毒。Bick等[25]報道,ZAP蛋白在細胞水平能夠抑制上述病毒的復制。
禽白血病病毒J亞群(avian leukosis virus subgroup J,ALV-J)是逆轉錄病毒科的一種RNA病毒。Zhu等[26]研究表明,ZAP的mRNA和蛋白質水平分別在ALV-J感染DF-1細胞后24 h和48 h極度顯著升高,然后在72 h開始降低,通過在DF-1細胞中過表達,ZAP能夠顯著抑制ALV-J的復制。
3 ZAPS通過激活RIG-I介導的I型干擾素反應調節天然免疫應答
病毒入侵時,宿主首先通過天然免疫應答來抵抗病毒感染,由模式識別受體觸發,包括RIG-I樣受體和Toll樣受體等[27-28]。在RIG-I樣受體信號通路中,RIG-I識別病毒RNA結合并激活線粒體抗病毒信號蛋白(MAVS),該蛋白通過激活胞質IκB激酶(IKK)和TANK結合激酶1(TBK1)進而分別刺激核轉錄因子(NF-κB)和干擾素調節因子3(IRF3)。NF-κB和IRF3協同誘導干擾素β(IFN-β)和其他抗病毒分子的產生[29-32]。
Hayakawa等[33]研究發現,ZAPS能夠通過其鋅指結構與RIG-I相互作用,進而激活NF-κB與IRF3信號通路,最終增強RIG-I介導的I型干擾素的產生。試驗結果表明,293T細胞中ZAPS能夠通過增強IFN-β的表達最終抑制流感病毒H3N2的復制,另外,ZAPS能夠通過增強A549細胞中IFN-β的表達最終起到抗新城疫病毒的作用。
4 病毒感染誘導ZAP基因表達調控的機制研究
ZAP蛋白作為一種新型宿主限制因子,病毒感染誘導其高表達,發揮著重要的抗病毒作用。Wang等[34]報道,ZAP基因的轉錄可直接由IRF3控制,也可以是病毒感染過程中干擾素自分泌或旁分泌信號轉導的結果,但不依賴于NF-κB活性。研究表明,在感染的早期,IRF3被激活并轉移到細胞核中,而后與ZAP基因啟動子結合,從而上調ZAP基因的轉錄水平,此過程獨立于干擾素信號傳導。隨后,受感染的細胞分泌IFN-β,繼而激活感染細胞和或未感染鄰近細胞中的JAK-STAT(janus family of tyrosine kinase-signal transducer and activator of transcription)信號傳導,導致STATs的活化,后者轉移到細胞核中與ZAP基因啟動子結合并維持ZAP基因的表達。
5 ZAP蛋白的表達調控及其抗病毒等機制總結
ZAP蛋白的合成需要經過轉錄、翻譯,其中轉錄水平受到IFNβ、IRF3的調控。一方面,ZAP蛋白可作為宿主限制因子,主要通過抑制病毒RNA合成、降解病毒mRNA或抑制病毒mRNA翻譯和介導病毒靶蛋白泛素化降解等多種途徑在RNA水平和蛋白水平抑制病毒的復制,但其對不同病毒的抗病毒機制不盡相同,具體機制見表1。
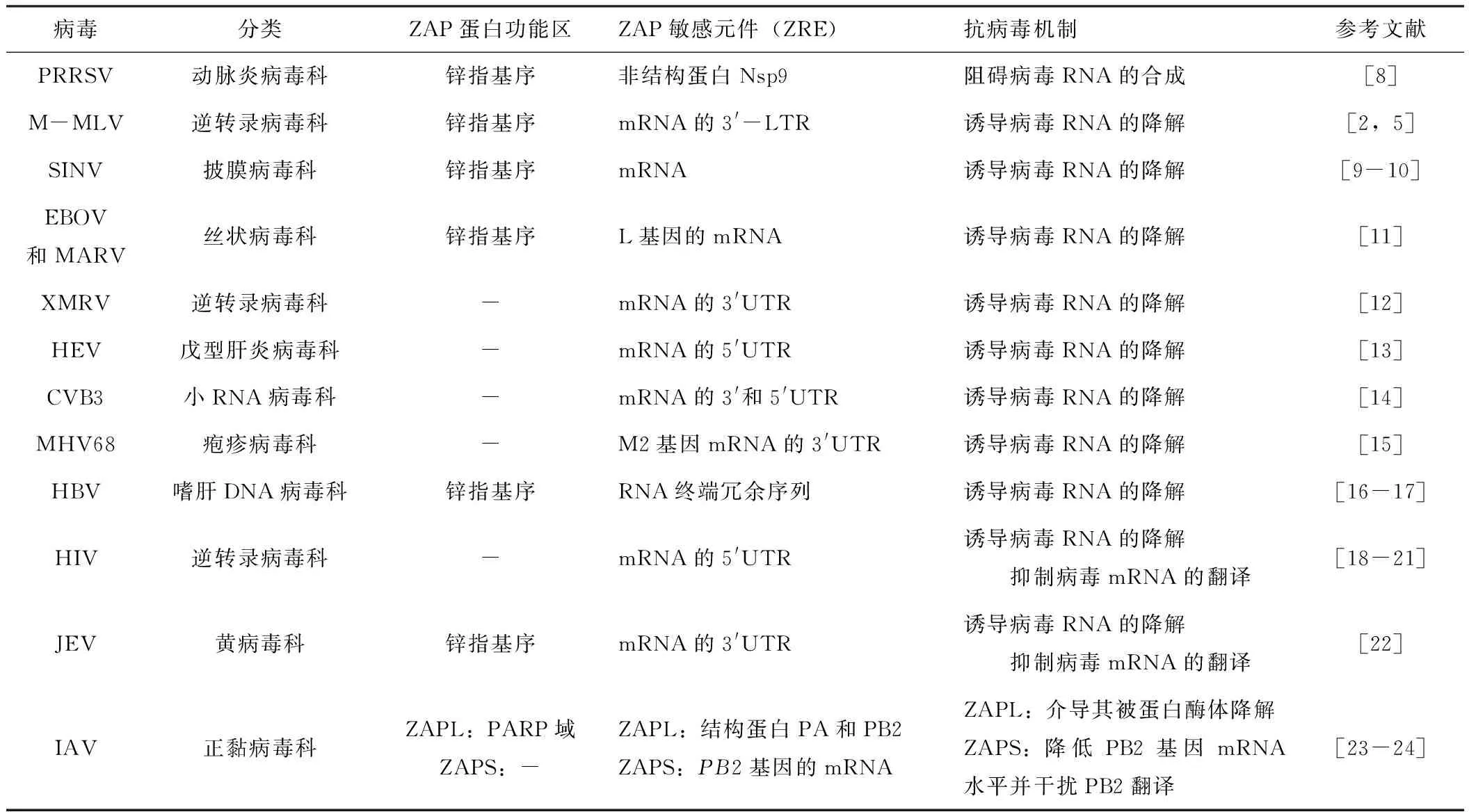
表1 ZAP蛋白在抗病毒天然免疫中的作用
另一方面,ZAP蛋白可作為免疫調節因子,通過增強RIG-I介導的I型干擾素反應誘導抗病毒因子的產生,從而發揮抗病毒作用,具體機制見圖1。
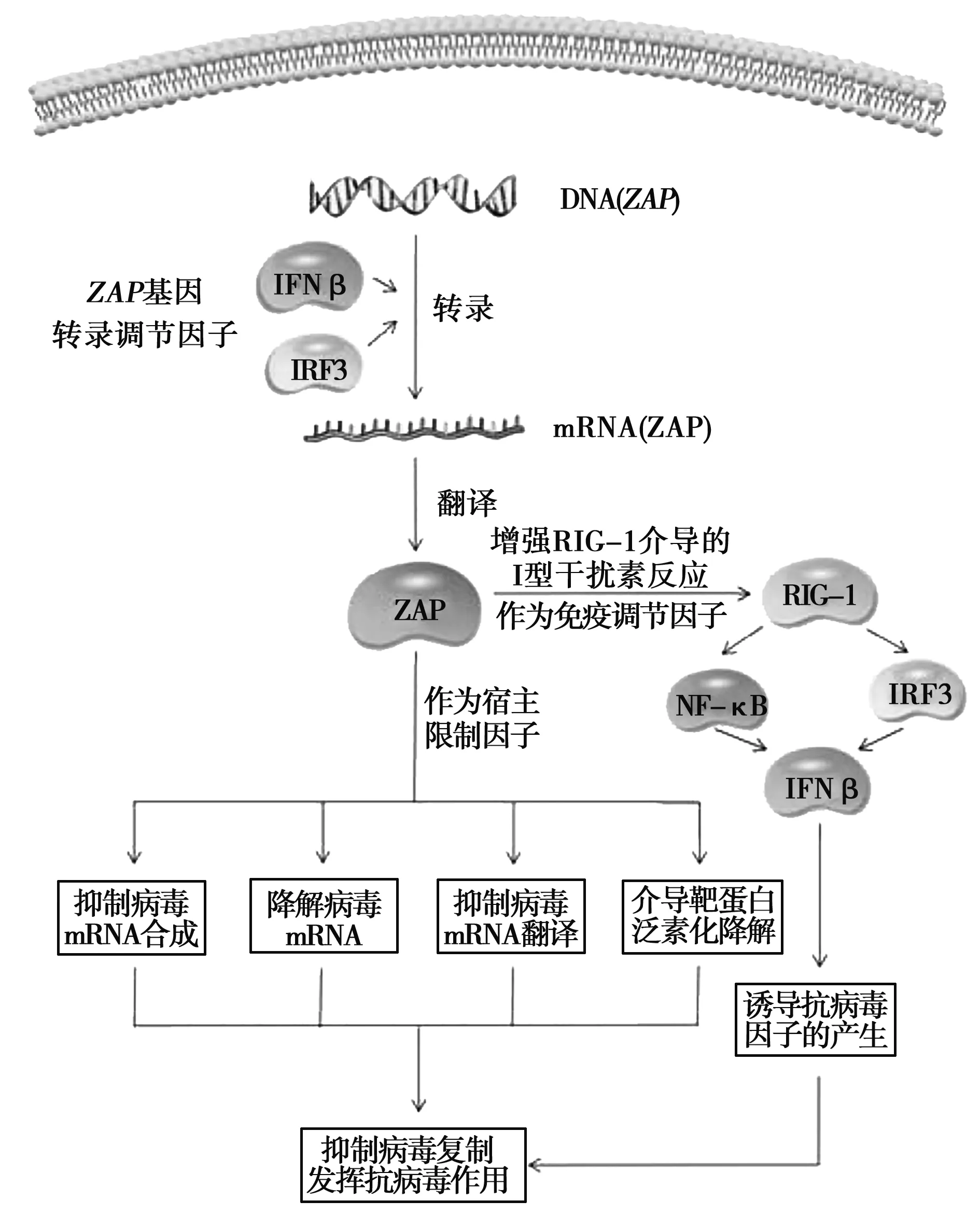
圖1 ZAP蛋白的表達調控及其抗病毒等機制
6 不同病毒拮抗ZAP蛋白介導的宿主天然免疫應答
天然免疫系統的細胞(如巨噬細胞)可表達模式識別受體(pattern recognition receptor,PRR),以識別病原體相關的分子模式(pathogen-associated molecular patterns,PAMP),啟動細胞內信號轉導通路,誘導分泌細胞因子或趨化因子,發揮抗感染作用。病毒感染能夠激活天然免疫應答并誘導包括ZAP在內抗病毒因子的表達,其可在病毒感染的不同階段抑制病毒的復制[35]。同時,在與宿主免疫系統相互作用的過程中,不同病毒也已進化出一系列拮抗ZAP蛋白介導的天然免疫應答抗病毒途徑,來滿足自身復制的需要,主要包括抑制ZAP基因mRNA合成、降解ZAP基因mRNA、降解ZAP蛋白和抑制ZAP蛋白與靶病毒的mRNA或目標蛋白結合等多種機制。
6.1 抑制ZAP基因mRNA合成
MicroRNA(miRNA)是一類長度約為22 個核苷酸的非編碼單鏈RNA分子,它能夠通過與目標mRNA特異結合,從而抑制轉錄后基因的表達。Kincaid等[36]報道,托克特諾病毒(torque teno virus,TTV)編碼的TTV-tth8miRN能夠通過靶向N-Myc相互作用因子(NMI)抑制干擾素信號通路,從而促進病毒逃避宿主免疫應答。
牛病毒性腹瀉病毒(bovine viral diarrhea virus,BVDV)是黃病毒科的一種RNA病毒。劉升[37]報道,BVDV感染宿主細胞MDBK后18至48 h內,ZAP基因mRNA水平顯著下降,而過表達ZAP的MDBK細胞顯著抑制病毒的復制,表明BVDV能夠通過某種機制抑制ZAP的轉錄,從而拮抗ZAP蛋白的抗病毒活性。該研究同時發現,BVDV感染后能夠提高miR-2459的表達,miR-2459可直接靶向ZAP基因3′UTR區的miRNA識別位點并導致其轉錄水平的下降,從而促進BVDV在細胞中的復制。
6.2 降解ZAP基因mRNA
I型單純皰疹病毒(herpes simplex virus 1,HSV-1)是皰疹病毒科的一種DNA病毒。UL41屬于其非結構蛋白,是一種具有RNase活性的核酸內切酶。Murphy等[38]報道,UL41可以通過多種機制抑制IFN介導的抗病毒反應。Su等[39]研究表明,ZAP蛋白并不能抑制HSV-1在293T細胞中的復制,但過表達ZAP能夠顯著抑制UL41突變失活的HSV-1在宿主細胞中的復制。該研究發現,HSV-1是通過UL41的RNase促進ZAP基因mRNA的降解,從而拮抗ZAP蛋白的抗病毒活性。
6.3 降解ZAP蛋白
6.3.1 腸道病毒A71型(enterovirus A71,EV-A71)與ZAP蛋白
EV-A71是微RNA病毒科的一種RNA病毒,結構蛋白VP1和非結構蛋白3C蛋白酶(3Cpro)在病毒與宿主互作過程中起到重要作用。多項研究表明,EV-A71已進化出多種逃逸宿主細胞I型干擾素反應的策略,從而起到拮抗宿主天然免疫的作用[40-42]。Xie等[43]報道,在EV-A71感染過程中,HeLa細胞中ZAPL基因的mRNA表達顯著上調,而ZAP蛋白水平卻顯著下降,尤其在感染后30 h最為明顯。此外,過表達ZAPL可降低VP1及3C蛋白的表達即抑制病毒的復制,且EV-A71的3C蛋白能夠通過其蛋白酶活性介導ZAP蛋白的切割,從而拮抗宿主天然免疫。
6.3.2 PRRSV與ZAP蛋白
nsp4、nsp7β、nsp9、nsp12均屬于PRRSV的非結構蛋白,其中nsp4屬于典型的具有切割活性的3C樣絲氨酸蛋白酶,Chen等[44]報道,nsp4能夠通過抑制IFN-β的轉錄從而起到拮抗宿主天然免疫的作用。楊玉婷[45]研究表明,ZAPL與ZAPS的過表達均能顯著抑制MARC-145細胞中PRRSV的復制,且nsp4能夠呈劑量依賴性識別ZAP第411位谷氨酸并切割ZAP蛋白,從而拮抗ZAP蛋白介導的抗病毒作用,此過程不依賴細胞凋亡和細胞自噬途徑。
6.4 抑制ZAP蛋白與靶病毒的mRNA或目標蛋白結合
NS1IAV的非結構蛋白之一。許多研究表明,NS1蛋白在流感病毒拮抗宿主天然免疫作用中扮演著重要角色,例如它可以通過抑制三聯基序蛋白25(TRIM25)的E3連接酶活性,限制流感病毒感染誘導的I型干擾素的產生[46]。ZAPL與ZAPS在IAV感染過程中均起到顯著的抗病毒作用,Liu等[23]報道,IAV的PB1蛋白能夠促使ZAPL、PA和PB2的解離,保護PA和PB2蛋白免受蛋白酶體的降解,從而起到拮抗ZAPL抗病毒活性的作用。Tang等[24]研究發現,IAV的NS1蛋白能夠抑制ZAPS與病毒mRNA的結合,拮抗ZAPS的抗病毒作用。
7 總結與展望
作為新型抗病毒因子,ZAP蛋白可通過抑制RNA合成、降解mRNA或抑制mRNA翻譯、介導靶蛋白泛素化降解等多種途徑直接或間接抑制RNA或DNA病毒的復制,從而在宿主抗病毒天然免疫應答中發揮重要作用,此外,它還能通過激活RIG-I介導的I型干擾素反應調節天然免疫。同時,在與宿主免疫系統斗爭的過程中,病毒也已進化出多種拮抗ZAP蛋白介導的抗病毒天然免疫應答機制,包括抑制ZAP mRNA合成,降解ZAP mRNA,降解ZAP蛋白和抑制ZAP蛋白,與靶病毒的mRNA或目標蛋白結合等。
ZAP蛋白能夠通過其不同抗病毒功能區結合靶病毒上的ZAP敏感元件,并依賴不同機制抑制靶病毒的復制,但ZAP并非對所有病毒都具有抗病毒作用。Bick等[25]研究表明,水泡性口炎病毒、脊髓灰質炎病毒、黃熱病病毒在ZAP過表達的細胞中仍可正常復制,這些現象背后的分子機制是什么,ZAP蛋白在發揮抗病毒作用過程中,又是哪些因素決定著其抗病毒功能區和靶病毒上ZAP敏感元件的選擇,這些問題還有待進一步深入研究。

